流固耦合分析技术在胸主动脉血管瘤诊疗中的应用
2021-03-04吴晨晖
雷 倩,吴晨晖
(1.武汉大学中南医院,武汉430064;2.武汉第二船舶设计研究所,武汉430064)
0 引言
胸主动脉血管瘤是一种严重的、致命的心血管疾病,其形成原因主要是动脉管壁薄弱且受血管内压力影响,使胸主动脉扩张(常呈进行性膨大)。胸主动脉血管癌瘤体越大,破裂的可能性越大。但此病在临床上比较少见,常见的发病原因有高血压、动脉硬化、先天缺陷、感染、外伤等。40%的胸主动脉血管瘤患者没有症状,常在体检或胸部X射线、超声心动图、CT或MRI等检查中发现[1-4]。一般来说,胸主动脉血管瘤患者可能出现胸部搏动性的肿物,有时会出现栓塞,甚至有的患者还会出现瘤体破裂,常危及患者的生命。且胸主动脉血管瘤如果不治疗的话,不可能自愈,瘤体一旦破裂,会导致患者出现死亡,因此提倡早诊断、早治疗。临床上通过胸主动脉血管瘤的瘤径大小来判断其严重程度和危险性。如果瘤径大于5 cm,其破裂的可能性就很大,需要进行手术治疗[5]。
目前研究认为,血流动力学方面的因素是血管瘤产生的重要因素,包括壁面压力、血流速度、壁面剪切应力等多个方面[6-9]。流固耦合力学是流体力学与固体力学交叉融合生成的一门力学分支,兼顾考虑两相介质之间的相互作用,固体在流体载荷作用下会产生变形或运动,同时变形或运动又反过来影响流体,从而改变流体载荷的分布和大小。血液和血管系统物理特性的研究重点是血液流动和血管壁表面的物理量,因此对血管瘤组织结构进行流固耦合计算得到的结果会比假设血管壁为刚性壁面更加准确。
陈广新等[6]基于个体化CT血管造影影像数据构建了脑动脉瘤流固耦合模型,计算了一个心动周期的动脉瘤血流动力学参数,并就动脉瘤的发生、发展及破裂的血流动力学因素进行了分析。张光武等[7]采用与动脉瘤等壁厚的模型研究了血流特性参数及瘤体受力变形情况。韩嘉玮等[8]应用流固耦合方法对2种常见动脉瘤载瘤血管与血液之间的相互作用基于有限元计算研究了载瘤血管内血液流速和管壁应力,得到了最容易破坏的区域以及破坏形式。任国荣等[9]介绍了颅内动脉瘤的血流动力学研究流程,综述了颅内动脉瘤的血流动力学研究进展。但现有的研究主要是针对血管瘤在血液作用下的物理特性变化,尚未将血管瘤的各项变化与诊疗方案相结合,未能辅助临床中治疗方案决策。本文针对武汉大学中南医院心内科某病例开展研究(经患者及家属知情同意),通过对血管瘤血液作用下力学响应的计算,分析血管瘤的破坏机理,并基于此针对性地提出诊疗建议方案。
1 胸主动脉血管瘤建模
1.1 双向流固耦合力学模型
血管中的血液流动过程遵循质量守恒、动量守恒、能量守恒三大定律。流体分析中只需求解质量守恒方程和动量守恒方程即可,故本研究仅求解两大定律方程。
质量守恒方程如下:

式中,ρf为血液密度;t为时间;v为速度矢量[10]。
动量守恒方程如下:
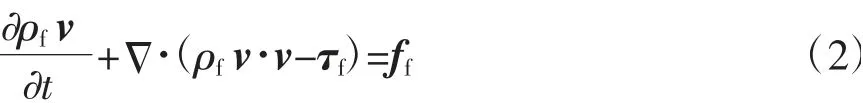
式中,ff是血液体积力矢量;τf是血液的剪切力张量。
血管瘤组织模型控制方程可表达为

式中,σs为血管及血管瘤的应力张量;ρs为血管及血管瘤密度;as为血管及血管瘤加速度。在流固耦合交界面上,变量的传递方程应满足:

式中,ds为固体应力;df为流体应力;ns为固体边界法向量;nf为流体边界法向量;μs为固定体摩擦系数;μf为液体摩擦系数。
1.2 模型的三维重建
本研究中血管瘤模型的数据来源于武汉大学中南医院。使用三维阈值分割及三维区域增长分割方法提取3D胸主动脉血管瘤表面模型[11],将获得的3D胸主动脉血管瘤模型以STL格式导入工程软件CATIA进行光顺表面线型优化,最终获得血管瘤及其内部血液的3D模型,如图1所示。由于血栓可能降低了血管瘤壁所受的切应力[12-14],因此在建模时简化了血栓结果,截用了部分瘤体作为研究对象。

图1 胸主动脉血管瘤模型
1.3 边界条件与求解设置
本研究定义的模型中血液为不可压缩的层流牛顿流体,血管壁无血流渗透且与血流之间无滑动。设置血液密度为1 060 kg/m3,血液黏性系数为常数0.003 5 Pa·s。由于胸主动脉内血液的雷诺数为600~700[15],所以组织内血液流动属于层流状态。
血管瘤和血管为各向同性线弹性材料,故血管瘤密度为1 120 kg/m3,弹性模量为5.0 MPa,泊松比为0.45[16],承载能力为650 kPa[17]。
血液在动脉中的流动为脉动流,可通过UDF方法设置血管的入口速度为一个心动周期的速度函数,入口速度边界条件如图2所示[18]。流体分析时设置入口参数为速度,出口为自由流出,压力为0 Pa。

图2 入口流速边界条件[18]
2 流固耦合分析结果
通过流固耦合力学分析进行数值模拟计算,可以了解血管瘤在一个心跳周期内某个时刻的血液流动状态,从而分析血管瘤内血液流动情况和血管瘤受力变化情况。
2.1 血液流速分析
图3 为0.1 s时血管瘤对称截面流线图,此时入口速度为0.55 m/s,从图中截取A、B 2个部分进行讨论,如图4、5所示。从图4中可以看出,血流在血管即将进入血管瘤处出现旋涡,为局部最大值。从图5中可以看出,在瘤体背部出现局部旋涡,其他区域均为层流分布。血液沿血管轴向速度递减的趋势依旧存在,在血管中心线附近血流速度最快。
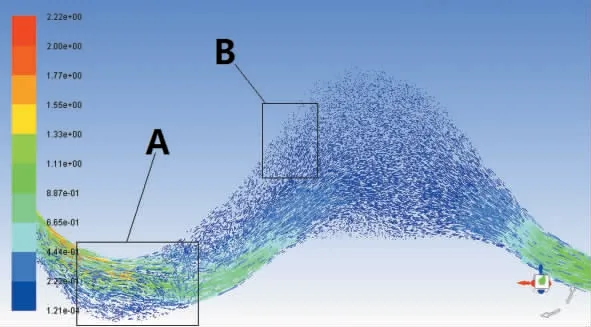
图3 t=0.1 s时血管瘤对称截面流线图

图4 t=0.1 s时血管瘤对称截面A放大图

图5 t=0.1 s时血管瘤对称截面B放大图
为探讨血管瘤在一个心跳收缩周期内血液流动的流场变化,分别提取t=0、0.10、0.20、0.30、0.35、0.40 s时(对应入口流速v=0.04、0.55、0.37、0.02、-0.10、0.09 m/s)瘤体入口、瘤体出口、瘤体中心3个区域流速及最大流速,详见表1。
血管瘤瘤体内部流速变化趋势如图6所示。随着血液流速变化,血管瘤内流速与入口流速变化趋势基本一致。0~0.10 s内,血管中血流速度不断增大,呈层流状态,血管瘤约30%的区域呈现出较高流速状态,瘤内的局部血流形成涡流。0.10~0.30 s内,流场形态并无较大变化,血流速度逐渐降低。0.30~0.40 s内,由于心室舒张,室内压下降,主动脉内血液向心室方向反流,所以出现了轴向速度回流和血液倒流现象。

表1 血管瘤瘤体内部在心跳收缩期内各时刻流速数据表单位:m/s

图6 血管癌瘤体内部流速变化曲线
血管瘤区域血液流速较血管流速低,血管瘤与血管连接区域较血管瘤区域流速高。血管瘤中血液流动形成局部涡流,有可能导致红细胞和其他物质堆积。而血液过瘤腔经左侧瘤颈处流入载瘤动脉,会对血管瘤与血管连接区域形成明显冲击,对该处组织结构不利。
2.2 血管瘤组织变形分析
血管瘤壁面变形与血管瘤增生关系密切,血管瘤壁面变形过大,容易导致血管瘤破裂。通过流固耦合计算得到各个时刻血管瘤组织变形情况。选择血管瘤组织出现最大变形时刻t=0.10、0.35 s的位移云图进行分析,如图7、8所示(显示比例为3倍)。
当t=0.10 s时,血管中血液流速v=0.55 m/s,血管瘤与血管组织呈现外凸趋势,整体组织最大位移约为10.332 mm,主要发生在血管瘤侧部中间区域,其次是血管瘤顶部区域。血管瘤下部呈现明显的内凹趋势,最大位移约为5.166 mm。血管瘤整体变形明显大于血管区域,整体呈现上部和侧部外凸、下部内凹的趋势。

图8 t=0.35 s时血管瘤组织位移云图(显示比例为3倍)
当t=0.35 s时,血管中血液流速v=-0.1 m/s,血管瘤与血管组织呈现内凹趋势,整体组织最大位移约为0.345 mm,主要发生在血管瘤侧部中间区域,其次是血管瘤顶部区域。血管瘤下部呈现轻微的外凸趋势,最大位移约为0.173 mm。血管瘤整体变形依旧大于血管区域,整体呈现侧部内凹、上部和下部外凸的趋势。
为观测血管瘤在心跳收缩期全时刻变化情况(如图9所示),设定血管瘤的横截面有A、B、C、D 4个位置,提取各位置在t=0、0.10、0.20、0.30、0.35、0.40 s时的综合位移值,其中数据向外为正,向内为负,详见表2。

图9 血管瘤横截面A、B、C、D 4个位置示意图

表2 血管瘤在心跳收缩期内各时刻位移数据表单位:mm
由图10所示的血管瘤组织位移变化曲线可知,在0~0.30 s时,血管瘤两侧及上部外凸,下部内凹;在0.30~0.40 s时,血管瘤下部外凸,两侧及上部内凹。随着时间的变化,血管瘤整体组织呈现出“呼吸式”往复位移变化,血管瘤组织变形最大值随血液流速变化,两侧变化率较上、下部大。

图10 血管瘤横截面中A、B、C、D 4个位置的位移变化曲线
现实情况下,血管瘤的变形会受周围组织液和肌肉限制,使得血管瘤的变形量减少。但由于血管瘤区域的高频率、周期性变化,两侧组织疲劳失效,可以推断在血管壁上已经出现老化问题,应针对该问题辅助药物治疗,以增强血管壁弹性。同时当血流速度最高时,血管瘤组织变形最大,因此在日常生活应注意控制血压,避免情绪激烈变化或剧烈运动引起的血压大幅波动。
2.3 血管瘤组织受力分析
高应力部位是最容易发生材料破坏的位置,也是导致血管瘤破裂的高风险位置。取心跳周期中血液流速最大时刻进行分析。当t=0.10 s时,血管瘤组织von-Mises应力云图如图11所示,血管瘤组织的最大剪切应力云图如图12所示。可以看出,在血管瘤侧部中间区域出现最大von-Mises应力和最大剪切应力,最大von-Mises应力为75.2 kPa,约为血管瘤承载能力(650 kPa)的11.6%,最大剪切应力约为41.7 kPa,处于许用的应力范围内。
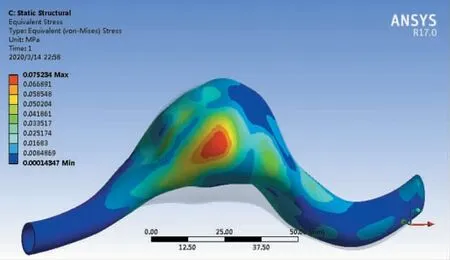
图11 t=0.10 s时血管瘤组织von-Mises应力云图

图12 t=0.10 s时血管瘤组织最大剪切应力云图
为观测血管瘤在心跳收缩期的全时刻变化情况,提取t=0、0.10、0.20、0.30、0.35、0.40 s时刻的最大von-Mises应力和最大剪切应力,详见表3。
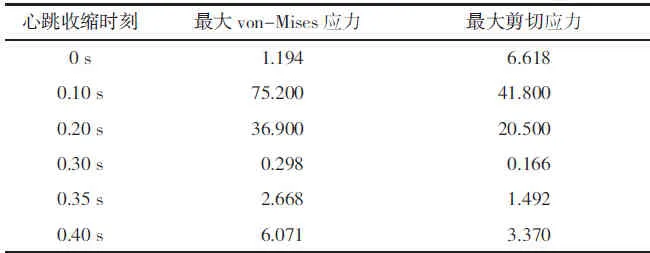
表3 血管瘤在心跳收缩期内各时刻的应力数据表单位:kPa
随着心跳周期发生变化,最大von-Mises应力和最大剪切应力出现在第0.1 s,得到的计算结果与实际情况相符。马小奇等[19]在脑动脉瘤增长模型中计算出血管瘤最大von-Mises应力约为40 kPa;韩嘉玮等[8]计算的囊形动脉瘤中血管瘤的最大von-Mise应力为5.174 kPa。上述研究结果与本研究的计算结果较为相近,证明了本研究结果的合理性。
真实情况下由于血管瘤处的血管已发生病变,承载能力大幅下降。从计算结果来看,血管瘤两侧处的应力相比其他部位较大,引起部分血管区域呈现较高应力状态,这对患者的安全极其不利。
3 结语
本文准确地建立了胸主动脉血管瘤双向流固耦合数值模型,应用流固耦合分析方法研究弹性载瘤血管与不可压缩黏性血液的相互作用对胸主动脉血管瘤血流特性参数变化及瘤体受力变形的情况,分析了血管瘤中血液流动的流场变化以及血管壁、瘤壁的变形和应力,能清晰、准确地反映血管瘤内的血流特性,对预测血管瘤物质堆积、破裂能提供更有效的依据。主要研究结论有:
(1)血管瘤区域血液流动形成明显的涡流,有可能导致物质堆积。
(2)血液过瘤腔经左侧瘤颈处流入载瘤动脉,并对血管瘤与血管连接区域形成明显冲击,这对该处组织不利。
(3)在血流周期内,血管瘤组织整体呈现出“呼吸式”往复形位移变化,且血管瘤组织变形最大值随血液流速变化,两侧变化率较上、下部大。由于血液流动呈现正负交替的现象,可以预计该循环作用将导致血管瘤在连接区域出现疲劳现象。
(4)血管瘤组织内的最大von-Mises应力为75.2 kPa,约为血管瘤承载能力(650 kPa)的11.6%。由于血管瘤组织已发生病变,其真实承载能力较差,随时存在破裂的危险。
从计算结果来看,本文提出的方法对临床上胸主动脉血管瘤危险部位的预测是有效的,可以为临床诊治提供依据。但由于临床上所见的血管瘤瘤壁常伴有粥样硬化斑块,实际的应力结果会随之发生变化,因此还需要进一步完善血管瘤模型。
