桃NHX基因家族的全基因组鉴定与表达分析
2021-03-01李淼李桂祥刘伟高晓兰王孝友张安宁
李淼 李桂祥 刘伟 高晓兰 王孝友 张安宁


摘要:本研究利用生物信息学方法从桃全基因组数据库筛选出7个NHX反向转运体,并对其序列特征、基因结构、进化关系、亚细胞定位、组织表达谱和盐胁迫响应性进行综合分析。结果表明,7个桃NHX具有清晰的亲缘远近关系;5个桃NHX(NHX1,NHX4~NHX7)基因在结构等方面具有相似性,亲缘关系较近,而与NHX2和NHX3亲缘关系较远。7个桃NHX蛋白在N端具有明显的跨膜结构区域。顺式元件分析表明,桃NHX基因家族上游启动子区域包含與光信号、激素、逆境胁迫及分生组织表达相关的顺式作用元件。qRTPCR分析结果显示,大多数桃NHX家族成员在茎中表达较多;所有桃NHX成员对外源盐处理具有响应性。
关键词:桃;NHX基因家族;全基因组;基因表达
中图分类号:S662.1:Q781文献标识号:A文章编号:1001-4942(2021)12-0008-09
Na+/H+反向转运体(Na+/H+ transporters,NHX)在植物耐盐性方面发挥着重要作用[1]。NHX能将Na+(K+)区域化或排出细胞外以保持植物细胞内较低水平的Na+(K+)浓度,避免细胞受到伤害,维持其正常生理功能。NHX具有调节细胞膨压、维持细胞Na+(K+)浓度、调节细胞内pH 值的功能,是植物耐盐途径的重要因子[2-5]。
拟南芥基因SOS1和NHX1是植物中最早被克隆的NHX类基因,这两个基因分别定位于细胞的质膜和液泡膜上,分别在细胞质中Na+(K+)向胞外运输和Na+(K+)向液泡的区域化运输发挥着重要作用[6,7]。经研究,在多种植物中如水稻(OryzasativaLinanaeus)[8]、棉花(Gossypiumherbaceum Linanaeus)[9]、碱蓬(Suaeda glaucaBunge)[10]、柑桔(CitrusreticulataBlanco)[11]等均克隆到相应的同源基因。目前,数据库中发现的植物NHX类蛋白60多个。拟南芥中NHX基因家族成员共8个(AtNHX1~AtNHX8),均参与拟南芥耐盐代谢途径。在盐胁迫条件下,AtNHX1~AtNHX4定位于液泡膜上,能将Na+区隔化至液泡中[12-15];AtNHX5与AtNHX6定位在内膜体上,在调控细胞Na+(K+)、pH平衡和钾营养等方面起重要作用[5,16,17];AtNHX7和AtNHX8定位于细胞膜上,参与细胞质Na+的外排代谢,是植物抵抗盐离子毒害的首个屏障[18,19]。综上,研究NHX基因家族的亚细胞定位情况是分析NHX基因功能的重要环节。
我国盐碱化土地主要分布于北方及沿海地区,占全国可利用土地面积的4.88%[20]。日益严重的土壤盐碱化问题严重影响农业生产和生态环境,如何充分利用盐碱地资源成为农业生产发展亟需解决的问题。桃树抗逆性强,干旱、轻度盐碱条件下均可正常生长,解析桃树的耐盐分子机理和代谢途径、培育耐盐新品种可为桃树在盐碱地种植提供一条新途径。
本研究基于桃(Amygdalusdavidiana)全基因组测序结果,对桃与耐盐相关的Na+/H+反向转运体NHX基因家族进行鉴定,利用生物信息学软件对其进行分类及功能预测,并测定这些基因在植物组织的表达及受到盐胁迫转录水平的变化情况,为深入揭示NHX基因家族的生物学功能奠定基础。
1 材料与方法
1.1 植物材料与处理
供试材料为山东省果树研究所金牛山试验基地5年生山桃(Amygdalusdavidiana)的各组织(根、茎、叶、花和果实)。根、茎、叶和花采样时间是2020年3月30日,果实采样时间是2020年7月28日。样品于液氮中速冻,-80℃保存备用。
盐处理试验离体枝条采自5年生山桃,采样时间是2020年7月28日。取长势一致、健康一年生枝条分为两组:一组放入300mmol/L的NaCl盐溶液;另一组放入清水(对照)。置于人工气候箱中进行培养,设定温度25℃,相对湿度60%左右,光照强度40μmol/(m2·s)。处理0、0.5、1.0、1.5h后取样,每次每组随机选取3根枝条,每根枝条取成熟叶3片立即放入液氮中冷冻,-80℃保存,用于提取RNA进行基因表达分析。
1.2 桃NHX转录因子的鉴定与表达分析
1.2.1 桃NHX基因家族成员的检索 已报道文献显示拟南芥(ArabidopsisthalialaHeynh.)有8个AtNHXs基因成员、水稻有5个OsNHXs基因成员、胡杨(PopuluseuphraticaOliver)有6个PeNHXs基因成员。利用美国国立生物技术信息中心数据库(NationalCenterforBiotechnologyInformation,NCBI,http://www.ncbi.nlm.nih.gov)搜索上述基因的蛋白序列,利用桃基因组数据库GDR(https://www.rosaceae.org/)中BLASTP选项搜索比对。下载比对出的蛋白序列和对应的基因序列。将候选基因提交至InterProScan(http://www.ebi.ac.uk/interpro/)进行结构域验证,最终确定桃基因组NHX家族成员共7个。依据家族成员在染色体上的位置依次命名为PpNHX1~PpNHX7。
利用网站ExPASy(https://web.expasy.org/protparam/)预测家族成员对应的等电点(pI)、不稳定指数以及亲水指数;使用在线网站TMHMMServer(http://www.cbs.dtu.dk/services/TMHMM/)和软件IBS(http://ibs.biocuckoo.org/)预测并绘制PpNHXs蛋白的跨膜结构模型;使用在线网站Softberry(http://www.softberry.com)进行亚细胞定位预测。
1.2.2 系统进化关系分析和基因结构分析 使用MEGA5软件(https://www.megasoftware.net)将拟南芥、水稻、胡楊和桃NHX家族全部成员蛋白序列采用邻接法(Neighbor-Joining,NJ)在默认参数下构建进化树。
利用桃基因组数据库GDR获取家族成员的基因序列和对应编码区(CDS)序列,运用在线软件GSDS(http://gsds.cbi.pku.edu.cn/)进行PpNHXs家族成员外显子和内含子的结构分析。
1.2.3 桃NHX家族成员启动子顺式作用元件分析 在桃基因组数据库GDR下载各成员基因翻译起始位点ATG上游2000bp的序列,使用在线网站Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行作用元件预测分析。
1.2.4 桃NHX基因家族的组织表达分析 对桃7个NHX家族成员进行组织(根、茎、叶、花和果实)表达谱分析,并对NaCl处理下离体枝条上叶片的表达量进行实时荧光定量PCR检测。用植物总RNA提取试剂盒HiPureHPPlantRNAMiniKit(MagenR4165-02)提取总RNA。以总RNA为模板,采用试剂盒SUM OnetubeRTMixtureⅢ(gDNAremovel)(SUMMERSUM7806a)合成cDNA。采用荧光定量试剂盒qPCRmastermixSybrGreen100Reaction(DBI-2043)配制qRT-PCR体系,以稀释10倍的cDNA为模板,具体反应体系为(20μL):2×SYBRqPCRMix10μL,正反向引物(10μmol/L)各0.4μL(表1),DNA模板1μL、ddH2O8.2μL;荧光定量PCR仪器为美国DBI7500fast荧光定量系统。qRT-PCR反应程序为:94℃ 10min;94℃ 15s,50℃ 30s,72℃30s,40个循环;95℃ 1min,55℃ 30s,95℃ 30s。内参基因为桃基因Translationelongationfactor2(TEF2),每个样品重复3次。采用2-△△Ct法计算基因相对表达量。
2 结果与分析
2.1 桃PpNHXs基因的鉴定和理化性质分析
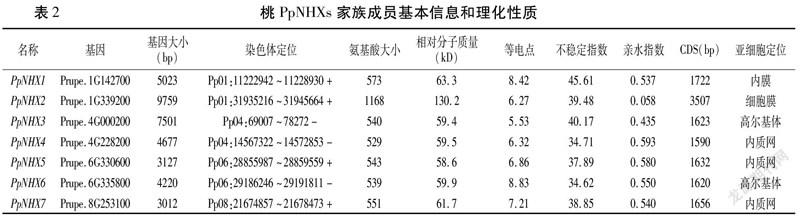
利用桃基因组数据库共鉴定出7个PpNHXs基因,根据其在染色体上的定位依次命名为PpNHX1~PpNHX7(表2)。PpNHXs家族7个成员CDS长度在1590~3507bp之间,其中PpNHX4最短,PpNHX2最长。PpNHXs蛋白氨基酸长度在529~1168之间,相对分子质量介于58.6~130.2kD。PpNHXs蛋白等电点介于5.53~8.83,其中蛋白PpNHX2~PpNHX5呈酸性,其他呈碱性。PpNHXs蛋白不稳定指数介于34.62~45.61,仅有PpNHX1和PpNHX3的不稳定指数大于40,说明桃PpNHXs蛋白家族中不稳定蛋白居多。PpNHXs蛋白的亲水指数在0.058~0.593之间,说明桃PpNHXs家族的蛋白均为疏水蛋白。
2.2 桃PpNHXs基因结构分析
利用桃基因组数据库GDR提供的PpNHXs蛋白序列构建系统发育树(图1),结果显示,PpNHXs具有清晰的亲缘远近关系,PpNHX1、PpNHX4~PpNHX7亲缘关系较近,其与PpNHX2和PpNHX3亲缘关系较远。根据提供的PpNHXs家族gDNA和cDNA序列绘制每个成员的基因结构,结果(图2)显示,7个PpNHXs基因的外显子数在13~23之间不等,外显子数目较多。其中,PpNHX1、PpNHX4~PpNHX7外显子数目相近,基因长度差异较小。
2.3 桃PpNHXs蛋白跨膜结构分析
使用在线网站TMHMM Server分析桃PpNHXs蛋白跨膜结构域,并利用软件IBS绘制PpNHXs蛋白的跨膜结构模型(图3)。结果显示,PpNHX1~PpNHX7均具有跨膜结构域,符合NHX家族跨膜蛋白的特征。PpNHX1、PpNHX4和PpNHX7具有11个跨膜区域;PpNHX3、PpNHX5和PpNHX6具有10个跨膜区域;PpNHX2具有12个跨膜区域,为跨膜区域个数最多的成员。
PpNHXs家族成员的N端、C端在膜两端的分布存在差异,PpNHX1、PpNHX4和PpNHX7的N端和C端分布于跨膜两侧;PpNHX2、PpNHX3、PpNHX5和PpNHX6的N端和C端分布于跨膜同侧。根据20种氨基酸的疏水性和亲水性,对7个桃PpNHXs氨基酸序列进行分析,发现7个桃PpNHXs跨膜结构域(N端)均有较大比例的疏水氨基酸异亮氨酸(I)、亮氨酸(L)、苯丙氨酸(F)、缬氨酸(V)和丙氨酸(A)(表3)。
2.4 桃PpNHXs基因家族成员启动子分析
利用Plantcare软件对桃PpNHXs基因家族上游启动子元件进行预测,分析统计与光信号、激素、逆境胁迫及分生组织表达相关的顺式作用元件(图4)。在7个桃PpNHXs基因家族的启动子区域,均具有与光信号相关的元件;其中,PpNHX2的光信号元件最少,为4个;PpNHX5具有的光信号元件最多,为21个。与激素相关的作用元件有生长素、脱落酸、赤霉素、水杨酸、茉莉酸甲酯;PpNHX2具有5种与激素相关的作用元件,PpNHX4具有与赤霉素和生长素相关的作用元件,PpNHX5具有与脱落酸和水杨酸相关的作用元件,PpNHX4和PpNHX5为家族中具有激素元件最少的成员。与逆境相关的作用元件有厌氧诱导、干旱诱导、低温、防御和应激反应;PpNHX3和PpNHX5均具有4种逆境相关元件;PpNHX6只具有厌氧诱导相关元件,为家族中具有逆境相关元件最少的成员。PpNHX4、PpNHX5和PpNHX7基因的启动子上含有与分生组织表达相关的顺式作用元件;PpNHX6和PpNHX7的启动子上含有与胚乳表达相关的顺式作用元件。
通过分析桃PpNHXs基因家族上游启动子元件,发现PpNHXs家族与光信号、激素、逆境胁迫及分生组织表达有密切关系,说明PpNHXs基因家族在生长发育、激素调控、抵抗逆境胁迫方面发挥重要调控作用。
2.5 桃PpNHXs基因家族成员的表达分析
2.5.1 组织特异性 对7个桃PpNHXs基因家族成员进行qRT-PCR分析,结果表明(图5),PpNHX1~PpNHX7在山桃根、茎、叶、花和果实均有表达;PpNHX1在茎中相对表达量较高,PpNHX2在根和茎中相对表达量较高,PpNHX3在各组织表达量相对均匀;PpNHX4、PpNHX5和PpNHX7主要在茎中表达,其次在花中;PpNHX6在果实中相对表达量最高。
2.5.2 桃PpNHXs響应盐胁迫的表达分析 由图6可知,离体枝条叶片经过NaCl溶液处理后,7个PpNHXs基因均出现不同变化。盐处理下的PpNHX1和PpNHX2基因在0~1.5h变化趋势是一致的,均为先升高后降低然后趋于平稳;PpNHX5、PpNHX6和PpNHX7的相对表达量与对照组相比均明显降低;PpNHX3的相对表达量高于对照组;PpNHX4的相对表达量0~0.5h高于对照,1h后低于对照。
3 讨论与结论
本研究共鉴定出7个PpNHXs基因家族成员,与拟南芥(8个)、水稻(5个)和葡萄(8个)的NHX家族成员数量相近[21-23]。通过对拟南芥、水稻、胡杨和桃基因组NHX家族成员亲缘关系进行分析,发现每种植物的NHX家族成员在系统进化树中分布均匀,相同植物的NHX基因家族成员聚在同一个分支的现象较少,说明不同植物间NHX家族成员多为直系同源基因,如PpNHX1和PeNHX4、PpNHX4和AtNHX3;相比于其他基因家族如MYB、SAUR、NAC等拥有50~100个家族成员,不同植物基因组NHX家族成员个数较少,主要是NHX家族发生复制事件较少,即旁系同源基因(如AtNHX7和AtNHX8)对数较少。
通过系统发育树分析发现,PpNHX2、PpNHX3与其他5个PpNHXs成员亲缘关系较远;通过分析基因外显子数目、基因长度,发现PpNHX2、PpNHX3与其他5个PpNHXs成员在基因结构上差异较大。PpNHX2、PpNHX3在桃基因组上具有结构和序列特异性,这种特异性预示着基因功能的特异性,为后续的基因功能分析奠定了基础。
NHX基因家族最明显的结构特征为跨膜结构域[18]。NHX跨膜结构集中分布在疏水性较强的N端,而亲水性较强的长序列C端分布在不同细胞器中,具有感知信号、调控蛋白等功能[24]。在拟南芥AtNHXs基因家族中共鉴定出8个AtNHXs成员;根据在亚细胞器的定位可以分为3类,液泡膜NHX(AtNHX1~AtNHX4)、内膜NHX(AtNHX5和AtNHX6)和质膜NHX(AtNHX7和AtNHX8)[25]。PpNHX2定位在质膜上,这与系统发育树中亲缘关系较近的AtNHX7、AtNHX8蛋白定位一致;系统进化树中唯一与AtNHX5、AtNHX6亲缘关系近的PpNHX3定位在高尔基体上,这与AtNHX5、AtNHX6蛋白定位一致;PpNHX1、PpNHX4~PpNHX7与AtNHX1~AtNHX4具有较近的亲缘关系,但PpNHX1、PpNHX4~PpNHX7蛋白定位均未在液泡膜上,与AtNHX1~AtNHX4的蛋白定位不一致。本研究认为至少存在1~2个PpNHX在液泡膜上,调节细胞液泡Na+的平衡和渗透压,但该结论需后续试验进行验证。
在桃PpNHXs组织表达分析中,7个PpNHXs表达具有特异性,表明7个PpNHXs在不同组织具有各自功能特点;但PpNHXs普遍在根和茎组织表达较高,因根和茎是植物抵御外界有害物质进入和运输至体内各部的重要关口,较多的PpNHXs分布在根和茎组织内对提高桃抗逆性具有重要作用。通过分析桃PpNHXs启动子顺式作用元件,发现大量与激素、抵抗逆境相关的元件。通过盐胁迫处理,发现每个PpNHX的表达出现明显变化,说明7个PpNHXs均参与体内耐盐代谢;PpNHX1~PpNHX3的表达量高于对照,说明其可能正向调控耐盐代谢途径;PpNHX4的表达量先高于对照,1h后低于对照,说明其可能正向参与体内耐盐代谢,只是基因表达的持续性不如基因PpNHX1~PpNHX3。PpNHX5~PpNHX7表达出现降低的现象,说明其可能负向调控体内耐盐代谢。
综上,本研究对桃PpNHXs基因家族进行全基因鉴定、生物信息分析、跨膜结构分析和表达分析,发现该基因家族结构特点明显、功能多样,尤其与抵抗逆境联系密切。本研究结果可为进一步研究和利用桃PpNHXs基因家族奠定基础。
