LPA对子宫颈癌干细胞生物学特性的影响及对RhoA/Rock2通路调控作用
2021-02-27罗保平
周 用, 罗保平, 许 海
(1.湖北省中医院肿瘤科, 湖北 武汉 430060 2.湖北中医药大学黄家湖医院妇科, 湖北 武汉 430060)
肿瘤干细胞(cancerstem cell,CSC)是肿瘤发生转移、耐药和复发的根源,占总肿瘤细胞数的2%左右,对其进行靶向清除可能是根治肿瘤的一种方法[1]。近年来,人们着眼于癌细胞的生长、增殖、侵袭、转移等相关的分子信号通路来探求宫颈癌的发生机制,寻找治疗方法,取得了一系列的成果[2]。溶血磷酸酯(lysophosphatidic acid ,LPA)是与肿瘤的发生发展密切相关的细胞间信号分子,可增加肿瘤恶性程度,亦能通过刺激 Akt磷酸化、激活 NF-κB等来抑制肿瘤细胞的凋亡,与子宫颈癌的生物学表达密切相关[3]。同时可以促进肿瘤干细胞的迁移,与癌症的转移和复发相关[4],RhoA作为在许多肿瘤中高表达的癌基因,在子宫颈癌中表达尤高[5],并与其恶性表型相关,RhoA/Rock2信号通路在肿瘤细胞干性中发挥重要作用。已有研究证实,LPA激活RhoA/ROCK2信号通路对乳腺癌细胞的增殖有显著促进作用,而LPA是否经由RhoA/ROCK2信号通路来完成子宫颈癌干细胞的恶性生物学特性表达以及沉默RhoA基因能否抑制子宫颈癌细胞的生物学特性目前尚无定论[6]。本研究旨在探讨LPA与RhoA/ROCK2信号通路之间的关系及二者在子宫颈癌干细胞中的调控作用及机制。
1 材料与方法
1.1主要材料及仪器:Siha细胞株:购于中国科学院上海生命科学研究院细胞库;DMEM培养液、小牛血清、干细胞培养添加剂:购于美国Gibco公司,FITC-anti-CD34、PE-cy5-anti-CD44、PE-anti-CD105:购于eBioscience公司,鼠抗人RhoA、ROCK2单克隆抗体:购于台湾Abnova公司,ROCK特异性抑制剂Y-27632:购于杭州联科生物技术有限公司,反转录酶:购自Promega公司,Taq酶购自Fermentas公司,所有引物由上海生工生物工程技术服务有限公司合成,荧光活化细胞分类仪:Beckman公司产品。
1.2子宫颈癌干细胞的培养与鉴定:将Siha细胞接种于肿瘤细胞球培养(DMEM培养液中加入碱性成纤维细胞生长因子、表皮生长因子、胰岛素、谷氨酰胺、B27以及青、链霉素)中进行培养,收集悬浮的细胞球用0.25%胰蛋白酶进行消化形成单细胞悬液,以流式细胞术对培养的宫颈癌细胞进行鉴定:收取培养后细胞离心10min,(1000rpm),弃上清后重悬,分管,调适后每管细胞1×106,各管分别加入PE CD44+、PE CK17+、FITC CD34-,FITC CD105-,4℃下避光孵育避光35min,继以3mL PBS 洗涤2次,350u L PBS 重悬处理后的内皮细胞,上流式细胞仪检测。
1.3LPA对子宫颈癌干细胞增殖能力的影响:将子宫颈癌干细胞接种于含小牛血清、青霉素与链霉素培养液中,培养箱调节为37℃、5% CO2,细胞置于培养箱中培养,胰蛋白酶消化传代,再培养,将细胞接种于96孔板中,调节细胞个数为1×105个/孔,37℃、5%CO2培养箱中继续培养。取对数生长期的细胞制成单细胞悬液,接种于24孔板,PBS溶液冲洗后,分加加入不同浓度的LPA(1、5、10、15、20umol/L)取对数生长期的细胞制成单细胞悬液接种于24孔培养板中,抑制剂组以最佳促增殖浓度的LPA细胞组为基础,加入Rho激酶抑制剂Y-27632,在24h、48h、72h、96h时对细胞计数,绘制细胞生长曲线图。
1.4LPA对RhoA/Rock2的调控作用
1.4.1PCR法检测各组细胞LPA、RhoA、Rock2的mRNA水平:采用TRIzol试剂提取三组细胞的RNA,取3ugRNA逆转录合成cDNA,按照逆转录试剂盒操作说明进行扩增,采用荧光定量PCR试剂盒检测各组细胞的LPA、RhoA、Rock2的mRNA表达量,扩增产物行1%琼脂糖凝胶电泳分析。
1.4.2Western blot法检测各组细胞RhoA及Rock2的表达:按照《分子克隆实验指南》的方法进行Western blot检测:在细胞培养液中加入裂解液,提取总蛋白,常规进行电泳、转印和封闭,加入RhoA单抗与Rock2多抗,稀释比例为1∶100,4℃过夜;加入稀释比例为1∶5000的生物素标记二抗,室温下反应2h,后取5μL产物用1.5%琼脂糖凝胶电泳,Odyssey扫描仪摄片。
1.5统计学方法:采用SPSS19.0软件对所有的数据进行统计学分析,多组间计量资料比较采用F检验,两两比较采用LSD-t检验,以P<0.05为具有统计学差异。
2 结 果
2.1宫颈癌干细胞表面标志性分子鉴定:经过培养后,细胞均可见悬浮细胞球,原代细胞经胰蛋白酶消化传代后,均具有克隆能力,流式细胞术所得细胞各组阳性率分别为:CD44+:91.36%,CK17+:85.16%,CD34-:78.66%,CD105-:81.55%(图1-4)。检测结果显示,宫颈癌干细胞表面标志性分子为CD44+、CK17+、CD34-、CD105-,细胞黏附分子CD44和子宫颈干细胞分子标志物CK17为阳性,且CD34、CD105阴性,排除了其它细胞污染的可能性,结合观察到的悬浮细胞球及细胞克隆,证实成功培养出了子宫颈癌干细胞。
2.2LPA对子宫颈癌干细胞增殖能力的影响:在培养第24h,不同浓度的LPA中子宫颈癌干细胞数量无明显差异(P>0.05),自48h起,各组不同浓度LPA中细胞数量有显著差异(P<0.05),且浓度越高,时间越长,细胞数量越多(图5),证明LPA对子宫颈癌干细胞的增殖有促进作用,且呈剂量时间依赖关系。
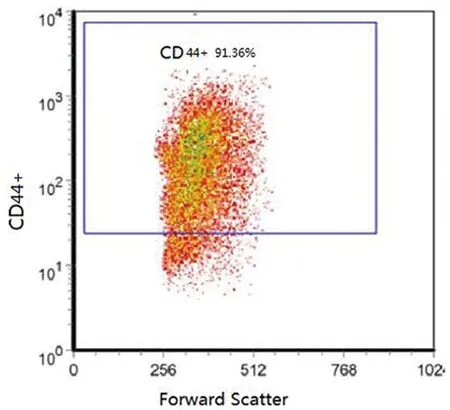
图1 流式细胞术所得干细胞CD44+阳性表达
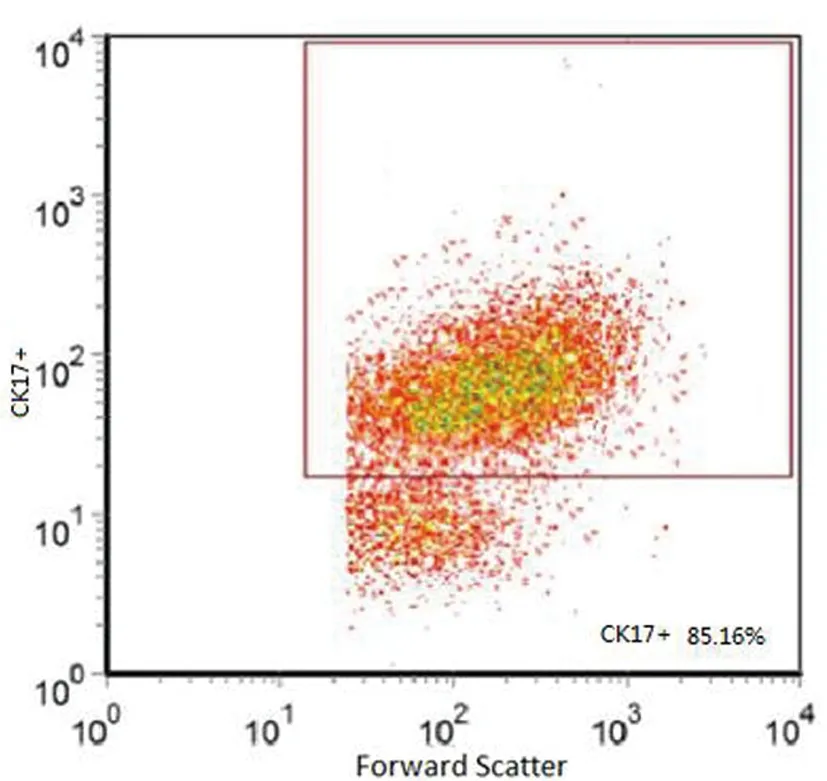
图2 流式细胞术所得干细胞CK17+阳性表达
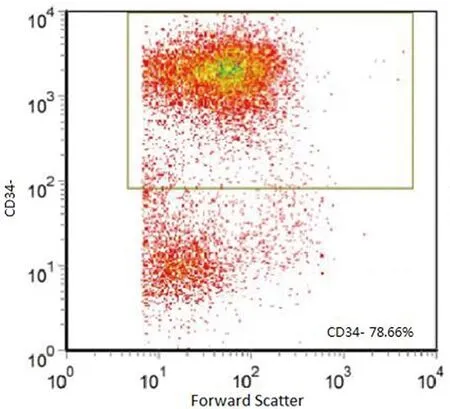
图3 流式细胞术所得干细胞CD34-阳性表达
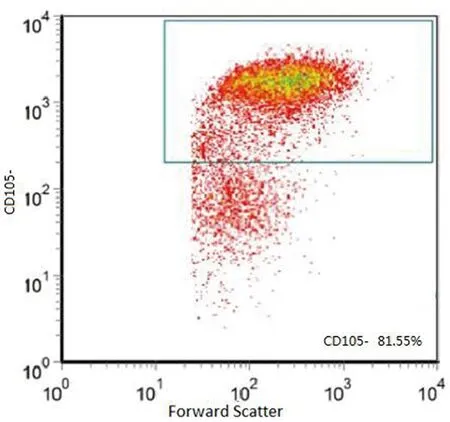
图4 流式细胞术所得干细胞CD105阳性表达
2.3RhoaA抑制剂Y-27632对子宫颈癌干细胞增殖能力的影响:将子宫颈癌干细胞,分为对照组、LPA组及抑制组,对照组正常培养,LPA组分别加入不同浓度的LPA,抑制剂组以含20umoL/L的LPA细胞组为基础,加入10umoL/L的RhoA激酶抑制剂Y-27632,自48h起,抑制剂组细胞数显著低于LPA组(P<0.05),且时间越长,差异越明显(P<0.05),证明Y-27632对子宫颈癌干细胞增殖有显著的抑制作用(图6).
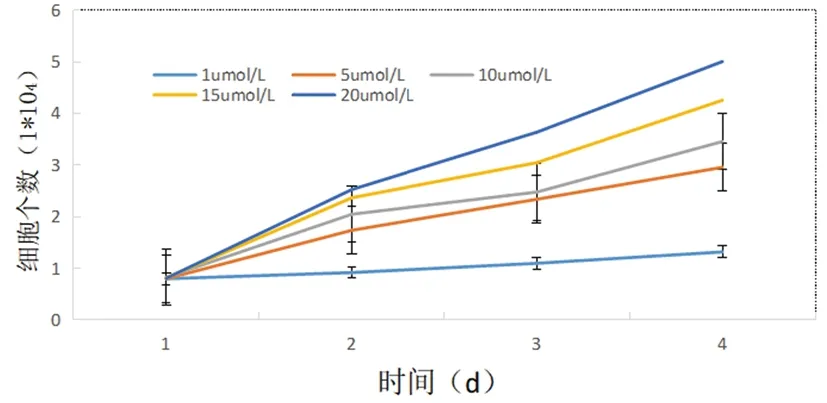
图5 不同浓度LPA下细胞生长曲线图
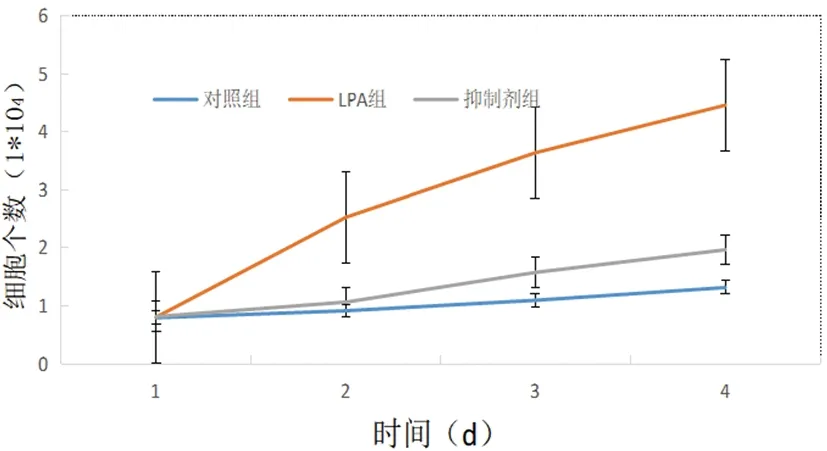
图6 Y-27632对子宫颈癌干细胞增殖能力的影响
2.4各组细胞LPA、RhoA、Rock2的mRNA水平:以对照组细胞的LPA、RhoA、Rock2的mRNA水平为对照组(1.0±0.00),LPA组的LPA、RhoA、Rock2的mRNA水平较对照组均显著升高(P<0.05),抑制剂组LPA的mRNA水平与LPA组无显著差异(P>0.05),RhoA、Rock2的mRNA水平显著低于LPA组,具体见表1。
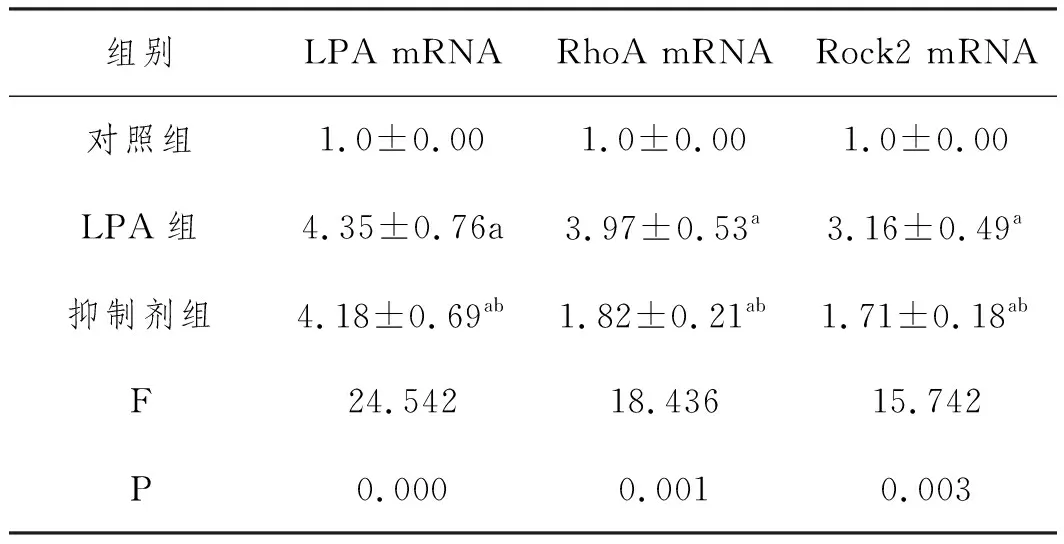
表1 各组细胞LPA RhoA Rock2的mRNA水平
2.5各组细胞RhoA及Rock2蛋白的表达:具体见表2,从结果中可以看出,LPA组的RhoA及Rock2蛋白表达量显著高于对照组与抑制剂组(P<0.05),抑制剂组的RhoA及Rock2蛋白表达量高于对照组(P<0.05)(图7)。
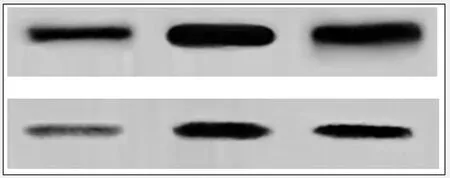
图7 各组细胞RhoA及Rock2蛋白的表达
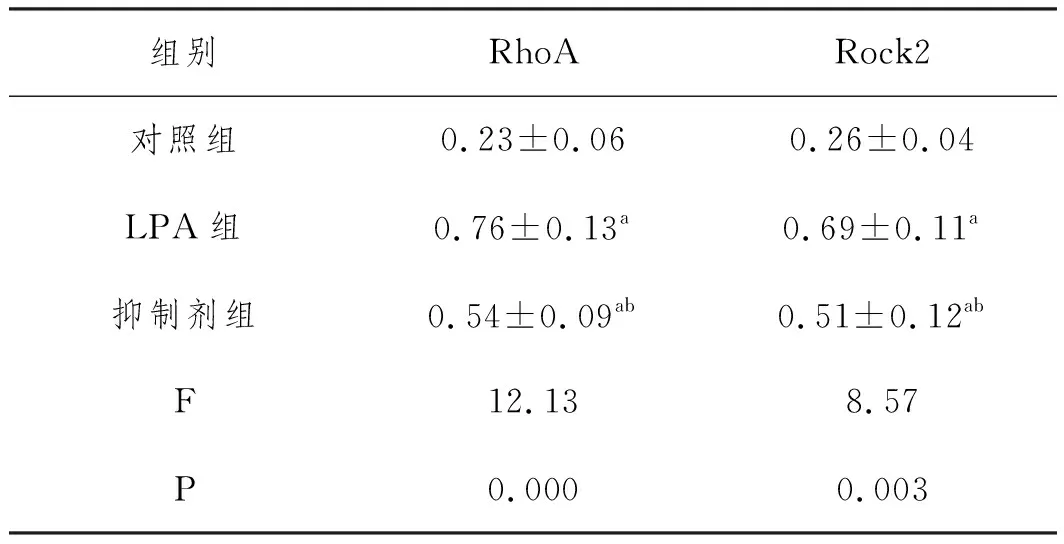
表2 各组细胞RhoA及Rock2蛋白的表达
3 讨 论
肿瘤干细胞理论认为,肿瘤细胞是由具有成瘤能力的CSC分化而来,虽然数量不多,但却是肿瘤发生、发展、转移和复发等问题的根源[7]。在肿瘤的治疗过程中,如果能针对CSC进行靶向完全杀伤,即使不能缩小瘤体,也可以制约肿瘤细胞的生成,使瘤体痿缩,最终达到完全治愈的目的,本研究中,我们成功培养和收集了子宫颈癌干细胞,为进一步的实验打下了基础。LPA是一种由血小板、成纤维细胞、脂肪细胞和某些肿瘤细胞分泌的小分子甘油磷酸脂,以多种形式存在于不同的组织/细胞中,LPA对干细胞有非常强烈的诱导作用,研究发现,LPA可使干细胞向机体发生损伤的部位迁移,同时刺激干细胞旁分泌作用,促进伤口愈合[8]。而对于肿瘤干细胞上,则体现为促进肿瘤干细胞的增殖与迁移。很早以前就有研究发现癌变组织中的LPA表达显著升高,从而提出LPA可能与癌症的发生发展相关[9],之后的研究揭示LPA可通过各种途径参与到肿瘤发生的病理过程,且直接影响到肿瘤恶性程度、侵袭转移。LPA可以通过PLC的激活来增加Ca2+的流动,提高肿瘤细胞的迁移能力,同时通过刺激Akt磷酸化、激活NF-κB抑制肿瘤细胞的凋亡[10]。目前已有的研究已证实LPA与卵巢癌细胞、肝癌细胞、淋巴癌细胞、胶质瘤细胞、胰腺癌细胞的增殖与迁移相关,也有诸多体外实验研究证实LPA可以促进子宫颈癌细胞的生长增殖,且呈浓度时间依赖性,在临床上,LPA也可以作为多种癌症诊断或判断预后的一项参考指标[11]。在本研究中,我们对子宫颈癌干细胞采用了不同浓度的LPA进行干预,结果发现,干预后的癌细胞增殖能力显著增强,且呈剂量时间依赖关系,证实了LPA对子宫颈癌干细胞增殖的促进作用。
LPA对肿瘤细胞的促进是多方面通路共同作用的结果,其中一条重要的信号通路为RhoA/Rock2信号通路,LPA可通过藕联特定的G蛋白,LPAR1LPAR2、LPAR4和LPAR5结合,直接激活RhoA途径,RhoA能够影响多种分子的表达,调节肌动蛋白骨架,激活下游的核转录因子kappa B(nuclearfactor kappa-B,NF-κB)等重要信号分子,影响细胞的增殖与迁移。同时研究发现,RhoA 的的ROCK2是调节细胞增殖与迁移的主要参与者,在使用RhoA抑制剂Y-27632后,肿瘤细胞的桩蛋白的磷酸化水平也明显减弱,研究发现,多种癌症都存在RhoA/Rock2信号通路的异常表达,且与肿瘤的预后密切相关[12]。韦红卫等人研究发现,RhoA/ROCK2信号通路可能在宫颈癌浸润和转移中发挥了一定的作用。在本研究中,我们加入LPA后,发现可进一步促进子宫颈癌干细胞LPA的表达,宫颈癌干细胞的增殖能力增强,且RhoA、Rock2的mRNA水平增加,RhoA、Rock2的蛋白表达量增加。加入RhoA抑制剂Y-27632后,LPA的mRNA表达量不变,但细胞增殖能力、RhoA、Rock2的mRNA水平及蛋白表达量显著下降,说明RhoA/ROCK2信号通路与子宫颈颈癌有密切关系,而LPA对RhoA/ROCK2信号通路具有调控作用。
综上所述,LPA可以促进子宫颈癌干细胞的增殖,其作用机制可以是通过调控RhoA/Rock2通路来实现的。在将来的进一步研究中,我们将构建沉默RhoA基因的慢病毒载体转染宫颈癌干细胞,来探索RhoA/Rock2通路对子宫颈癌干细胞的影响,为将来靶向药物的开发提供理论依据。
