含异原子石墨炔基电极材料的研究进展
2021-02-26孙全虎卢天天何建江黄长水
孙全虎,卢天天,何建江,黄长水
(1.中国科学院青岛生物能源与过程研究所,青岛266101;2.中国科学院大学,材料与光电研究中心,北京100049)
多年来,碳材料一直是科学家们研究的热点[1~3].碳的多种杂化形式,即sp,sp2,sp3杂化,使碳的同素异形体可以具有多种可能的形式,并表现出不同的物理化学性质.由sp2杂化碳构成的碳材料(例如石墨、石墨烯、碳纳米管等)具有良好的导电性,在材料领域展现了广阔的应用前景;由sp3杂化碳构成的碳材料(例如金刚石等)则具有稳定的三维空间构型,可以提高材料的硬度,在机械加工方面具有较大的优势;而sp杂化碳具有线性结构,可以有效降低空间电荷密度,改善材料的孔隙度[4,5].这些不同结构的碳材料在不同研究领域显现出优异的性质,也具有重要的应用前景.
与由sp2或sp3杂化碳组成的碳材料不同,石墨炔[6~8]具有由苯环(sp2碳原子)和炔键(sp碳原子)连接的二维平面结构,是碳材料结构上的一大突破.石墨炔独特的化学结构和物理性质使其在电化学储能方面表现出优异的电化学性能和广阔的发展前景.石墨炔化学结构最重要的特征之一是sp碳的存在,这使其具有许多其它碳材料所没有的性质[9].石墨炔由炔键以及苯环所构成的18-C大三角环在层层堆叠后形成了规整的离子扩散通道,使离子不仅可以在二维平面内扩散,也可以在垂直方向传输[10].此外,石墨炔炔键中的π键成分还有效地扩展了共轭体系,有利于提高材料的电子传输能力,降低电化学反应中的极化现象.许多理论计算已经预测石墨炔作为电池电极材料拥有优异的储锂储钠性能[11],通过苯环以及炔键对这些金属阳离子的吸附,石墨炔的理论容量要明显高于其它碳材料.同时,在巨大比表面积和离子传输通道的辅助下,石墨炔可以迅速进行这些阳离子的嵌入和脱出,从而达到较高的功率密度.更值得注意的是,石墨炔作为一种新型二维材料,其结构具有较强的化学稳定性及机械性能,保证了石墨炔作为电极材料具有极好的循环性能.
由于石墨炔的合成路线温和,研究者们通过引入具有特殊功能的官能团设计合成了许多杂化石墨炔,充分发挥了石墨炔微结构功能可调的优势[12].本文将分类对近几年包含异原子的石墨炔在储能应用方向的工作进行总结.
1 石墨炔及异原子掺杂石墨炔的制备
石墨炔主要是通过交叉偶联的化学方法制备而成.如图1(A)所示,将反应制得的六三甲基硅炔基苯溶于四氢呋喃(THF)中,于8℃下加入四丁基氟化铵(TBAF)反应10 min,得到脱去保护基的六炔基苯单体.随后对得到的单体进行萃取、抽滤、旋转蒸发处理.以吡啶作为主要溶剂,在氩气氛围下于60~110℃范围内缓慢加入已脱保护基的单体,通过交叉偶联反应在铜箔表面生长72 h.铜箔在吡啶(弱碱性)的存在下可以生成铜离子,进一步催化交叉偶联反应,所以在石墨炔形成过程中,铜箔不仅是石墨炔薄膜生长的基底,也是交叉偶联反应的催化剂.从图1(B)中可以看到铜片上存在卷曲的薄膜,这表明石墨炔薄膜本身是具有一定柔性的[4].
为了获得石墨炔材料更多的性能,通常对石墨炔进行异原子掺杂(氮掺杂、磷掺杂等).例如,石墨炔在氨气氛围下,以氨气作为氮源经过高温煅烧即可转化为氮原子掺杂的石墨炔[图1(C)].从图1(D)~(G)中可以看出,经过氮掺杂后,石墨炔薄膜基本保持了原来的形态,颗粒尺寸略有变大,厚度也没有明显的变化.对石墨炔在氨气氛围下进行热处理后不仅可以实现氮掺杂,而且可以去除石墨炔中的小分子聚合物和含氧基团,进一步提高石墨炔的电化学性能[13].

Fig.1 Synthetic route and SEM images of graphdiyne films
2 异原子杂化石墨炔电极材料在不同储能器件中的应用
2.1 锂离子电池
为了满足现代社会日益增长的能源需求,可充电锂离子电池被认为是最有潜力的储能设备[14~16].尽管已经取得了相当大的进展,但仍需要通过开发新材料等方法进一步提高其性能[16].电极材料往往是锂离子电池容量、倍率性能和循环使用寿命的决定因素,因此设计合成具有优异电化学性能的电极材料是满足未来动力电池需求的有效途径之一[17].自2010年石墨炔在实验室被成功合成以来,由于其理论容量高和微结构可调节等特点,研究者对石墨炔在锂离子电池中的应用进行了大量的研究.
在石墨炔[图2(A)]储锂研究方面,Huang等[18]调控了单体的不同含量合成了3种不同厚度的大面积石墨炔薄膜作为锂离子电池的电极材料,用于验证锂离子电池的存储容量.多层石墨炔中锂的存储主要通过层间嵌入/脱出和表面吸附/脱附两种方法进行.实验中制备了3种面密度分别为0.24,0.48和0.72 mg/cm2的石墨炔薄膜GDY-1,GDY-2和GDY-3.将3种材料分别作为负极,在扣式半电池上进行了电化学性能测试.从图2(B)可以看出,在电流密度为500 mA/g时,前200圈循环GDY-1,GDY-2和GDY-3薄膜对应的容量分别为495,260和127 mA·h/g;随后分别稳定在520,285和136 mA·h/g.从图2(C)可以看出,GDY-1拥有良好的倍率性能,且在大电流密度(2 A/g)下循环1000圈以上时仍可稳定工作,表明组装好的扣式半电池具有很好的电化学性能,包括高比容、突出的倍率性能和较长的循环寿命,并且可以在大电流下稳定快速地充放电.通常,石墨炔的制备条件是温和的.He等[19]尝试改变反应温度,通过热处理去掉薄膜表面的小分子聚合物,形成了光滑的石墨炔膜,提高了石墨炔的质量,进而提升了其储锂性能.在100 mA/g的电流密度下循环150圈后,经200℃热处理的样品的可逆容量为272 mA·h/g,经300,400和500℃热处理后样品的可逆容量分别为689,901和578 mA·h/g.当热处理温度为500℃时,由于新产生的石墨炔球形颗粒和堆积的片层不利于锂离子的扩散,其可逆容量有所下降.实验通过对加热温度与时间两种因素的共同优化,得到了导电性良好的均匀石墨炔薄膜.这些均匀石墨炔薄膜具有较大的容量、稳定的循环性能和优异的倍率性能.

Fig.2 Structure and lithium ions storage performance of GDY and F⁃GDY
由于具有提高导电性和活性位点的功能,异原子掺杂通常被用来提高碳材料的电化学性能[20].在已有报道中,碳材料大多通过焙烧的方式进行掺杂[21].Zhang等[13]在氨气氛围下热处理石墨炔进行了氮元素掺杂.与石墨炔相比,氮原子的引入产生了大量的杂原子缺陷和活性位点,可以提高电化学性能.氮掺杂石墨炔作为锂离子电池的负极材料,在200 mA/g的电流密度下经过200次循环可获得高达785 mA·h/g的可逆容量,在500 mA/g电流密度下经400次循环可逆容量达到了761 mA·h/g,并且在2 A/g的电流密度下经过1000次循环仍可获得510 mA·h/g的可逆容量.因此,与原始石墨炔相比,氮掺杂石墨炔作为负极材料的锂离子电池在可逆容量、倍率性能和循环稳定性方面都有提升和改善.Shen等[22]以磷酸为磷源,在高温下制备了磷取代石墨炔(P-GDY).拉曼光谱结果表明,磷掺杂产生了大量的异原子缺陷和活性位点,使微孔结构更加层次化,为相应的离子提供了更多的存储位点和传输路径.他们还结合实验和密度泛函理论(DFT)计算方法研究了磷掺杂和锂贮存的结构和位置,通过结构表征证实了掺杂的磷在P-GDY材料中形成了P—O、P=O和P—C键,提供了更多的分层多孔结构和大量的活性位点,这有利于锂的存储和离子的传递.P-GDY作为电极材料,在电流密度为50 mA/g时可逆容量达到1169 mA·h/g,在电流密度为500 mA/g时可逆容量达到637 mA·h/g,高于未掺杂的石墨炔和一些其它杂原子掺杂碳材料.所以,高温下硫元素的掺杂也能够提供大量的杂原子缺陷和活性位点,Yang等[23]使用苄基二硫(BDS)作为硫源,BDS均解生成的硫自由基能与乙炔键反应,并被很好地封闭在石墨炔内部的三角孔中,形成硫取代石墨炔(S-GDY).BDS分解过程中产生的甲苯、二苯乙烷等小分子在加热过程中被完全去除.该S-GDY电极在50 mA/g的低电流密度下表现出810 mA·h/g的高锂离子存储容量,可以循环运行50次;在500 mA/g的大电流密度下,经过200次充放电循环,平均可逆容量为500 mA·h/g;即使在2 A/g的更高电流密度下,S-GDY电极也可以在1000次循环中保持平均380 mA·h/g的容量,平均库仑效率高达99.9%.
除高温焙烧外,石墨炔特殊的化学合成方法还使其可以设计定性、定量的掺杂.He等[24]通过使用1,3,5位有氟取代的偶联前体制备了氟取代石墨炔(F-GDY)[图2(D)].由于是自下而上对前体进行取代,实现了异原子精确定位均匀掺杂.在结构中,氟原子在二维分子平面上分布均匀,F-GDY框架更加稳定且形成了大孔隙.同时,由于导电率高、比表面积大、扩散距离短且锂离子的活性存储位点多,使得F-GDY电极具有较高的功率和能量密度.从图2(E)可以看到,在电流密度为50 mA/g时,F-GDY的可逆容量可达1700 mA·h/g;当电流密度增加到2 A/g时,也可以获得良好的循环性能[图2(F)],可逆容量在初始循环时保持在500 mA·h/g,循环2500次后保持在490 mA·h/g.此外,F-GDY中的C—F键使膜具有良好的稳定性和与电解液的相容性.XPS结果表明材料中包含的半离子键介于离子键和共价键之间,可实现到离子键的快速可逆转变.Wang等[20]制备了氯取代石墨炔薄膜(Cl-GDY),该膜具有高共轭结构,在二维分子平面上具有均匀的大孔隙.氯原子在二维分子平面上均匀分布,这种独特的二维结构使Cl-GDY在分子平面垂直方向上有更多的锂离子传递通道,锂存储量也有所增加.因此,以Cl-GDY为电极的锂离子电池具有优异的倍率性能和循环稳定性.此外,Gao等[25]使用温和、低成本的水热法,在铜箔上原位生成了高质量的基于吡嗪并喹喔啉的石墨炔(PQ-GDY)薄膜材料,并通过多种表征方法证实了所得的石墨炔是一种原子精度氮掺杂的层状结构.锂离子半电池测试和第一性原理(DFT)计算结果揭示了锂原子与材料中3种对应结构的亲和力大小依次为吡嗪氮>二炔碳>中心芳环,且超过一半的锂原子优先与吡嗪氮结合.该材料经800圈长循环后,在200 mA/g的电流密度下可逆容量为570 mA·h/g,达到理论容量的97.2%.Ren等[26]在异原子掺杂的基础上,通过剪裁丁二炔的连接实现在石墨炔碳骨架上钻洞,形成了较大的微孔密度,提高了离子迁移和存储的能力.通过这种方式获得的氢取代石墨炔作为柔性电极在50 mA/g时的容量可达1550 mA·h/g,即使在5000 mA/g条件下仍能提供470 mA·h/g的可逆容量,充放电过程的库仑效率超过99.9%.同时,Yang等[27]通过改变前体的中间苯环引入异原子,合成了仅由吡啶类氮原子和碳原子组成的吡啶石墨炔(PY-GDY)和嘧啶石墨炔(PM-GDY)[图3(A)].这些薄膜是自支撑、均匀且连续的,并且仅掺杂吡啶类氮原子.图3(B)显示制备的薄膜能作为可穿戴电池点亮LED灯.理论预测表明,吡啶氮可以增强相互关联的结合能,所以氮掺杂有利于锂离子的存储.PY-GDY和PM-GDY作为负极材料显示了优良的电化学性能,如图3(C)和(D)所示,在电流密度为500 mA/g时,PY-GDY(PM-GDY)基电极表现出大于96%的库仑效率和约1050(900)mA·h/g的高容量.在100 mA/g的电流密度下,PY-GDY(PM-GDY)的容量达到了1168 mA·h/g(1165 mA·h/g);在5000 mA/g的电流密度下,PY-GDY(PM-GDY)经过1500(4000)次循环后容量稳定在764 mA·h/g(483 mA·h/g).以上结果表明,在石墨炔分子平面上均匀、定量地掺杂异原子可以有效地提高其电化学性能.

Fig.3 Structural characteristics and lithium storage performance of PY⁃GDY,PM⁃GDY,MsGDY and GDY⁃MoS2
另外,也可通过取代基对石墨炔进行修饰来调节电子结构,从而提升其电化学性能.Li等[28]首先合成了同时具有sp,sp2,sp3杂化碳的甲基取代石墨炔(MsGDY)[图3(E)].从图3(F)可以看出,sp和sp2的共轭碳构成了导电骨架和分布良好的孔隙,通过苯环上的耦合作用将甲基(sp3-C)引入分布良好的孔隙中,层间距变大(0.41 nm).图3(G)表明在MsGDY中可能存在多种堆叠模式.MsGDY结合了3种杂化碳的优点,可提供比现有碳材料更多的锂离子存储位点(理论容量为1701 mA·h/g)和更低的锂离子扩散壁垒.实验结果表明,MsGDY具有较高的锂存储容量,如图3(H)所示,在50 mA/g电流密度下容量为1020 mA·h/g.此外,Xie等[29]通过加入吸电子/给电子基团对石墨炔的能隙、形态和对碱性金属的亲和力等性质进行了有效的调整,实验和理论结果表明,引入的基团对制备的石墨炔衍生物的部分性质调节起关键作用.他们研究了3种石墨炔衍生物作为锂电池负极的储锂机理、倍率性能和循环性能等.通常,具有吸电子能力的氰基和具有供电子特性的甲基可以在一定范围内减小石墨炔网络的带隙,提高石墨炔网络的电导率.同时,氰基和甲基的存在提供了更多的微孔和更大的比表面积.氰基的电负性增强了石墨炔骨架对锂原子的亲和力,甲基的大体积增大了层与层之间的距离,从而可提供更多的存储空间和扩散通道.研究结果表明,合理引入不同杂化形式的取代基对新型碳基二维材料的设计具有重要意义.
双元素掺杂在适当时候往往能够展现出协同作用.Lu等[30]提出了氢和氟定位均衡共掺杂石墨炔的策略,结合氢和氟元素对锂的存储贡献,合成了H1F1-GDY.该材料结合了氢取代的高比容量和氟取代的高稳定性,实现了在50 mA/g电流密度时2050 mA·h/g的超高容量,而且在5 A/g下循环8000次后容量仅降低23%.当氢和氟均匀共掺杂时,可以形成纤维网状多孔结构,该结构赋予材料与电解液很好的界面相容性,SEI膜形成稳定且阻值小.该工作为界面结构调整提供了方法,有效地提高了锂的存储稳定性.定位取代与共掺杂相结合的方法有助于提高锂的存储容量,为元素共掺杂提供了参考.
此外,将石墨炔与活性电极材料复合也能发挥两者各自的优势.Gao等[31]采用原位法合成了GDYMoS2杂化纳米结构[图3(I)].石墨炔与MoS2的接触面积较大,可以极大地缩短锂离子的扩散距离.其独特的结构使GDY-MoS2具有良好的机械稳定性和良好的储能性能.GDY-MoS2(MoS2重量分数为77.9%)作为锂离子电池负极时,表现出优异的锂离子存储性能.如图3(J)所示,GDY-MoS2在电流密度为0.05 A/g时表现出1463 mA·h/g的高容量.在5 A/g的电流密度下,GDY-MoS2表现出419 mA·h/g的高容量.由图3(K)中可以看出,GDY-MoS2在电流密度为0.05 A/g时,循环100次后比容量仍然可达1450 mA·h/g,是纳米级MoS2(250 mA·h/g)的5.8倍,也说明了GDY-MoS2具有良好的稳定性.
良好的导电性和孔隙度使石墨炔在锂离子电池中有优异的倍率性能和比容量.在与不同性质的原子或基团进行掺杂后,进一步优化了材料的孔结构与电导率,能够有效提升材料的倍率性能和比容量.另外,孔结构的变化也使材料与电解液的浸润性得到改善,可以形成更加稳定的SEI膜,降低充放电过程中副反应的发生,提升长期循环稳定性.在这些性质的协同作用下,石墨炔类材料在锂离子电池中表现出了优异的储锂性质.
2.2 钠离子电池
钠在元素周期表中与锂相邻[32],在地壳中的储量比锂更丰富并且和锂的化学性质类似[33].这些优点使得钠储能设备成为最有希望替代锂离子电池应用于可再生能源存储和智能电网的候选设备[34,35].近年来,人们对钠储能材料进行了大量的研究和开发.石墨炔的化学结构、物理性质也使其在钠离子电池应用方面表现出优异的电化学性能和广阔的发展前景.
实验证明,对本征石墨炔进行合理的形貌调控能够有效提高其在钠离子电池中的电化学性能.Zhang等[36]合成了具有多孔结构的石墨炔,并将其作为钠离子电池的电极材料.石墨炔具有大量微孔和中孔的独特结构,使其具有更多的钠存储位点,有利于离子的快速传输.由于其独特的三维多孔结构、化学稳定性和高电子导电性,组合的钠离子电池倍率性能优异,比容量适中,循环寿命长.此外,Wang等[37]采用三维结构石墨炔纳米片(GDY-NS)作为钠离子存储设备的负极材料进行了研究.从图4(A)可以清楚地观察到,在铜基板上分布着垂直方向的GDY-NS,拥有均匀的大孔隙.GDY-NS的三维纳米结构[图4(B)]可以通过调节分子内孔、三维互联孔结构和增加活性位点来促进钠离子快速扩散,极大地优化了钠的存储行为.结果表明,丁二炔键的存在对位点的增加和SEI膜的稳定形成起到了重要作用.从图4(C)中可以看出,在电流密度为1 A/g的情况下,循环1000次后容量仍保持在405 mA·h/g左右.可见,基于GDY-NS的负极具有高容量、高功率密度和良好的循环性能,在下一代储能设备中显示了巨大的潜力.以上研究结果表明,设计和制备具有多孔和纳米结构的新型石墨炔基材料为开发容量大、循环稳定性好的电极材料提供了思路.
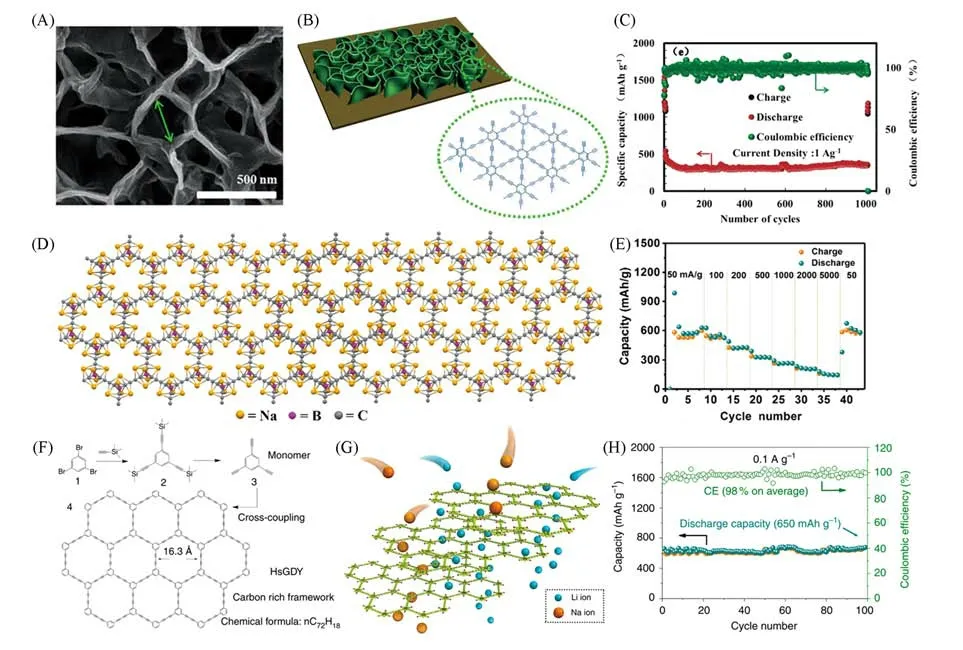
Fig.4 Sodium storage advantage of GDY⁃NS,HsGDY and BGDY materials
从异原子精确定量掺杂的角度考虑,Wang等[38]采用自下而上的合成策略制备了硼取代石墨炔(BGDY),该富碳骨架上具有高共轭结构和膨胀孔隙.sp杂化碳和均匀分布的硼在BGDY骨架中赋予了材料优异的电子结构和良好的导电性能,钠原子在垂直方向上有更稳定的存储位置和更大的转移通道.BGDY中可能的钠存储位置如图4(D)所示.从图4(E)中可以看出,基于BGDY的电极表现出了良好的倍率性能.即使在电流密度为5 A/g的情况下,循环4000次后容量仍能保持在180 mA·h/g.此外,He等[39]通过三炔基苯在铜箔上的原位交叉耦合反应制备了富碳骨架氢取代石墨炔薄膜(HsGDY)[图4(F)].芳香氢(Ar-H)为HsGDY提供了更多的钠离子结合位点;三维分层多孔结构为电子的移动提供了一个矩阵,确保了电子的高效率收集和扩散[图4(G)].从图4(H)中可以看到,在电流密度为0.1 A/g的情况下,经过100次循环,可逆容量可达1050 mA·h/g.得益于这些优点,这种柔性电极可以实现较高的可逆稳定容量.在此基础上,Yang等[40]以钯修饰的铜箔为催化剂和载体制备了33 cm2具有良好结晶度的多孔氢取代石墨炔(HsGY).HsGY的芳香氢和乙炔键为离子结合提供了大量的活性位点,HsGY具有高比表面积、宽层间距、层次化多孔结构及优异的导电性,保证了钠离子的传输.以HsGY为负极的钠离子电池在100 mA/g的电流密度下能提供600 mA·h/g的可逆容量,即使在5000 mA/g的高电流密度下,容量也可以稳定在320 mA·h/g,库仑效率维持在96%,证明HsGY中的分层多孔结构和芳香氢可有效提高容量.Gao等[41]通过对1,3,5-三炔基苯和2,4,6-三炔基吡啶这两种前驱体配比的精确调整,制备了一系列不同氮/碳比的材料,实现了优越的储存能力.在0.05 A/g时,以所制备的样品为负极的钠离子电池的最大比容量可达到680 mA·h/g.其比容量与氮含量之间不存在正相关关系,单体配比为1∶1时,比容量最大,说明除N/C比外,形貌、层间距、润湿性等也会影响电池性能.以上研究为异原子掺杂碳材料在储能中的应用提供了新的思路和指导.
石墨炔自身的18-C大三角形孔使半径较大的钠离子也可以顺利地嵌入与脱出,减少失活储钠位点的产生.在多次充放电后,也可以保持较好的循环稳定性.在引入异原子后,不仅调节了材料的孔结构,还增加了钠离子活性吸附位点,提升了材料的储钠比容量.所以,本征石墨炔及掺杂石墨炔都可以作为钠离子电池的高稳定性负极材料.
表1对含异原子石墨炔基电极材料在锂离子电池和钠离子电池中的性能进行了总结,可以看出,不论是在容量方面还是在循环稳定性方面石墨炔基电极材料均有优异的表现,也展现了石墨炔作为电极材料在锂离子和钠离子电池等领域广阔的发展前景.

Table 1 Summary of the performance of GDY-based electrodes in electrochemical batteries
2.3 锂硫电池
当前,锂离子电池所用正极材料的能量密度已不能满足日益增长的需求.硫由于具备较高的理论比容量和较低的成本[42],逐渐受到关注并被视为极具潜力的正极材料[43].但是,硫的电导率很低,这就需要利用导电能力强的碳材料对硫进行负载,而石墨炔不仅拥有较大的比表面积和良好的导电能力,还有较强的吸附能力,实验结果表明,石墨炔在解决多硫化物穿梭问题方面有显著的作用.
以石墨炔为基础的硫正极材料在应用于锂硫电池中时表现出了优异的化学性能.Du等[44]通过热合成过程,使S8环裂解产生的短硫单元与石墨炔的高活性C≡C键发生反应,并被限制在石墨炔内部的三角形孔中,形成了由高锂离子迁移率的导电碳骨架和短硫储能单元组成的硫取代石墨炔(SGDY).SGDY正极在商业碳酸基溶液的锂硫电池中表现出良好的电化学性能.在0.5和1 C电流密度下经过100次循环后,可逆容量分别为821.4和713.7 mA·h/g.通过调整碳材料的结构[45,46]提高硫的含量,可以制造低成本、高性能的硫基电池.
通过抑制多硫化物的穿梭效应可以改善电池的性能.Wang等[47]在商用聚丙烯隔膜[图5(A)]上对调制的石墨炔纳米片进行原位制备,并将其应用在锂硫电池中.在电化学过程中,乙炔键与多硫化物之间存在较强的相互作用,推测乙炔键的均匀分布和丰富的三角形分子间孔隙增强了与多硫化物的物理吸附和化学结合.在图5(B)左图中可以观察到,由于金属锂与多硫化物的剧烈反应,造成了锂枝晶的快速生长并形成了大量的锂沉积.而由于物理吸附和化学作用结合有效捕获多硫化物,在图5(B)右图中可以看到相对温和的锂枝晶和部分锂沉积.在电流密度为0.1 C的情况下,电池容量能够大于1262 mA·h/g;在电流密度为1 C的情况下,循环500次电池容量可维持在412 mA·h/g.这种纳米片有效抑制了穿梭效应[图5(C)]并阻止了多硫化物的扩散,可作为实现高能量电池的理想隔膜.Wang等[48]还以石墨炔作为锂硫电池的隔膜涂层,以提高锂硫电池的电化学性能.一方面,石墨炔的大共轭体系含有乙炔键和苯环,它们对可溶性锂多硫化物具有很强的静电吸引,且作用是可逆的;另一方面,石墨炔均匀分布的微孔和均匀的层间距也可以通过物理作用阻挡可溶性多硫化物.石墨炔对多硫化物的双重作用促进了电化学性能的提高[图5(D)].因此,制备的石墨炔涂层的锂硫电池具有优异的电化学性能,包括高比容量、倍率性能和低容量衰减率.如图5(E)所示,在0.5 C时,电池的初始容量为1112.9 mA·h/g;经过200次循环后,容量保持在816.7 mA·h/g,衰减率为0.13%,采用这种石墨炔隔膜的电池循环性能也明显优于采用PI和PI-SP隔膜的电池.

Fig.5 Application of GDY in lithium sulfur battery and lithium ion capacitor
石墨炔本身具有大的比表面积、很强的吸附性及较高的导电性,所以石墨炔的引入有效提升了硫电极的电导率,保证了硫在石墨炔上高负载的同时能够通过物理吸附作用和化学结合作用有效抑制多硫化物的穿梭效应,在锂硫电池中展现了良好的电化学性能.
2.4 电容器
电容器具有功率密度高、充放电快和使用寿命长等优势[50,51].石墨炔独特的离子扩散途径使离子能够实现快速嵌入脱出,使石墨炔成为需要高功率密度电容器的理想电极[12],在电容器中拥有广阔的应用前景.
实验表明,石墨炔在电容器中显示出了很好的电化学性能.Du等[52]将石墨炔作为负极材料应用于锂离子电容器,在100.3 W/kg的功率密度下,达到了110.7 W·h/kg的高能量密度.即使在1000.4 W/kg的高功率密度下,能量密度依然可以达到95.1 W·h/kg.这说明在相同功率密度下,石墨炔比之前报道的石墨烯和石墨具有更高的能量密度.此外,Wang等[49]将纳米墙状石墨炔(GDY-NW)作为锂离子电容器的负极材料进行了性能测试.石墨炔纳米墙具有独特的多孔结构,包括大量的宏观和微观孔隙[图5(F)],拥有很多活性位点,比表面积很大,充放电曲线具有线性对称性,无氧化还原峰,所以具有很好的电化学性能.从图5(G)中可以看出,该电容器还有很好的循环性能,电流密度为1 A/g时,循环10000次后比容量仍可达到189 F/g.同时,Wang等[37]采用三维结构石墨纳米片(GDY-NS)作为钠离子电容器的负极材料,实现了高容量和功率性能以及良好的循环能力.他们通过调节分子内孔和三维连接孔结构及增加活性位点来优化钠的存储行为,形成了快速的钠离子扩散通道.在1 A/g的电流密度下,经过3000次循环后比容量仍为200 F/g.在300 W/kg的功率密度下,初始能量密度高达182.3 W·h/kg.甚至在15000 W/kg的功率密度下能量密度也能稳定在166 W·h/kg.GDY-NS负极的高能量密度和极好的循环性能使其在高效储能器件中具有巨大的潜力.
对石墨炔进行异原子掺杂也可以有效提高其在电容器中的电化学性能.Shen等[53]采用溶剂热法合成了富氟石墨炔(F-GDY).氟元素在F-GDY二维结构中均匀分布,以F-GDY为负极材料时,可以生成更多的活性位点,提高了器件的倍率能力和循环稳定性.氟的取代可以增大二维平面上的孔隙,也可以提高锂离子的存储性能.当活性炭与F-GDY质量比为7∶1时,锂离子电容器释放的最大能量密度为200.2 Wh/kg,对应的功率密度为100.3 W/kg.这种锂离子电容器还具有优异的长循环稳定性,在2 A/g条件下循环5000次后能量密度保持率约为80%,在5 A/g条件下循环6000次后能量密度保持率超过80%.Shen等[54]还通过在氨水中的氮化反应制备了掺氮石墨炔(N-GDY).该材料导电率高,层间距离宽,具有独特的三维多孔结构,并伴有氮掺杂的缺陷,具有极好的锂、钠离子快速扩散和存储能力.以N-GDY为负极制备的锂离子电容器(LIC)和钠离子电容器(SIC)具有高的功率密度和能量密度.当功率密度为11250 W/kg时,以N-GDY为基础的LIC仍然可以提供107 W·h/kg的能量密度.而以N-GDY为基础的SIC在功率密度为22500 W/kg时能保持119 W·h/kg的能量密度.LIC和SIC的能量密度高于纯石墨炔和许多其它碳材料.
石墨炔良好的导电性和独特的孔隙结构使离子能够快速地嵌入和脱出,满足电容器对高功率密度和高能量密度的需求.因此,石墨炔作为电极材料在电容器中展现了很好的电化学性能.
2.5 金属空气电池
金属空气电池以轻质活泼金属为负极,以空气中的氧气为正极,具有安全性高、容量大、能量密度高、放电电压稳定及环境友好等优势.氧还原反应(ORR)是金属空气电池的重要反应过程.传统上,铂(Pt)基材料被用作ORR的电催化剂[55].但由于铂是一种贵金属,价格高且储量有限,使用铂作为催化剂将限制金属空气电池的商业化.此外,在CO或甲醇存在的情况下,用于ORR的Pt基催化剂也存在耐久性欠佳和失活问题[56].碳基无金属催化剂具有成本低、储量丰富、耐氧化和耐甲醇等优点,是贵金属氧还原反应的理想替代品.许多杂原子掺杂的碳材料均表现出高的ORR活性[57].
结合石墨炔可以调控的特性,可以从异原子掺杂石墨炔中找寻合适的贵金属氧还原反应的替代催化剂.Lv等[57]以三炔基苯为前驱体,在铜箔表面通过交叉耦合反应合成了HsGDY.然后,在高温氨气中处理HsGDY,得到N掺杂的HsGDY(N-HsGDY)[图6(A)],实验和理论计算结果表明,它对ORR具有显著的催化活性.从图6(B)中可以看出,吡啶N是容易形成的,HsGDY提供了丰富的活性位置或缺陷位点.图6(C)显示出N-HsGDY的催化活性有了很大的提高,电势在0.2~1.1 V之间的活性均高于Pt/C(JM).N-HsGDY在碱性介质中的ORR活性高于市售的Pt/C(质量分数20%,JM),其催化稳定性和耐甲醇性也优于Pt/C(JM).N-HsGDY在酸性介质中的催化性能也可与Pt/C(JM)媲美.所以,这些在HsGDY中掺杂的吡啶N位点对ORR具有较高的催化活性.此外,Lv等[58]将具有特定构型的氮选择性地掺杂到碳骨架中,设计合成了一种新的碳基材料—PyN-GDY,使石墨炔的每个苯环中都有1个碳原子被吡啶取代[图6(D)].PyN-GDY由吡啶环和乙炔键组成,是一个理想的吡啶氮掺杂结构模型.图6(E)中只在399.9 eV处有1个峰,属于吡啶氮,说明该材料的分子结构相对明确,仅含吡啶氮.由图6(F)可见,极化曲线上PyN-GDY的起始电位、半波电位和有限电流密度分别为1.0 V,0.84 V和5.5 mA/cm2,优于大多数报道的无金属催化剂.如图6(G)所示,以PyN-GDY为电极的锌空气电池的开路电压高达1.51 V,略高于Pt/C的开路电压,且最大功率密度为130 mW/cm2[图6(H)],可以与Pt/C相媲美.在电流密度为20 mA/cm2时,电池的比放电容量达到了647 mA·h/g,略高于Pt/C的641 mA·h/g[图6(I)].由图6(J)可以看到,电池的充放电电位在经过150 h次循环后仍然保持不变,说明其具有良好的循环性能.上述结果表明吡啶氮是碳材料中有效的氮掺杂类型,该研究为开发金属空气电池和其它储能设备的选择性掺杂碳材料提供了新的途径.

Fig.6 N⁃doped GDY and transition metal doped GDY applied for Zn⁃air batteries
引入异原子的石墨炔具有丰富的活性位点,在ORR中展现了显著的催化活性,甚至高于市售的Pt/C(20%,JM),有效解决了Pt基催化剂在CO或甲醇情况下的失活问题,同时满足环境友好、低成本、耐甲醇、耐氧化等条件,可以说石墨炔是金属空气电池中贵金属氧还原催化剂的理想替代品.
2.6 电极保护
随着对高能量密度可充电电池需求的不断增长,锂金属负极因其较大的理论容量和较低的还原电位而被认为是最有潜力的电极候选者[12].然而,由于金属锂在大多数有机电解质中具有相对活性,且在电极界面上沉积不规则,严重阻碍了锂负极电池的实际应用.特别是锂枝晶的不规则生长以及不稳定SEI膜的坍塌给锂金属负极带来严重的安全问题,如内部短路或电池爆炸等,因此,对电极的保护研究引起了科研人员的重视.
从诱导无枝晶锂金属负极均匀成核和沉积的亲锂角度出发,Wang等[59]开发了一种通过乙炔键填充石墨炔的纳米薄片.锂原子与乙炔键相互作用,纳米片结构可以降低界面电阻,有效抑制锂枝晶无序生长,形成无枝晶锂金属负极.在电流密度为2 mA/cm2的条件下,基于乙炔键填充石墨炔纳米薄片方法的锂负极可以实现1000次以上的稳定电镀-剥离过程,与Li4Ti5O12正极所组成的电池表现出长期的循环稳定性.该研究通过调节乙炔键在亲锂碳层中的分布,促进了无枝晶锂金属负极的均匀成核和沉积,有望促进锂负极在下一代充电电池中的广泛应用.
此外,通过改善SEI层来进行电极保护也是一种有效的思路.Wang等[60]在工业铝箔上设计并制备了新型噻吩石墨炔(Thi-Dy),它可以作为双离子电池负极材料的保护层,提高循环稳定性.由于引入的噻吩与电解液中的乙酰官能团具有强相互作用,人工合成的Thi-Dy可以促进增强的杂化SEI层的形成.非原位测量结果证实,增强的SEI层与人工的Thi-Dy层形成了协同效应,为调节锂离子的插入和扩散提供了更有效的途径,延缓了锂铝合金的粉碎和体积膨胀.因此,与工业铝箔相比,Thi-Dy材料使电池具有更高的容量和更好的容量保持率,循环性能更好.同时,该研究也为下一代储能设备的金属电极保护提供了一种有效的方法.
综上所述,石墨炔在电极保护方面展现了潜力,有望通过电极保护在电池安全保障方面做出更大的贡献.
3 总结与展望
石墨炔作为电极材料在锂离子电池、钠离子电池、锂硫电池、金属空气电池及电容器等方面展现了广阔的发展前景,大量对石墨炔的理论计算和实验都取得了重大进展,也证明石墨炔及其异原子掺杂材料在电极材料应用方面具有特殊的优势:(1)石墨炔类材料具有良好的电导率和孔隙结构,在储能器件中展现出良好的电化学性能和高功率密度;(2)石墨炔类材料富含活性储能位点,可以有效提高储能器件的能量密度;(3)由于石墨炔的结构、功能可调节且合成路线温和,许多包含异原子的石墨炔可以被设计并合成,杂化石墨炔的多样性提供了不同的化学结构和电子结构,为进一步实现优越的电化学性能奠定了基础.
虽然石墨炔在实验上已经取得了较好的成果,并在电化学储能装置中展现了很大的潜力,但是在实际生产中的应用还有很长的路要走,其电化学性能还有待进一步研究:(1)对石墨炔类材料的形貌进行修饰(例如石墨炔纳米片)或者进行异原子掺杂(例如氮掺杂、氟掺杂等)可能会表现出新颖的性质;(2)新的石墨炔复合材料可能会更有效地提高石墨炔的电化学性能;(3)石墨炔是多种离子存储的理想选择,在多价离子电池和双离子电池中的应用前景很大;(4)杂化石墨炔具有优异的机械性能和特殊的化学结构,有望被用于保护金属阳极使其不受腐蚀;(5)石墨炔对O2的吸附能力和乙炔键上的电子使其在金属空气电池中也有望显示出更好的性能.
