lncRNA CASC19靶向miR-490-3p调控骨肉瘤细胞增殖、迁移和侵袭的分子机制*
2021-02-26周剑张香刘林梁涛
周剑 张香 刘林 梁涛
(自贡市第三人民医院 1.骨科;2.药剂科,四川 自贡 643020)
骨肉瘤(Osteosarcoma,OS)是一种易发于青少年的原发于骨组织的恶性肿瘤,虽然手术联合化疗的综合治疗取得一定的进步,但其易复发且易转移,致残率和死亡率依然很高,治疗效果不理想[1]。从分子水平研究骨肉瘤的发生和发展已成为研究热点,全新的特异性分子靶向治疗为提高骨肉瘤的治疗效果和方向提供了新思路[2]。近年来,研究发现lncRNA(long non-coding RNA)在骨肉瘤中异常表达,其通过与蛋白质、mRNA、miRNA等相互作用影响骨肉瘤细胞的增殖、侵袭和迁移[3]。通过研究在lncRNA骨肉瘤治疗中的作用靶点可以为其治疗提供一种新手段。肿瘤易感候选基因19(cancer susceptibility candidate 19,CASC19)是一种lncRNA,研究发现lncRNA CASC19在结直肠癌中高表达,可能促进结直肠癌的转移[4]。研究发现miR-490-3p通过靶向HMGA2抑制骨肉瘤细胞增殖,诱导细胞凋亡[5]。而lncRNA CASC19对骨肉瘤增殖、迁移和侵袭及其机制是否与miR-490-3p有关还尚未见报道,本实验旨在研究lncRNA CASC19与miR-490-3p的关系及其对骨肉瘤增殖、迁移和侵袭的影响。
1 材料与方法
1.1 材料 骨肉瘤细胞系MG63、U2-OS、OS187和健康人成骨细胞hFOB1.19购自中国科学院上海细胞库;胎牛血清、RPMI-1640培养基、胰蛋白酶购自美国Gibico公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;MTT试剂盒、DMSO、BCA试剂盒、PBS缓冲液购自Sigma公司;双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;Trizol试剂、反转录试剂盒、荧光定量试剂盒购自日本TaKaRa公司;抗体购自北京博奥森生物科技有限公司;Transwell小室、Matrigel胶购于美国BD公司;RIPA蛋白裂解液、SDS-PAGE试剂盒购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 细胞培养 骨肉瘤细胞系MG63、U2-OS、OS187和健康人成骨细胞hFOB1.19使用含10 %胎牛血清的RPMI-1640培养基于37 ℃、5% CO2饱和湿度条件下培养,每天换液一次,待细胞融和至80%左右时,加入胰蛋白酶进行消化传代,选取处于对数生长期的细胞进行实验。
1.2.2 细胞转染与分组 取常规培养的骨肉瘤细胞MG63用0.25 %胰蛋白酶消化后接种于96孔板中,待细胞生长至80%融合,更换为无血清培养基同步化12 h,随后进行转染。转染分为si-con组(转染si-con)、si-CASC19组(转染si-CASC19)、pcDNA组(转染pcDNA)、pcDNA-CASC19组(转染pcDNA-CASC19)、miR-con组(转染miR-con)、miR-490-3p组(转染miR-490-3p mimics)、si-CASC19+anti-miR-con组(共转染si-CASC19和anti-miR-con)、si-CASC19+ anti-miR-490-3p组(共转染si-CASC19和anti-miR-490-3p),转染按照LipofectamineTM2000试剂盒进行操作。
1.2.3 qRT-PCR检测miR-490-3p和CASC19表达水平 收集各组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA纯度和浓度。使用TaKaRa反转录试剂盒将RNA反转录成cDNA,按照TaKaRa 荧光定量试剂盒使用说明配制反应体系,以β-actin为内参进行PCR扩增,每个样品重复3次,循环条件为95 ℃ 30 s,60 ℃ 30 s;72 ℃ 30 s,共40个循环;60 ℃延长5 min。相对表达量采用2-ΔΔCt法计算。miR-490-3p和CASC19分别以U6和GAPDH为内参,miR-490-3p上游引物序列:5′-GCAAACAACCATTCGGCTGTC-3′;下游引物序列:5′-CGCAGGTCCGGAGTAGGT-3′;U6上游引物序列:5′-GCTTCGGCAGCACATATACTAAAAT-3′;下游引物序列:5′-CGCTTCACGAATTTGCGT GTCAT-3′;CASC19上游引物序列:5′-GAGGAAGG CAGCACAATGATG-3′;下游引物序列:5′-CTTGCC AGTGTCTTCTCCTGA-3′;GAPDH上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.4 Western blot检测蛋白的表达 收集各组细胞,加入RIPA裂解液裂解,4 ℃,12000 g离心15min,收集蛋白上清液,BCA试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5 % 脱脂奶粉封闭液室温封闭1 h。分别加入一抗(1∶1000),4℃孵育过夜,TBST洗膜;加入二抗(1∶2000)室温孵育2 h,TBST洗涤3次,每次10min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用Quantity One凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和β-actin条带的比值作为蛋白表达水平。每个蛋白样品设3个重复。
1.2.5 MTT检测细胞增殖 在各组细胞培养至24h、48h、72h时加入20 μL(5 g/L)的MTT溶液,继续孵育4 h;弃去多余培养基并加入150 μL DMSO振荡反应10 min,酶标仪检测490 nm处吸光度(A)值。细胞活性(%)=实验组A值/空白对照组A值×100%。
1.2.6 Transwell检测细胞迁移和侵袭 在各组细胞,胰酶消化后使用无血清培养基重悬细胞,调整浓度为2×104个/mL。细胞迁移实验:取200 μl细胞悬液接种于Transwell小室上室中,并置于含完全培养基的下室中,37 ℃、5 % CO2条件下培养24h,取出小室,去除培养基后用棉签轻轻擦去上层细胞,PBS洗涤,加入4%多聚甲醛固定30min,0.1%结晶紫染色10min,显微镜观察并随机选取5个视野拍照,计算结晶紫染色细胞数即为迁移细胞数。细胞侵袭实验:以1:5比例加入RPMI 1640培养液稀释Matrigel后,铺于Transwell小室的上室,室温下干燥后,按照细胞迁移实验步骤操作。最后显微镜下观察结晶紫染色细胞数即为侵袭细胞数。
1.2.7 荧光素酶报告基因检测实验检测CASC19对miR-490-3p的靶向调控 TargetScan数据库显示CASC19 3′UTR区域有miR-490-3p结合位点。构建野生型和突变型基因靶点CASC19的3′UTR-荧光素酶表达载体(WT-CASC19和MUT-CASC19),取对数生长期乳腺癌细胞接种于24孔板(5×104个/孔),待细胞生长至80 %融合时,用LipofectamineTM2000将WT-CASC19和MUT-CASC19组细胞分别转染miR-con和miR-490-3p。依据说明书要求,使用荧光素酶报告基因检测仪进行双荧光素酶报告实验测定。实验结果以荧光素酶活性和Renilla活性的比值进行统计学分析,实验重复3次。

2 结果
2.1 骨肉瘤细胞系中CASC19和miR-490-3p的表达 qRT-PCR检测结果(图1)显示,与健康人成骨细胞hFOB1.19相比,骨肉瘤细胞系MG63、U2-OS、OS187中miR-490-3p的表达水平显著降低,CASC19 的表达水平显著升高(P< 0.05)。

图1 骨肉瘤细胞系中CASC19和miR-490-3p的表达
2.2 干扰CASC19表达对骨肉瘤细胞MG63增殖的影响 MTT法检测结果(图2A)显示,与si-con组相比,si-CASC19组骨肉瘤细胞活性显著降低(P<0.05);qRT-PCR检测结果(图2B)显示,与si-con组相比,si-CASC19组CASC19 的表达水平显著降低(P<0.05);Western blot检测结果(图2C,D)显示,与si-con组相比,si-CASC19组骨肉瘤细胞MG63中CDK1、Cyclin D1表达水平显著降低(P<0.05)。可见,干扰CASC19表达抑制骨肉瘤细胞MG63增殖。
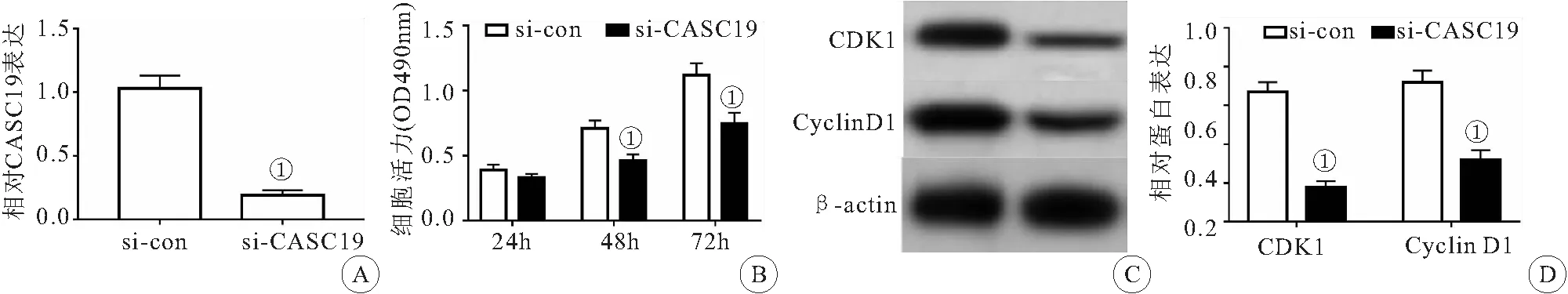
图2 干扰CASC19表达对骨肉瘤细胞MG63增殖的影响
2.3 干扰CASC19表达对骨肉瘤细胞MG63迁移和侵袭的影响 Transwell 法检测结果(图3A,B)显示,与si-con组相比,si-CASC19组骨肉瘤细胞MG63迁移和侵袭数量显著降低(P<0.05)。Western blot检测结果(图3C,D)显示,与si-con组相比,si-CASC19组骨肉瘤细胞MG63中MMP-2和MMP-9蛋白的表达水平显著降低(P<0.05)。可见,干扰CASC19表达抑制骨肉瘤细胞MG63迁移和侵袭。

图3 下调CASC19表达对骨肉瘤细胞MG63增殖、迁移、侵袭的影响
2.4 CASC19靶向调控miR-490-3p的表达 通过TargetScan数据库预测到CASC19与miR-490-3p存在结合位点(图4A)。荧光素酶报告基因检测实验结果(图4B)显示,转染野生型CASC19基因表达载体WT-CASC19后,相较于miR-con组,miR-490-3p组WT-CASC19骨肉瘤细胞的荧光素酶活性显著降低(P<0.05);而转染突变型CASC19基因表达载体MUT-CASC19后,相较于miR-con组,miR-490-3p组MUT-CASC19骨肉瘤细胞的荧光素酶活性差异不显著。Western blot检测结果(图4C)显示,相较于si-con组,si-CASC19组骨肉瘤细胞中miR-490-3p的表达水平显著升高;相较于pcDNA组,pcDNA-CASC19组乳骨肉瘤细胞中miR-490-3p的表达水平显著降低(P<0.05)。可见,CASC19可靶向调控miR-490-3p的表达。

图4 CASC19靶向调控miR-490-3p的表达
2.5 过表达miR-490-3p对骨肉瘤细胞MG63增殖、迁移、侵袭的影响 qRT-PCR检测结果(图5A)显示,与miR-con组相比,miR-490-3p组中miR-490-3p的表达水平显著升高(P<0.05)。Western blot检测结果(图5B,C,E,F)显示,与miR-con组相比,miR-490-3p组骨肉瘤细胞MG63中CDK1和CyclinD1蛋白的表达水平显著降低,MMP-2和MMP-9蛋白的表达水平显著降低(P<0.05)。MTT法检测结果(图5D)显示,与miR-con组相比,miR-490-3p组骨肉瘤细胞活性显著降低(P<0.05)。Transwell 法检测结果(图5G)显示,与miR-con组相比,miR-490-3p组骨肉瘤细胞迁移、侵袭数显著降低(P<0.05)。可见,过表达miR-490-3p抑制骨肉瘤细胞MG63增殖。

图5 上调miR-490-3p表达对骨肉瘤细胞MG63增殖、迁移、侵袭的影响
2.6 miR-490-3p抑制物部分逆转沉默CASC19表达对骨肉瘤细胞MG63增殖、迁移、侵袭的作用 qRT-PCR检测结果(图6A)显示,与si-con组相比,si-CASC19组中miR-490-3p的表达水平显著升高;与si-CASC19+anti-miR-con组相比,si-CASC19+anti-miR-490-3p组中miR-490-3p的表达水平显著降低(P<0.05)。Western blot检测结果(图6C,D)显示,与si-con组相比,si-CASC19组骨肉瘤细胞MG63中CDK1、CyclinD1、MMP-2和MMP-9蛋白的表达水平显著降低;与si-CASC19+anti-miR-con组相比,si-CASC19+anti-miR-490-3p组骨肉瘤细胞MG63中CDK1、CyclinD1、MMP-2和MMP-9蛋白的表达水平显著升高(P<0.05)。MTT法检测结果(图6B)显示,与si-con组相比,si-CASC19组骨肉瘤细胞活性显著降低;与si-CASC19+anti-miR-con组相比,si-CASC19+anti-miR-490-3p组骨肉瘤细胞活性显著升高(P<0.05)。Transwell 法检测结果(图6E)显示,与si-con组相比,si-CASC19组骨肉瘤细胞迁移和侵袭数量显著降低;与si-CASC19+anti-miR-con组相比,si-CASC19+anti-miR-490-3p组骨肉瘤细胞迁移和侵袭数量显著降低(P<0.05)。可见,抑制miR-490-3p表达可部分逆转沉默CASC19表达对骨肉瘤细胞MG63增殖、迁移和侵袭的抑制作用。

图6 抑制miR-490-3p表达逆转沉默CASC19表达对骨肉瘤细胞MG63增殖、迁移、侵袭的抑制作用
3 讨论
骨肉瘤在临床骨科肿瘤中发病率最高,严重危害人类健康,其治疗总体难度较大,随着新的化疗方式的出现,患者生存率和预后获得了较大的改善,但骨肉瘤耐药的出现导致其效果不佳[6]。分子靶向药物在肿瘤治疗领域发挥了重要作用,寻找可能的靶点对骨肉瘤治疗提供了新途径和前期的理论基础[7]。长链非编码RNA作为非编码RNA的一种,其对骨肉瘤细胞的生长、增殖、迁移、侵袭以及骨肉瘤的发生、发展、耐药性和预后具有重要的调控作用,可作为骨肉瘤发病诊断和临床治疗潜在的生物标志物[8]。研究发现CASC2在骨肉瘤中下调表达,过表达可抑制骨肉瘤细胞的增殖,迁移和侵袭[9]。CASC2通过miR-362-5p/Nf-κB调节肝细胞癌细胞的发生[10]。CASC2通过miR-18a抑制结肠癌的增殖[11];CASC19可促进结直肠癌的转移[4];CASC11通过激活WNT/β-catenin通路以促进结直肠癌的生长和转移[12];CASC15可通过调节miR-4310/LGR5/Wnt/β-catenin信号通路促进结肠癌细胞增殖和转移[13];CASC15还通过靶向miR-33a-5p促进舌鳞状细胞癌的进展[14]。本研究结果显示,CASC19在骨肉瘤细胞中高表达,干扰CASC19表达均可抑制骨肉瘤细胞MG63增殖、迁移和侵袭;抑制CDK4、Cyclin D1、MMP-2、MMP-9蛋白的表达。
研究表明miRNA在骨肉瘤中差异性表达,miRNA可作为骨肉瘤诊断及预后的特异性无创生物学指标[15]。研究发现miR-490-3p在骨肉瘤细胞中下调表达[16],miR-490-3p通过在骨肉瘤中靶向HMGA2来调节细胞增殖和凋亡[17];lncRNA CCAT1通过miR-490-3p上调TGFβR1,促进TGFβ1诱导的卵巢癌细胞EMT[18];CircSLC3A2通过miR-490-3p调节PPM1F表达在肝癌中起致癌因子的作用[19]。miR-490-3p可通过转录因子Smad2抑制结直肠癌细胞的侵袭、迁移的功能[20]。TTTY10通过靶向调节miR-490-3p,并通过HMGB1信号通路影响宫颈癌细胞的迁移和侵袭能力[21]。本实验结果显示,在骨肉瘤细胞中miR-490-3p的表达水平显著降低,过表达miR-490-3p可抑制骨肉瘤细胞MG63增殖、迁移和侵袭;抑制CDK4、Cyclin D1、MMP-2、MMP-9蛋白的表达。而且本实验结果表明CASC19可靶向调控miR-490-3p的表达,抑制miR-490-3p表达能逆转干扰CASC19对骨肉瘤细胞MG63增殖、迁移、侵袭的抑制作用。
4 结论
干扰lncRNA CASC19可能通过上调miR-490-3p的表达抑制骨肉瘤细胞的增殖、迁移和侵袭,这为骨肉瘤的防止治提供了新的靶点。
