基于网络药理学探析黄精干预认知障碍的可能机制▲
2021-02-26李翠萍赵红晔王璐璐齐晓娟周忠光
王 洋 李翠萍 赵红晔 王璐璐 齐晓娟 周忠光
(1 齐齐哈尔医学院生理教研室,黑龙江省齐齐哈尔市 161000,电子邮箱:Rachal830813@qq.com;2 黑龙江中医药大学基础医学院,哈尔滨市 150040; 3 齐齐哈尔医学院附属第三医院妇科,黑龙江省齐齐哈尔市 161000; 4 齐齐哈尔医学院解剖教研室,黑龙江省齐齐哈尔市 161000)
人口老龄化已经成为一个全球性问题[1],人口结构的重大变化导致与年龄相关的疾病发病率急剧上升[2]。随着年龄的增长,老年人的认知能力可以从正常的认知能力下降到主观认知障碍,再由轻度认知障碍转变为痴呆[3]。认知障碍给社会和公共医疗资源造成沉重负担,而药物是预防和治疗认知障碍疾病的重要手段。中药治疗认知障碍是近年来研究的热点[4]。黄精是百合科黄精属植物,药用部位为其干燥根茎。陶弘景的《名医别录》中记载了黄精,其归肺、脾、肾经,是历代健脾补肾、益气滋阴的良药[5]。黄精主要含甾体皂苷类、黄酮类、多糖、生物碱类及苯丙素类等成分,具有抗衰老、抗高血脂、保护神经系统、降血糖、保护心脑血管、抗肿瘤、抗氧化等药理作用[6]。既往研究表明,黄精可通过调控神经细胞的凋亡、抗氧化、改善神经血管单元的微结构来影响神经系统的结构和功能,可用于治疗相关神经系统疾病[7],具有改善学习记忆等效果,但目前关于黄精能否用于防治老年痴呆及其改善认知功能障碍的有效成分、作用靶点与分子机制的研究较少见。
网络药理学是以系统生物学和多聚药理学理论为基础,利用网络分析技术和网络可视化揭示药物、靶点和疾病之间复杂的生物网络关系,预测药理机制的新型研究模式[8]。网络药理学能够检测中药活性成分的明确靶点并确定其功能[9],使得中药研究途径由目前的“单一靶点、单一药物”模式向新的“多靶点、多成分”模式转变[10]。因此,本研究基于中药网络药理学方法,筛选黄精治疗认知障碍的生物活性成分,探讨其可能的分子生物学机制。
1 材料和方法
1.1 黄精有效化合物的筛选 通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP;https://tcmspw.com/index.php),以口服生物利用度(oral bioavailability,OB)≥30%和药物相似性(drug-likeness,DL)≥0.18为阈值,筛选黄精的有效化合物。
1.2 黄精有效化合物靶点的筛选 通过TCMSP确认黄精有效成分对应的靶点。为全面预测靶点,采用SwissTargetPrediction数据库(www.swisstargetprediction.ch)再次筛选,以补充有效化合物靶标。将TCMSP数据库与SwissTargetPrediction数据库预测结果进行比对,去重复值,并通过UniProt数据库(https://www.uniprot.org/)进行标准名称规范化处理。
1.3 认知障碍疾病相关靶点的预测 以“cognitive impairment”“mild cognitive impairment”“dementia”“Alzheimer′s disease”为检索词,分别从Therapeutic Target Database (TTD,http://bidd.nus.edu.sg/group/cjttd/)、DrugBank(https://go.drugbank.com/)、OMIM(https://omim.org/)、GeneCards(https://www.genecards.org/)数据库获取相关靶标,删除重复靶点,获得认知障碍疾病相关靶点。
1.4 黄精与认知障碍疾病的共同靶点的筛选 将筛选出的黄精有效化合物靶点和认知障碍疾病相关靶点导入Venny 2.1平台(https://bioinfogp.cnb.csic.es/),得到黄精与认知障碍疾病的共同靶点。
1.5 蛋白质-蛋白质相互作用网络的构建和可视化分析 利用STRING 11.0平台(https://string-db.org/)构建黄精与认知障碍疾病共同靶点的蛋白质与蛋白质相互作用(protein-protein interaction,PPI)网络。选择物种为“Homo sapiens”,设置置信度≥0.4,构建PPI网络。利用Cytoscape 3.7.2 软件绘制可视化交互网络,其中,使用“Network Analyzer”插件计算网络拓扑参数,分别以靶点作用度值(Degree)和靶点互作综合评分(Combined-Score)调节节点大小、边的粗细及渐变颜色,绘制PPI可视图形。利用Circular Genome Data Visualization平台(http://circos.ca/)将黄精有效化合物与其靶点的映射关系进行可视化。
1.6 基因本体论和京都基因和基因组百科全书富集分析 针对黄精与认知障碍疾病的共同靶点,利用Metascape数据库(https://metascape.org/)从细胞组分、分子功能、生物进程 3个层面进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,设置P<0.01,获取分析结果后,输入微生信平台(http://www.bioinformatics.com.cn/)在线绘图,获取可视化图形。
2 结 果
2.1 黄精的有效化合物 通过TCMSP筛选出符合标准的黄精有效化合物共12个,各化合物的相关参数见表1。黄精有效化合物的2D分子结构图见图1。

表1 黄精有效化合物的相关参数
图1 黄精有效化合物的2D分子结构图
2.2 黄精有效化合物的靶点 通过TCMSP检索共获得黄精靶点114个。经SwissTargetPrediction数据库预测,共获得预测靶点123个。将两个数据库的检索结果进行比对,去除重复靶点并根据UniProt数据库校正后,共鉴定出141个黄精有效化合物的靶点。
2.3 认知障碍疾病相关靶点的预测结果 经TTD、DrugBank、GeneCards和OMIM数据库预测,分别获得141个、63个、1 185个、669个与认知障碍疾病相关的靶点,去除重复靶点后最终共获得1 880个疾病靶点,见图2。
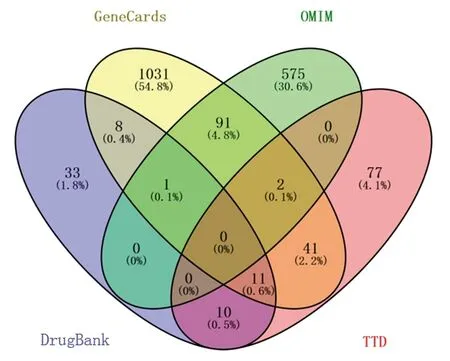
图2 4个数据库所获疾病靶点的韦恩图
2.4 黄精与认知障碍疾病的共同靶点及其PPI网络 利用Venny平台对141个黄精有效化合物靶点与1 880个认知障碍疾病靶点取交集,筛选得到66个共同靶点,即为黄精干预认知障碍的重要靶点,见图3。利用STRING 11.0平台构建66个共同靶点的PPI网络图,得到66个节点和508条连线,如图4。利用Cytoscape 3.7.2软件绘制可视化PPI网络图,中心节点是度值最大的靶点,节点随着度值减小而变小且远离中心,见图5;根据靶点度值(Degree)排序,排名靠前的靶点包括蛋白激酶B(protein kinase B,AKT)1、CASP3、TP53、JUN、血管内皮生长因子(vascular endothelial growth factor,VEGF)A、β淀粉样前体蛋白(amyloid beta precursor protein,APP)、PTGS2、CAT、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)14、哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)等,靶点具体信息见表2。筛选出的66个共同靶点共对应黄精中的8种有效化合物,利用Circular Genome Data Visualization平台将黄精中的8种有效化合物与66个疾病靶点的映射关系进行可视化,Circos关系图提示5,4′-二羟基黄酮、黄芩素、薯蓣皂苷元、β-谷甾醇募集到的靶点较多,见图6。
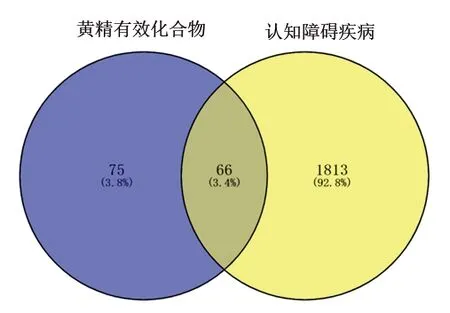
图3 黄精有效化合物靶点与认知障碍疾病靶点的韦恩图
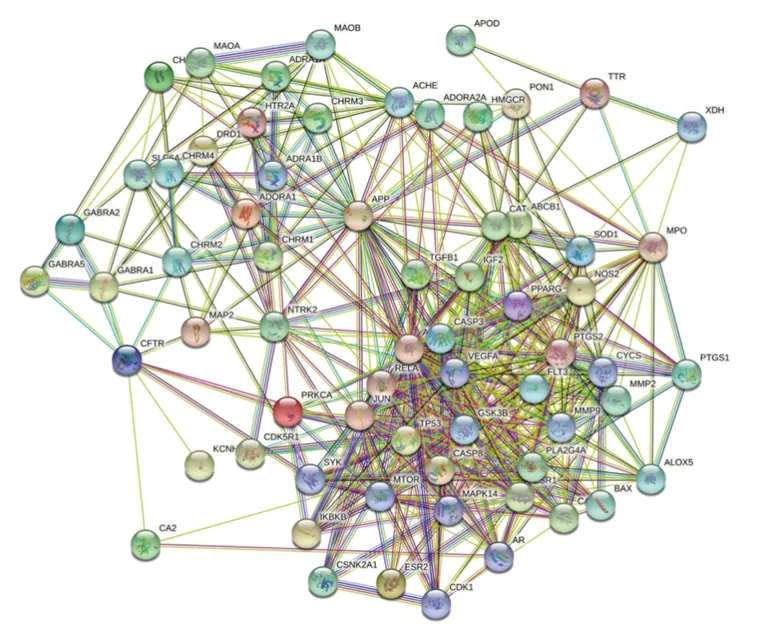
图4 黄精有效化合物与认知障碍疾病共同靶点的PPI网络图
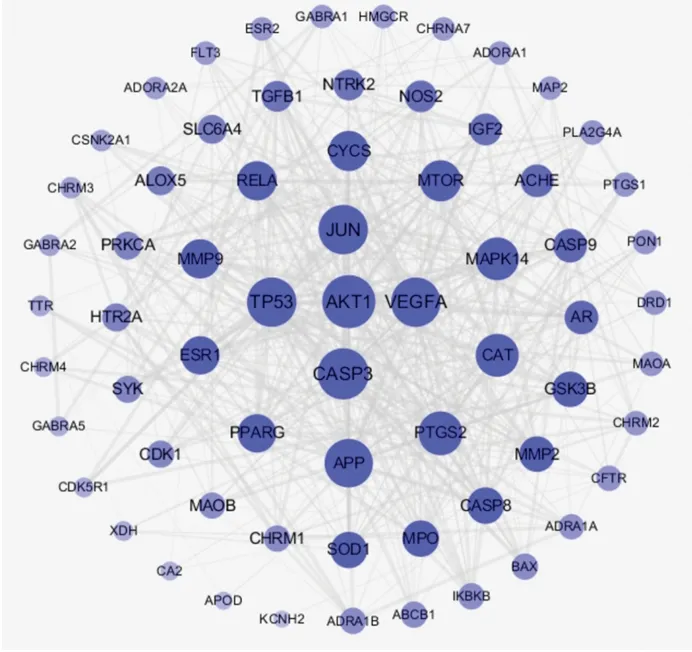
图5 黄精干预认知障碍的靶点的可视化图

表2 黄精干预认知障碍的重要靶点
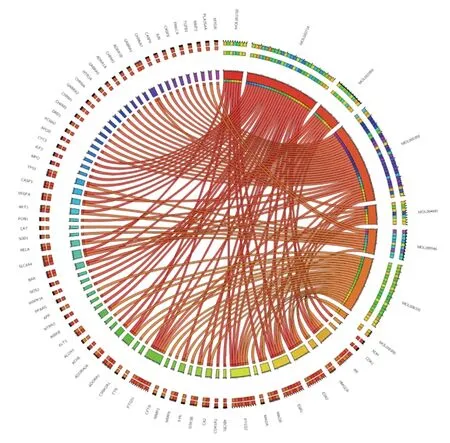
图6 黄精有效化合物与疾病靶点的Circos关系图
2.5 GO功能富集分析 黄精干预认知障碍66个的靶点主要分布在突触、分泌颗粒内腔、神经元投射区、细胞器被膜腔、线粒体包膜、轴突、富含Ficolin-1颗粒腔、胞质无核区域、核外围、吞噬泡等部位,见图7A;涉及的生物学进程包括细胞对氮化合物的反应、MAPK级联反应正调控、突触信号、老化、血液循环、神经元死亡、肽酰丝氨酸磷酸化、跨膜受体蛋白酪氨酸激酶信号通路、活性氧代谢过程调节等,见图7B;涉及的分子功能包括神经递质受体活动、蛋白域特异性结合、铵离子结合、氧化还原酶活性、蛋白质同源二聚活性、配体门控阴离子通道活性、磷酸酶结合、转录因子结合等,见图7C。

图7 黄精干预认知障碍的靶点的GO功能富集分析
2.6 KEGG通路富集分析 根据P<0.01的阈值筛选出排名前20的通路,见表3。主要包括癌症通路、神经活性配体-受体相互作用通路、5 -羟色胺通路、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)-AKT信号通路、内分泌抵抗通路、可卡因成瘾通路、环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号通路、帕金森病相关通路、催乳素信号通路、AMP活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路、核因子κB(nuclear factor kappaB,NF-κB)信号通路、血管平滑肌收缩相关通路、过氧化物酶体通路等通路。见表3。
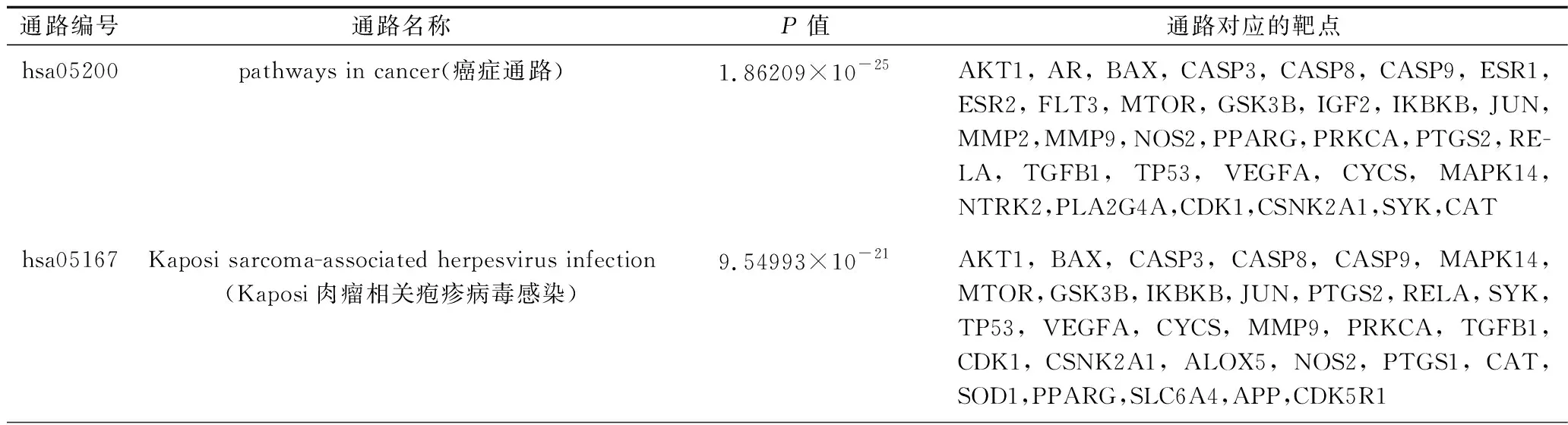
表3 黄精干预认知障碍的靶点的KEGG通路富集分析结果(排名前20)

续表3
3 讨 论
认知障碍在中医学中属于“痴呆”的范畴,主要表现包括语言错误、思维迟钝、健忘等[4]。中国现存最早的医学著作《黄帝内经》有类似痴呆症状的描述。唐代医王孙思邈在《华佗神医密传》中首次提出“痴呆”之名。明代医家张景岳在《景岳全书》中阐述了痴呆的病因病机,他提出该病由郁结、不遂、思虑、惊恐等病因积渐而成,临床表现变化多端。清代医家王清任在《医林改错·脑髓说》中指出,老年肝肾亏损、脑髓失充是本病的主要原因。故本病形成以年老肾衰,肾虚不能化精,髓海失充,以至髓不能养脑,脑失滋养枯萎,萎则神机不用而发为痴呆,亦可由痰瘀实邪痹阻脑络,清窍失养所致。治疗常以补肾填精、补益气血治其本。黄精是临床常用的滋肾填精中药,也是治疗痴呆类疾病方剂的首选药材。
本研究共筛选出黄精有效化合物12个及其靶点141个,与1 880个疾病靶点取交集后获得的66个共同靶点即为黄精干预认知障碍的重要靶点,以此建立了黄精有效化合物与疾病靶点的Circos关系图,Circos关系图提示5,4′-二羟基黄酮、黄芩素、薯蓣皂苷元、β-谷甾醇4种有效化合物募集到的靶点较多。其中,5,4′-二羟基黄酮属于黄酮类化合物,黄酮类化合物通过与负责记忆的大脑细胞和分子结构相互作用及减少神经退化,可有效地逆转与年龄相关的神经认知能力下降[11]。5,4′-二羟基黄酮具有很强的抗氧化、抗炎和信号通路调节作用,对PI3K/AKT和MAPK通路均有影响;同时能够调控海马区促生存转录因子和诱导特异性基因表达,可改善动物和人类年龄相关的认知功能衰退及神经退行性疾病,因此具有抗阿尔茨海默病的作用[12]。黄芩素也是黄精中重要的黄酮类化合物之一,其在体内外实验中均表现出强大的神经保护作用[13]。有学者认为黄芩素重建突触可塑性和改善认知功能的神经保护作用与激活PI3K和AKT磷酸化以及抑制糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3β)磷酸化有关[14-15]。薯蓣皂苷元可通过增强神经递质5-羟色胺信号通路保护海马免受炎症损伤[16],同时其也具有抗氧化能力和抑制淀粉样低聚物形成的作用[17]。β-谷甾醇治疗可减轻APP/早老素基因1双转基因小鼠的认知缺陷和防止β淀粉样蛋白的沉积[18]。
PPI网络中,按度值大小排序,排在前面的靶点为AKT1、APP、MTOR、VEGFA、MAPK14等,其也是黄精干预认知障碍的关键靶点。AKT1是3种丝氨酸/苏氨酸蛋白激酶(AKT1、AKT2、AKT3)之一,其可调节凋亡平衡,从而抑制促凋亡细胞因子、激活抗凋亡细胞因子的活性,进而影响神经元的存活[19]。活化的AKT是GSK-3β蛋白重要的上游调控因子,AKT可通过促进GSK-3β蛋白Ser9位点磷酸化,从而抑制GSK-3β蛋白活化,并进一步降低Tau蛋白的磷酸化水平,提高阿尔茨海默病小鼠的认知功能[14]。APP可经淀粉样代谢途径在β分泌酶和γ分泌酶的作用下产生可溶性β淀粉样蛋白,而β淀粉样蛋白代谢异常与神经元退化和认知损害密切相关,也是阿尔茨海默病发病机制的核心环节[20]。mTOR是一种大型多结构域蛋白,存在于两种不同的多蛋白复合物中(即mTORC1和mTORC2),其被证明是神经细胞存活、分化和形态形成的关键因素,参与神经元的发育和成熟神经元的正常功能[21]。mTORC1是mTOR和AKT1的相关调控蛋白,下调mTORC1水平可改善不同阿尔茨海默病模型动物的学习和记忆缺陷[21]。VEGF家族在神经和血管形成过程中发挥重要作用,并参与血管生成调节、神经发生和神经元存活。研究表明,经VEGFA治疗可有效地促进阿尔茨海默病模型小鼠的认知功能恢复[22],VEGFA对阿尔茨海默病患者和具有高风险认知衰退人群具有特别的保护作用[23]。MAPK14在促炎细胞因子或物理应激等细胞外刺激下,引起细胞级联反应,通过调节自噬可使阿尔茨海默病小鼠淀粉样病变减少[24]。
GO功能富集分析结果显示,黄精干预认知障碍的潜在靶点涉及多个细胞组分、分子功能和生物学过程。其中生物学过程主要涉及细胞对氮化合物的反应、MAPK级联反应正调控、突触信号、老化、血液循环、神经元死亡等。其中,衰老是认知衰退的主要危险因素,会导致工作记忆和执行功能下降[25]。神经元程序性死亡包括神经干细胞衰竭、细胞凋亡增加、蛋白质聚集、活性氧增加导致线粒体功能障碍、蛋白质和脂质氧化损伤、DNA损伤的积累,其是大脑衰老的关键[26],因此与老年性认知功能减退的发生、发展密切相关。此外,血液循环调节过程亦影响着认知功能。脑血管疾病在认知功能障碍和痴呆的发生和发展中发挥着重要作用,这些疾病也会长期改变脑血流的调节,而正常情况下老年人的脑血流或脑循环调节也在减弱,推测由脑缺血导致的脑血流减少可能会影响衰老性认知功能减退[27]。有研究报告,Ras-MAPK通路中的基因结构突变会导致突触可塑性缺陷,表现为以认知障碍、智力减退为特征的神经发育障碍疾病[28]。以上均表明,黄精干预认知功能障碍可能涉及多个分子生物学过程。
本研究中,网络药理学筛选黄精改善认知功能的主要信号通路有:神经活性配体-受体相互作用通路、5-羟色胺通路、PI3K-AKT信号通路、内分泌抵抗、cAMP信号通路、帕金森病相关通路、AMPK信号通路、NF-κB信号通路、血管平滑肌收缩相关通路。(1)神经活性配体-受体相互作用通路:在该通路中,神经递质受体丰富多样,涵盖乙酰胆碱受体、单胺类递质受体、抑制性氨基酸类递质受体等。有学者发现,胆碱能神经支配减少是认知和神经退行性疾病特别是阿尔茨海默病患者认知能力下降的原因之一[29]。大量的动物和人体研究表明,N型乙酰胆碱配体有改善注意力、空间学习、工作记忆、识别记忆和执行功能等多个认知领域的功能[30-33]。多巴胺系统也具有调节衰老和认知能力的功能,如多巴胺D1受体(dopamine D1 receptor,DRD1)在各种大脑通路的神经传递中至关重要,它调节着包括自主运动、记忆、注意力和奖赏等关键功能。选择性激活DRD1可为靶点治疗神经退行性疾病和神经精神疾病提供新的思路[34]。γ-氨基丁酸等抑制性中间神经元受体可产生阶段性抑制和紧张性抑制,从而调节神经活动,这有助于在皮层回路中建立适当的网络动态,维持正常的认知[35],因此γ-氨基丁酸信号改变与精神和神经疾病相关的认知缺陷相关。(2)5-羟色胺信号通路:5-羟色胺神经元支配着大脑和脊髓的大部分区域,参与广泛的神经系统功能,在情绪和认知调节中发挥重要作用。有研究表明,5-羟色胺受体2A激动剂增强了人类的关联学习能力,其使用剂量与认知效应的产生相关联[36];5-羟色胺受体1A、5-羟色胺受体2、5-羟色胺受体3、5-羟色胺受体4和5-羟色胺受体6参与调节帕金森病患者常见的认知障碍、情绪障碍[37]。(3)PI3K/AKT信号通路:PI3K/AKT信号通路被认为是神经元存活的重要信号通路,在衰老和许多神经退行性疾病中,该通路可调节神经细胞存活和突触可塑性[28]。由胰岛素受体底物激活的PI3K触发了下游蛋白磷酸肌醇3,4,5 -三磷酸的激活,然后磷酸肌醇3,4,5 -三磷酸激活磷酸肌醇依赖性蛋白激酶(phosphoinositide-dependent protein kinase,PDK),PDK随后将AKT召集到质膜上,并磷酸化Thr308和Ser473残基上的AKT,完全激活的AKT进而刺激mTORC1[38]。有研究报告PI3K/AKT/mTOR级联功能障碍参与神经精神疾病的发生与发展[39]。在PI3K/AKT/GSK-3β介导的通路中,PI3K/AKT信号的选择性下调和GSK3β蛋白激酶活性升高与脑功能障碍的发病有关;抑制GSK3β在皮质和海马中的过表达可逆转啮齿动物的认知缺陷[40]。(4)内分泌抵抗通路:近年来,认知障碍与内分泌因素相关联越来越受到人们的关注,本研究中的信号通路富集分析结果也显示黄精干预认知障碍涉及内分泌抵抗机制。雌激素受体位于大脑中,尤其是在与学习和记忆有关的区域,如海马体和杏仁核,而雌激素受体1与健康老年人的认知能力下降有关[41]。(5)其他:此外,还有研究报道帕金森病相关通路、AMPK信号通路、催乳素信号通路、NF-κB信号通路与认知功能相关[42-45]。
综上所述, 黄精中的多种化合物可能通过调节多个靶点以调控MAPK 级联反应调控、老化、血液循环、神经元死亡等生物学过程,以及神经活性配体-受体相互作用、5-羟色胺、PI3K-AKT、内分泌抵抗等多个通路,从而发挥干预认知功能障碍的作用。黄精在改善认知功能方面具有显著优势,这或为扩展其药用范围提供了依据。然而本研究仅利用网络药理学方法进行预测和分析药物治疗作用的潜在分子机制,还需要进一步以细胞实验或动物模型进行相关验证。
