AAT基因转化杂交构树叶片组培筛选研究*
2021-02-24谢晓阳魏磊王伟景炳年陈谭星颜慧萍曹力凡常霞高正龙
谢晓阳,魏磊,王伟,景炳年,陈谭星,颜慧萍,曹力凡,常霞,高正龙
(1.河南省生物技术开发中心 河南省科学院天然产物重点实验室,河南 郑州 450002;2.河南省高新技术实业有限公司,河南 郑州 450002)
构树(Broussonetiapapyrifera)属于桑科(Moraceae)构属(Broussonetia)多年生乔木,又称褚桃,是一种具有重要价值的多功能树种[1]。构树叶可做蛋白饲料,树皮是造纸的优质原料,根、茎、叶、果实及种子均可入药[2]。构树具有分布广和适应性强的特性[3-4],雌雄异株,花期4—5月,果期6—9月。严格异交,其有性繁殖和无性繁殖迅速,世代周期短,株型多样,基因组紧凑,易转化,表型性状和遗传多样性丰富[5-6]。
杂交构树(HybridBroussonetiapapyrifera)是中国科学院植物研究所沈世华团队研究出的无性良种组培苗,其由落叶乔木系构树为父本,小灌木系构树为母本,杂交选育获得。历经十几年潜心研究并通过示范验证,是中国大部分地区均可种植的优质树种。采用现代农业育种技术,通过太空搭载育种,杂交选育等手段培育出了中科1号、2号、3号杂交构树,杂交构树101,杂交构树201等树种。杂交构树具有生长速度快,当年树高生长速度可到3~5 m;粗蛋白含量达到20%以上,饲用价值高[7],司炳文等[8]通过在构树青贮饲料中添加糖蜜和酶菌复合制剂获得优质的青贮饲料。由于构树对生物及非生物胁迫耐受性好以及叶片吸尘吸霾强等特点,李梅如等[9]通过转化高牛毛草中FaDREB1基因在构树中异位表达,从而提高构树抗逆性的相关转基因研究。这些工作都是以构树为研究对象,目前在杂交构树转基因方面的研究很少,本研究首次选取杂交构树为研究对象进行转基因研究,以充分利用杂交构树这种经济树种,因其在农业饲料、中医药、造纸行业、生态修复及绿化等方面的自身优势,使得本研究更具有研究意义和价值。
目前杂交构树项目作为国家重点扶贫工程,已在国内很多省份开展试验,河南省兰考县作为国家级重点试点地区,已经开展了相关工作,建立了试验区和组培中心。一直以来,杂交构树繁育主要是扦插,而组织培养成活率低,使得效率低下[10-11]。本研究通过优化组织培养中的消毒方法、愈伤期及壮苗期各项激素施加条件,建立组培筛选体系。
杂交构树作为重要经济树种,应用广泛,尤其在生物饲料方面。为了挖掘其遗传转化方面的潜力和价值,以及开展相关工作研究做铺垫,本文进行了相关研究,研究发现杂交构树的粗蛋白含量与水稻(Oryzasativa)、玉米(Zeamays)等谷物相比有一定优势,但含量并不突出。通过文献调研和研究发现,苜蓿的粗蛋白含量在植物中最为突出,而蒺藜苜蓿(Medicagotruncatula)作为其中的模式植物,基因组小,结构简单,并且已经完成测序,加之生长周期短,所以是最佳的外源转化基因的选取材料[12]。在外源转化基因选取上,选取调控蛋白和氨基酸含量的基因天冬氨酸转氨酶(Aspartate Transaminase,AAT)的表达基因作为目的基因,其在高等植物中广泛存在,主要参与调控着植物氮素的代谢。植物对氮素的吸收主要以吸收氨态氮(NH4+或NH3)为主,一部分植物还可以吸收硝态氮(NO3-)。作物种类不同,吸收氨态氮和硝态氮的比例不同。氮的运输形式主要是有机物——氨基酸(主要是天冬氨酸,还有少量丙氨酸、蛋氨酸、缎氨酸)和酰胺(主要是天冬酰胺和谷氨酰胺),还有少量以硝酸形式向上运输[13]。AAT基因有多种同工酶形式,它们在植物的各个组织都有发现[14],通过亚细胞定位在细胞质、线粒体、叶绿体、核糖体和高尔基体中都有存在AAT基因的亚细胞定位,说明不同种的同工酶在植物的新陈代谢中发挥了不同的作用[15]。有研究表明,控制蛋白质和氨基酸含量的QTL与编码天冬氨酸转氨酶的AAT基因有对应的关系[16]。有研究报道超量表达OsAAT1基因的阳性植株的种子中的氨基酸总含量比其对应的阴性植株的含量提高了16.1%,蛋白质含量提高了22.2%;超量表达OsAAT2基因的阳性植株的种子中的氨基酸总含量比其对应的阴性植株的含量提高了12.0%,蛋白质含量提高了21.1%[17]。
本研究克隆目的基因,构建表达载体,通过农杆菌转化方法[18]将目的载体转入杂交构树组培叶片中,优化叶片前期消毒体系、愈伤期激素配比、抑制农杆菌的Cef浓度,以及Hyg对重组植株的筛选浓度。首次建立以杂交构树叶片为研究对象的遗传转化组培及筛选方法,并且对转化蒺藜苜蓿的AAT基因到杂交构树中,从而提高杂交构树的粗蛋白含量的前期转化方法进行了研究,为接下来杂交构树遗传转化深入研究奠定基础。
1 材料与方法
1.1 材料来源
1.1.1 杂交构树来源和培养
杂交构树(科构101),取自兰考中科华构生物科技有限公司。叶片组织培养基:MS基础培养基(100 mL含盐0.442 g、蔗糖3 g、琼脂粉0.8 g,pH 5.8),并与多种植物生长调节剂组合使用。将各培养基分别用1 mol/L KOH或1 mol/L HCl调至pH 5.8,0.8%固体琼脂,121 ℃高压灭菌20 min。光照时间:16 h光照培养,8 h暗培养。培养温度:25 ℃。
1.1.2 遗传转化材料来源
蒺藜苜蓿(R108)材料取自中国农科院;表达载体ps1300,内参基因Actin2取自河南大学植物逆境生物学重点实验室;大肠杆菌DH5α、农杆菌GV3101感受态细胞购自于北京康为世纪生物科技有限公司。
1.2 仪器与设备
PCR仪S1000,美国伯乐;电泳系统MINI-PROTEAN3,美国伯乐;定量PCR仪Lightcycler 480,美国ROCHE;电泳仪JY5000,北京君意;高速离心机PICO 21,美国热电;高速冷冻离心机5804R,德国艾本德;超低温冰箱MDF-U5411,日本三洋;精密天平BP310S-OCE,塞多利斯;精密pH计PHS-3C,上海雷磁;高压高温灭菌器LDZF-75L-II,上海申安;金属加热器HB-031,上海申能;制冰机FM50,北京长流;恒温振荡器HZQ-QX,东联电子技术;生化培养箱HPS-250,东联电子技术;智能恒温振荡器DZP-102,东联电子技术;紫外可见光分光光度计T10,北京普析通用仪器有限责任公司;人工气候培养箱 RXZ-280B,宁波江南仪器厂。
1.3 方法
1.3.1 遗传转化筛选优化方法
(1)生物信息学分析 通过Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)中的在线功能进行生物信息学分析;通过NCBI CDD 数据库(Conserved Domain Databases),进行保守结构域的分析。
(2)AAT基因克隆及重组表达载体构建AAT基因序列查询于Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)。通过ps1300表达载体设计引物两端酶切位点。利用Primer 6.0软件设计具有针对性的引物。引物为Sense(XbaI)GCTCTAGAATGGCCACCAACATG,Antisense(KpnI)GGGGTACCCTAAACAAGTCCAGCTG。 PCR程序:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 25 s,72 ℃ 90 s,35个循环;72 ℃ 8 min;4 ℃保温。提取蒺藜苜蓿叶片总RNA,并反转录cDNA,以cDNA为模板扩增CDS全长序列。用双酶切(XbaI和KpnI)获得目的片段。将回收产物与同样酶切的ps1300质粒在16 ℃相连接,连接产物转化大肠杆菌DH5α的感受态细胞。对过夜培养长出的菌落做菌落PCR,将阳性菌落摇菌并做质粒PCR,双酶切重组质粒进一步验证结果。回收双酶切得到的CDS,测序证实重组载体构建成功。
(3)目的载体转入农杆菌株 采用液氮冻融法[19]将目的载体转入农杆菌GV3101,-80 ℃保存。
(4)农杆菌株侵染液制备 摇菌培养农杆菌涂抹在添加有50 mg/L卡那霉素(Kan)的YEB培养基上,并挑取单菌落接种于5 mL LB液体培养中,28~30 ℃震荡培养。将1 mL过夜培养的农杆菌转接到添加有50 mg/L Kan,20 mg/L过滤灭菌的乙酰丁香酮(AS)的25 mL LB液体培养基中。检测过夜培养的菌液OD600的值。25 ℃,5 000 rpm,15 min集菌,用MS重悬液重悬菌体,使得最终OD600的0.4~0.6。轻柔地加入20 mg/L过滤灭菌的AS混匀,为杂交构树叶片的侵染做准备。
(5)农杆菌侵染杂交构树叶片及共培养 取用壮苗的叶片植株叶片切成0.5 cm×0.5 cm(作为叶片外植体),接种于20 mL含有农杆菌菌悬液,并添加20 mg/L AS的MS培养基中,28 ℃,处理50 min。随后,将叶片外植体贴敷于无菌滤纸上,除去大部分液体培养基,移入添加20 mg/L AS的MS固体(0.8% w/v)培养基共培养。24 h后,用含有Cef的无菌水快速冲洗外植体,抑制农杆菌细胞生长。无菌滤纸吸掉多余水分备用。
(6)Cef对农杆菌的抑制效果 以0.8% MS的固体培养基为基础培养基,加入不同浓度的Cef:0、100、200、300、400 mg/L;共5个水平。将共培养后的植株叶片接入培养基中培养,每个水平10瓶,每瓶4片叶片。光照培养7 d,观察并记录Cef对农杆菌的抑制情况。
(7)Hyg对重组植株的筛选 由于表达载体带有Hyg抗性,所以通过Hyg进行重组筛选。以0.8% MS的固体培养基为基础培养基,添加优化后的激素浓度配比和Cef浓度,再加入不同浓度的Hyg:0、2.5、5、7.5、10、20 mg/L,共6个水平。将共培养后的植株叶片接入培养基中培养,每个水平10瓶,每瓶4片叶片。进行耐Hyg的重组植株的筛选。观察并记录重组植株的生长情况。
(8)通过RT-PCR对杂交构树重组植株进行测定 提取杂交构树重组植株叶片以及未转化的杂交构树叶片的总RNA,并反转录cDNA,以AAT基因为模板,通过Primer 6设计RT-PCR引物:Sense:5′-TATAACCGATCAAGCAACC-3′; Antisense:5′-CATTAATCCCAGCCTGAG-3′。
选取Actin2为内参基因。Sense:′-CCTCCGTCTTGACCTTGC-3′;Antisense:5′-TCCTGGACCTGCCTCATC-3′。PCR 程序为:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 20 s,35个循环;72 ℃ 5 min。实验重复3 次,用以验证杂交构树重组植株。
(9)通过荧光定量PCR对杂交构树重组植株AAT基因表达量进行测定 提取杂交构树重组植株叶片以及未转化的杂交构树叶片的总RNA,并反转录cDNA,以AAT基因为模板,通过Primer 6设计RT-PCR引物:Sense:5′-CTCAAACCATGGCTTACACAAA-3′; Antisense:5′-GACAAGCAAGCAACAGTGAATA-3′。
选取Actin2为内参基因。Sense:5′-CCTCCGTCTTGACCTTGC-3′ ;Antisense:5'-TCCTGGACCTGCCTCATC-3′。PCR 程序为:95 ℃ 30 s; 95 ℃ 5 s,60 ℃ 30 s,40个循环;4 ℃ 终止反应。实验重复3 次,用以验证反应结果。
1.3.2 激素配比及消毒优化方法
(1)杂交构树试验材料消毒 选取生长健康,无病害的杂交构树叶片,预处理(洗洁精泡洗,自来水冲洗30 min,75%乙醇消毒20 s,无菌水冲洗2~3次,滤纸吸干)。然后放入消毒液中消毒,设置灭菌的双蒸水(ddH2O)为空白对照。消毒液分别为: 5% NaClO、0.3% HgCl2、10% H2O2,消毒时间分别为5、10、15 min。而后用无菌ddH2O冲洗5~6次,无菌滤纸吸干,接入0.8% MS固体培养基中培养,每瓶接种4个,每组做10瓶。光照培养室中培养7 d,记录污染率、死亡率、成活率。
(2)愈伤组织及丛苗的诱导和筛选 以0.8% MS的固体培养基为基础培养基,加入不同浓度的6-BA:1、1.5、2、2.5 mg/L;NAA:0.05、0.1、0.15、0.2 mg/L各4个水平。将消毒后的植株叶片切成0.5 cm×0.5 cm接入培养基中培养,每个水平10瓶,每瓶4片叶片。在黑暗中放置25 d,观察并记录愈伤组织及丛苗的生长情况。
(3)壮苗培养基的筛选 以0.8% MS的固体培养基为基础培养基,加入不同浓度的6-BA:1.5、2、2.5 mg/L;NAA:0.1、0.15、0.2 mg/L各3个水平。将消毒后的植株叶片切成0.5 cm×0.5 cm接入培养基中培养,每个水平10瓶,每瓶4片叶片。光照培养30 d,观察并记录壮苗期的生长情况。
2 结果与分析
2.1 AAT基因的生物信息学分析
AAT基因位于蒺藜苜蓿第七条染色体上,表达分析表明,该基因主要在叶片、根节、根中表达,其中根、叶中的表达较为丰富。作为天冬氨酸转氨酶,该基因参与到NH4+代谢通路中,调控蛋白和氨基酸含量[20]。图1-A为蛋白功能域,蛋白序列全长473 aa,黄色区为天冬氨酸转氨酶表达区。图1-B为基因组序列,CDS全长1 422 bp,粉色区域为编码区。图1-C发现本研究克隆的基因编码的蛋白是天冬氨酸转氨酶超家族成员,该基因编码的蛋白具有一个天冬氨酸转氨酶家族保守区(PRK05764)和天冬氨酸转氨酶超家族保守结构域(AAT-I superfamily)。图1-D蒺藜苜蓿中该基因序列与拟南芥(Arabidopsisthaliana)、水稻、衣藻科(Chlamydomonas)相比较,同源率高达85%以上。

图1 AAT的基因及蛋白分析注:A为蛋白功能域,B为基因组序列,C为保守序列预测,D为基因组序列同源对比。Fig.1 Analysis of AAT
2.2 AAT::ps1300重组载体验证
根据特异引物扩增出1 422 bp目的条带,构建出AAT::ps1300重组载体后,通过XbaI,KpnI双酶切,以及提质粒进行质粒PCR验证,并通过测序得到目的基因CDS。证实重组载体构建成功(图2)。

图2 AAT::ps1300重组载体的构建Fig.2 Construction of AAT::ps1300 vector
2.3 不同消毒方法之间的对比
通过不同消毒方法7 d后处理可以看出(表1),消毒效果最理想的是75%乙醇溶液处理20 s后,再用0.3%的HgCl2处理15 min,除菌率可以达到71.5%,植株外植体的成活率可以达到47.3%。

表1 不同消毒方法对杂交构树叶片消毒效果的比较Tab.1 Comparison of disinfection effects of different disinfection methods on leaves of hybrid B.papyrifera
2.4 愈伤组织及丛苗的诱导和筛选
杂交构树叶片在愈伤组织培养基上黑暗诱导培养25 d后,观察不同的浓度激素配比中杂交构树叶片的出芽数和幼苗的生长情况,见表2。

表2 不同激素配比对杂交构树叶片愈伤组织及丛苗的诱导和筛选的比较Tab.2 Comparison of induction and screening of callus and cluster seedlings in leaves of hybrid B.papyrifera with different ratio of hormones
从表2中发现,在愈伤期,细胞分裂激素6-BA起到主导作用。较之NAA浓度增加,随着6-BA的浓度增加,杂交构树叶片愈伤期出芽数增加明显,而当6-BA浓度增加到3 mg/L时,出芽数和长势都明显变差。 从图3中也直观看到优化后植株愈伤长势好于优化前。所以,当6-BA浓度为2.5 mg/L,NAA浓度为0.15 mg/L时,诱导出芽数效果最显著。而当6-BA浓度为2.5 mg/L,NAA浓度为0.2 mg/L时,诱导愈伤率效果最显著。
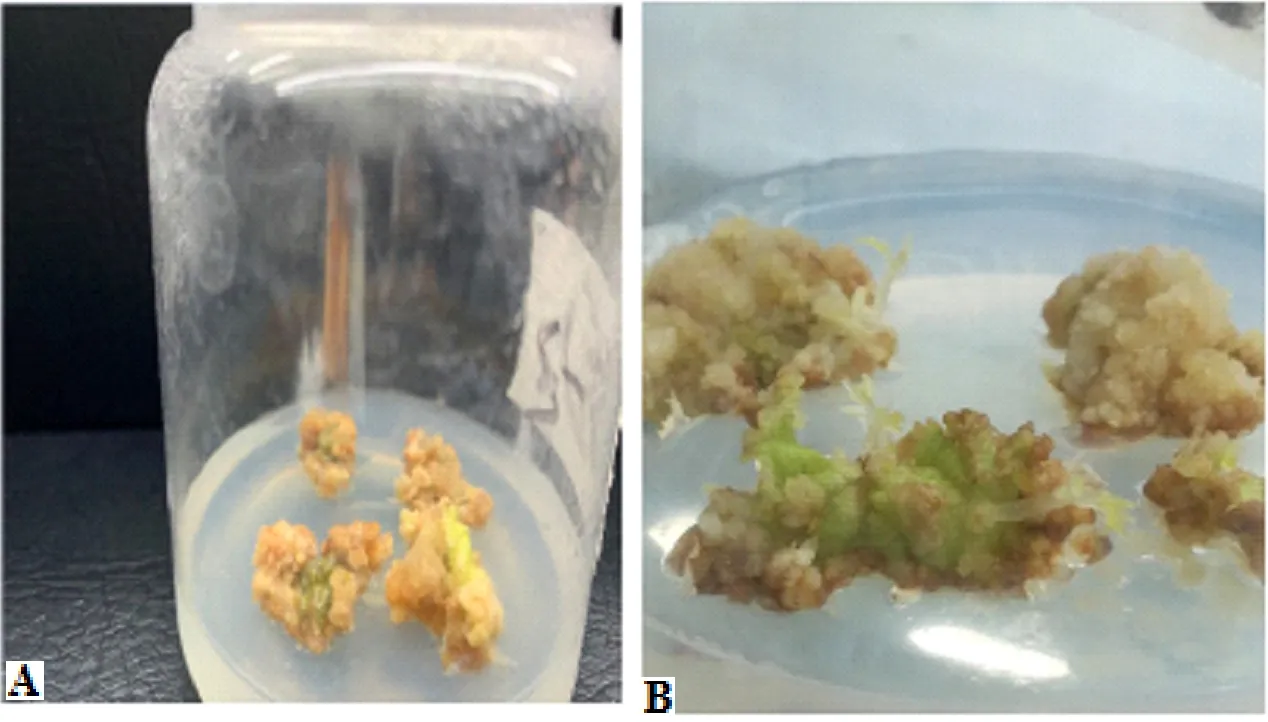
图3 愈伤期植株注:A为优化前,B为优化后。Fig.3 Callus plants
2.5 继代壮苗培养基的筛选
杂交构树丛苗在壮苗培养基上光照培养30 d后,观察不同的浓度激素配比中杂交构树丛苗的生长情况。从表3中发现,随着6-BA的浓度增加,会抑制植株高度增加。 6-BA浓度为1.5 mg/L,NAA浓度为0.2 mg/L时,植株高度达到3.8 cm,从图4也可以看到这个结果,在这个参数下壮苗效果最明显。

表3 不同激素比对杂交构树继代壮苗的比较Tab.3 Comparison of different ratio of hormones on the subculture robusts seedlings of hybrid B.papyrifera

图4 壮苗期植株注:A为优化前,B为优化后。Fig.4 Seedling stage plants
2.6 抗生素Cef对农杆菌的抑制效果对比
杂交构树叶片在共培养后,接入带有不同浓度Cef的培养基中培养7 d后,观察不同浓度的Cef对农杆菌的抑制情况。从图5中可以看出,300 mg/L的Cef可以显著抑制农杆菌的生长。

图5 Cef 对农杆菌的抑制率Fig.5 Inhibition rate of Cef on agrobacterium
2.7 抗生素Hyg对重组植株的筛选效果对比
将共培养后植株叶片接入不同浓度Hyg的培养基中培养,观察不同浓度的Hyg对杂交构树重组植株的筛选情况。从图6中可以看出,Hyg浓度到达10 mg/L以后就完全抑制幼苗生长,而在 7.5 mg/L的Hyg处理下植株成活率在5%左右。从图7中可以直观看到在通过优化Hyg参数后,植株死亡率明显上升,能够有效筛选出重组的植株。

图6 Hyg 筛选重组植株成活率Fig.6 Survival rate of recombinant plants in Hyg screening

图7 Hyg筛选重组植株注:A为优化前,B为优化后。Fig.7 Recombinant plants screened by Hyg
2.8 RT-PCR检测杂交构树重组植株
经过Hyg 对杂交构树重组植株的有效筛选后,通过半定量的方法对筛选出的重组植株进行检测,图8中,重组1和重组2是要检测的杂交构树重组植株,CK是未转化的对照株,Actin2为内参基因。通过检测得出:重组植株里带有AAT基因,空白对照里面没有AAT基因,初步说明外源基因AAT转入到杂交构树植株中。

图8 RT-PCR检测重组植株Fig.8 RT-PCR detection of reconstituted plants
2.9 荧光定量PCR对杂交构树重组植株AAT基因表达量进行检测
通过半定量的方法对筛选出的重组植株进行检测,验证得出外源基因AAT转入到杂交构树植株中。然后本实验通过荧光定量PCR对杂交构树重组植株AAT基因表达量进行了检测。通过实验发现,较之未转化的CK型,重组1型的植株AAT基因表达量有2.5倍的显著提高(图9)。

图9 荧光定量PCR检测重组植株AAT基因表达量Fig.9 Fluorescence quantitative PCR was used to detect the AAT gene expression in the recombinant plant
3 结论与讨论
中科院沈世华团队前期进行了杂交构树的选育后,杂交构树的价值越来越受到重视。杂交构树选育主要通过扦插,而组培效率低下,其中植物生长调节激素是植物外植体培养组织和器官分化的关键因素,调节其种类、浓度及组合将导致再生频率变化[21-22],所以本研究进行了叶片组培的相关优化。
本研究前期优化叶片消毒方法,叶片首先通过75%乙醇溶液处理后,再用0.3%的HgCl2处理15 min,通过优化除菌率可以达到71.5%,植株外植体的成活率可以达到47.3%,比田瑞等[23]报道过的方法有所提高。而通过NaClO 以及H2O2的消毒方法一样表现不明显。在叶片组织培养中愈伤期激素配比优化上,通过不同浓度的搭配发现,6-BA在愈伤期的激素中占主导作用。当6-BA浓度为2.5 mg/L,NAA浓度为0.15 mg/L时,诱导出芽数效果最显著。随着6-BA浓度提高到3 mg/L,愈伤明显受到抑制。施和平等[24]报道了6-BA在3 mg/L以内对黄瓜(Cucumissativus)毛状根生长和形态起到促进生长作用。在壮苗期,6-BA浓度为1.5 mg/L,NAA浓度为0.2 mg/L时,植株高度达到3.8 cm,壮苗效果最明显。
Peng等[25]在构树遗传转化方面进行了研究,Li等[26-27]在构树抗逆方面进行了深入研究,而本文研究了外源基因转化杂交构树的可行性。本研究选取杂交构树(科构101)为转化目的植株,蒺藜苜蓿(R108)为外源基因取材植株,对AAT基因进行相关生物信息学分析。AAT基因位于蒺藜苜蓿第七条染色体上,表达分析表明,该基因主要在叶片、根节、根中表达,其中根、叶中的表达较为丰富。基因组序列与拟南芥、水稻、衣藻科的同源率达到85%以上。通过克隆基因构建了AAT::ps1300重组表达载体,采用Chen等[19]优化的农杆菌转化法,利用农杆菌GV3101转化杂交构树叶片。
本研究在重组植株筛选方面,农杆菌转化叶片共培养后,300 mg/L的Cef可以显著抑制农杆菌的生长。由于表达载体具有抗Hyg的基因,试验中通过不同浓度的Hyg处理,发现超过10 mg/L的Hyg就会导致幼苗死亡。而在7.5 mg/L的Hyg处理下,能够有效控制重组植株的成活率在5%左右,从而提高筛选的效率。在验证重组植株方面,通过RT-PCR验证筛选重组成功的植株,并通过定量PCR发现重组植株比未转化的野生植株AAT基因表达量提高2.5倍。
本研究通过整合并优化早期报道的组培及相关转化方法,首次建立以杂交构树叶片为研究对象的遗传转化组培及筛选方法。并对杂交构树的粗蛋白提高的前期转化方法进行了研究,为接下来杂交构树遗传转化深入研究奠定基础。
