低谷蛋白稻米组分蛋白提取工艺优化
2021-02-18隋晓东吴超越丁春邦
(兰 艳 隋晓东 王 锦 吴超越 丁春邦 李 天
(四川农业大学农学院/作物生理生态及栽培四川省重点实验室1,成都 611130)
(四川农业大学生命科学学院2,雅安 625014)
低谷蛋白水稻是指可吸收蛋白 (清蛋白、球蛋白、谷蛋白之和) 含量低于4%的具有辅助疗效的功能型水稻品种[1]。食用等量的低谷蛋白大米后,人体不会因摄入过量热量而使血糖、血脂升高,能有效预防、辅助治疗糖尿病和肾病[2]。水稻籽粒中含有7%~10%的蛋白质,一般糙米的蛋白质含量约为8%,精米约7%[3, 4]。根据蛋白质的溶解性,可将其分为四类:水溶性的清蛋白、盐溶性的球蛋白、醇溶性的醇溶蛋白和碱溶性的谷蛋白[5]。由此,稻米中组分蛋白的提取通常采用连续提取法,即首先用水提取得到清蛋白,其残渣用稀盐溶液提取得到球蛋白,再用75%乙醇提取得到醇溶蛋白,最后用碱溶液提取得到谷蛋白[6]。然而,稻米中的四种蛋白质含量差异很大,且同一种蛋白质在不同品种中含量也有差异[7, 8]。据报道,普通稻米胚乳中各类蛋白质量分数分别为:清蛋白2%~5%、球蛋白2%~10%、醇溶蛋白1%~5%、谷蛋白75%~90%[5]。而低谷蛋白稻米中各蛋白组分的含量与普通稻米相差甚远[9, 10],普通稻米的提取液浓度是否适用还未知;此外,蛋白的提取率还受温度、料液比、提取时间等因素影响[11]。因此本实验在连续提取法的基础上,筛选最适提取液浓度并利用Design-Expert (RSM) 软件设计实验条件,优化低谷蛋白稻米各组分蛋白的提取时间、料液比、提取温度及提取次数,为低谷蛋白功能稻的综合评价提供参考。
1 材料与方法
1.1 材料与试剂
选取低谷蛋白稻米(D105)为材料,稻谷收获风干并存放三个月,加工成精米粉碎过筛后烘干供测试用。
G250、牛血清蛋白标准品、无水乙醇、氯化钠 (AR)、磷酸 (AR)、氢氧化钠 (AR)。
1.2 仪器与设备
YB-750A粉碎机,THZ-82A恒温水浴振荡摇床,Thermo离心机,Analytik Jena Specord 200 Plus双光束紫外分光光度仪,BT-124S型电子天平。
1.3 实验方法
1.3.1 提取剂浓度筛选实验
以各组分蛋白含量为指标,考察提取剂浓度:球蛋白提取剂氯化钠溶液(0.5、0.6、0.7、0.8、0.9、1.0 mol/L)、醇溶蛋白提取剂乙醇体积分数为(70%、75%、80%、85%、90%)、谷蛋白提取剂氢氧化钠溶液(0.02、0.04、0.06、0.08、0.09、0.1 mol/L) 对各组分蛋白含量的影响,并固定温度35℃,时间30 min,提取3次。
1.3.2 组分蛋白含量测定
稻米中组分蛋白提取量的测定采用G250显色法,取待测液1 mL,加4 mL G250试剂,摇匀,静置5 min,于595 nm检测吸光值。以牛血清蛋白标准液浓度为x轴、吸光度为y轴,绘制标准曲线。按公式计算各组分蛋白含量:
蛋白含量=
1.3.3 稻米中各组分蛋白的提取
采取连续提取法对稻米组分蛋白进行提取,具体步骤为:准确称取精米粉0.300 0 g,按设定料液比例加入超纯水,恒温水浴摇床(190 r/min)振荡浸提后6 000转离心10 min,收集多次提取的上清液合并定容,为清蛋白的待测液;对提取过清蛋白的样品中再加入氯化钠溶液,重复上述提取步骤,为球蛋白提取液;依次对提取过球蛋白的样品加入乙醇溶液,提取醇溶蛋白,对提取过醇溶蛋白的样品中加入氢氧化钠溶液提取谷蛋白;并按1.3.2 方法测定并计算稻米中各组分蛋白的含量。
1.3.4 单因素实验
以各组分蛋白含量为指标,分别考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30,固定温度35 ℃,时间40 min,提取3次)、提取温度(25、30、35、40、45 ℃,固定料液比1∶20,时间40 min,提取3次)、提取时间(20、40、60、80、100 min,固定料液比1∶20,温度35 ℃,提取3次)、提取次数(2、3、4、5、6,固定料液比1∶20,温度35 ℃,时间40 min)、4个因素对各组分蛋白含量的影响。
1.3.5 响应面优化实验方法
在单因素实验结果的基础上,采用Design-Expert 11 (RSM)软件设计实验条件,选用Box-Behnken (BB) 模型,以各组分蛋白含量为响应值,料液比(A)、提取温度(B)、提取时间(C)、提取次数(D) 为自变量,设计4因素3水平响应面实验 (表1)。
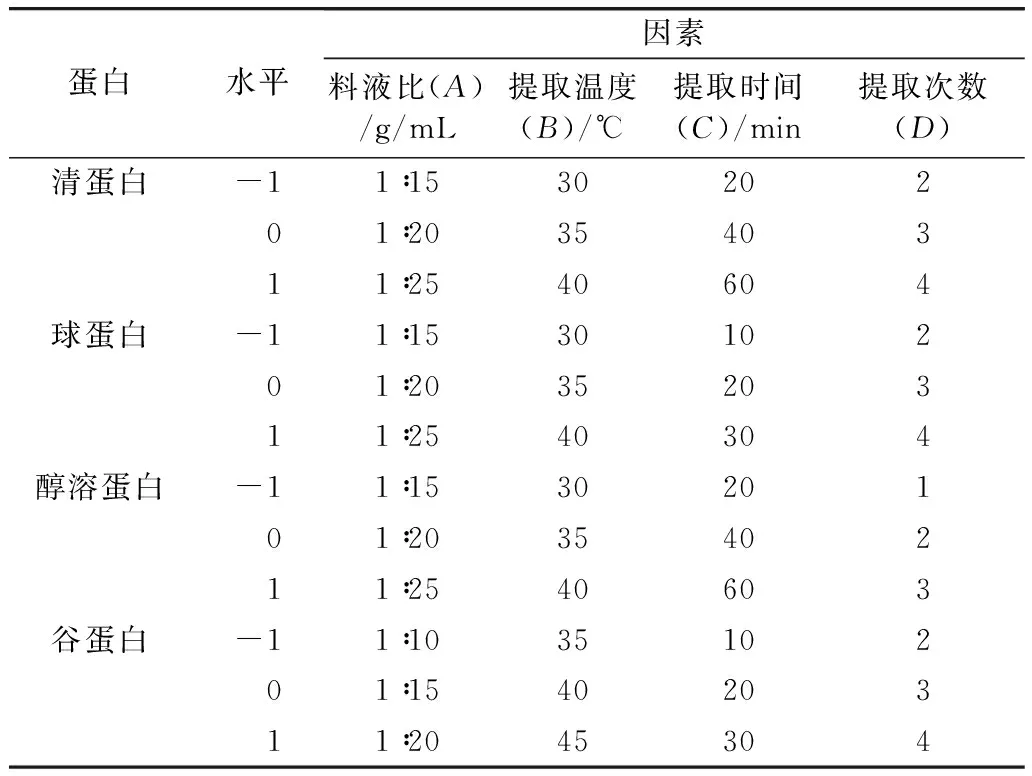
表1 因素水平编码表
1.4 数据处理
采用Microsoft Excel 2010、SPSS 17.0、Design expert 11、SAS 9.4对实验数据进行统计分析处理。所有实验均重复3次。
2 结果和分析
2.1 提取剂浓度筛选
2.1.1 氯化钠浓度对球蛋白含量的影响
由图1可知,球蛋白含量随着氯化钠溶液浓度的增大呈先增后降的变化,当氯化钠浓度为0.6 mol/L时,含量达到6.29 mg/g。这可能是较高浓度的盐离子造蛋白质的部分沉淀,降低了球蛋白的提取量。因此,选择氯化钠浓度为0.6 mol/L。
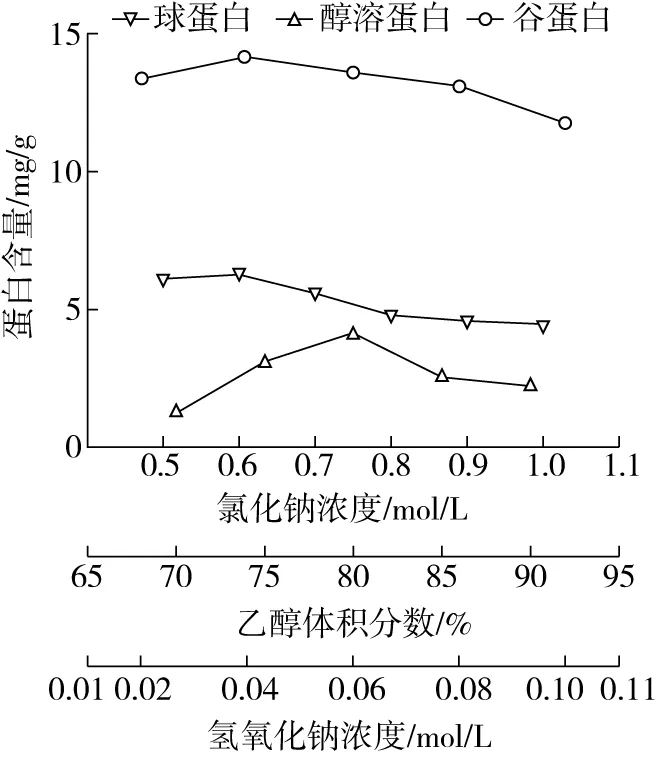
图1 不同提取剂浓度对各组分蛋白含量的影响
2.1.2 乙醇浓度对醇溶蛋白含量的影响
由图1可知,醇溶蛋白含量随着乙醇浓度的增大呈先增后降的变化趋势,当乙醇体积分数为 80% 时,含量达到4.13 mg/g。这可能是较高乙醇浓度造成蛋白质的结构的破坏,造成部分沉淀,从而降低了醇溶蛋白的提取量。因此,选择乙醇体积分数为80%。
2.1.3 氢氧化钠浓度对谷蛋白含量的影响
由图1可知,谷蛋白含量随着氢氧化钠浓度的增大呈先增后降的变化趋势,当氢氧化钠浓度为 0.04 mol/L 时,含量达到14.15 mg/g。这可能是氢氧化钠会与蛋白质发生一定反应,在较高浓度下会降低蛋白质的溶解性,从而降低了谷蛋白的提取量。因此,选择氢氧化钠浓度为0.04 mol/L。
2.2 单因素试验结果
2.2.1 料液比对各组分蛋白含量的影响
由图2可知,随着料液比的增加,四种组分蛋白提取量增加,清蛋白、球蛋白、醇溶蛋白、谷蛋白分别在料液比为1∶20,1∶20,1∶25,1∶15达到最大值,分别为5.59,15.27,4.19,20.26 mg/g。当提取料液比超过最大提取值的料液比时,四种组分蛋白提取量逐渐降低;说明此时,稻米四种蛋白已基本溶出,料液比继续增加,可溶性杂质增多,降低蛋白对溶剂的亲和力,降低提取量[12]。因此,响应面分析时清蛋白和球蛋白选择料液比:1∶15、1∶20、1∶25;醇溶蛋白料液比:1∶20、1∶25、1∶30;谷蛋白料液比:1∶10、1∶15、1∶20。
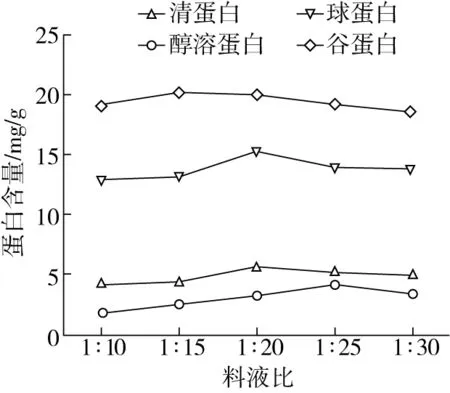
图2 料液比对各组分蛋白含量的影响
2.2.2 提取温度对各组分蛋白含量的影响
由图3可知,当温度为25~40 ℃时,四种组分蛋白提取量增加,清蛋白、球蛋白、醇溶蛋白都在35 ℃达到最大值,分别为4.59、10.29、2.49 mg/g,谷蛋白在40 ℃达到最大值为19.68 mg/g。当提取继续增加,四种组分蛋白提取量逐渐降低。这可能是由于实验中一定的温度 (35、40 ℃)可以加快分子间的运动,提高蛋白溶解量,但超过一定温度 (35、40 ℃)时,可能会影响蛋白的结构,使蛋白从溶液中析出,降低提取量[13]。因此,响应面分析时选择清蛋白、球蛋白、醇溶蛋白提取温度为:30、35、40 ℃;谷蛋白提取温度为:35、40、45 ℃。
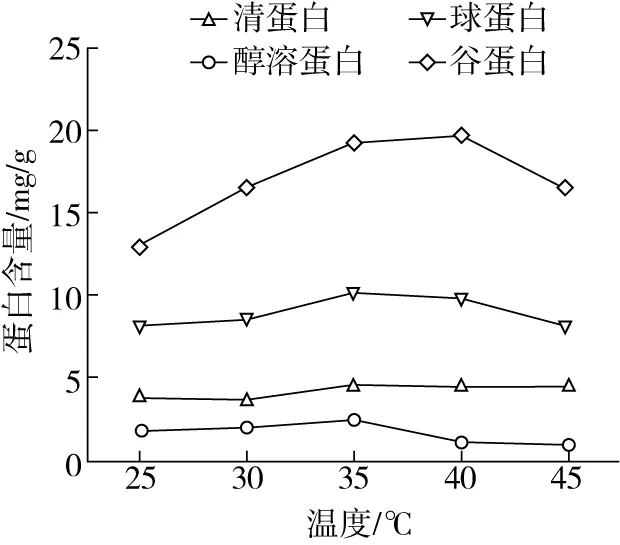
图3 温度对各组分蛋白含量的影响
2.2.3 提取时间对各组分蛋白含量的影响
由图4可知,清蛋白和醇溶蛋白提取量随提取时间的延长先增加后降低,在40 min达到最大值,分别为4.49、2.49 mg/g。谷蛋白和球蛋白的提取量则随提取时间延长下降,在提取时间为20 min时达到最大值分别为20.44、9.26 mg/g。当清蛋白和醇溶蛋白提取时间超过40 min;谷蛋白和球蛋白超过20 min时,四种组分蛋白提取量逐渐降低。这可能在40、20 min时稻米四种蛋白已基本溶出,提取时间继续增加,蛋白质发生部分的沉淀,降低提取量[12]。因此,响应面分析时选择清蛋白和醇溶蛋白提时间为:20、40、60 min;球蛋白提取时间为:10、20、30 min;谷蛋白提取时间为:10、20、30 min。

图4 提取时间对各组分蛋白含量的影响
2.2.4 提取次数对各组分蛋白含量的影响
由图5可知,清蛋白、球蛋白和谷蛋白提取量随提取次数增加先升后降,在提取次数为3次时达到最大值,分别为 4.59、10.29、21.79 mg/g。醇溶蛋白提取量则随提取次数增加而降低,当提取次数为 2次时含量达到最大值为1.70 mg/g。当清蛋白、球蛋白和谷蛋白提取超过3 次,醇溶蛋白提取超过2次时,四种组分蛋白提取量逐渐降低;此时稻米四种蛋白已基本溶出,随着提取次数继续增加,其他物质溶出量增加,使得最终样品液中的蛋白发生部分的析出,降低提取量[12]。因此,响应面分析时选择清蛋白、球蛋白、谷蛋白提取次数为:2、3、4;醇溶蛋白提取次数为:1、2、3。
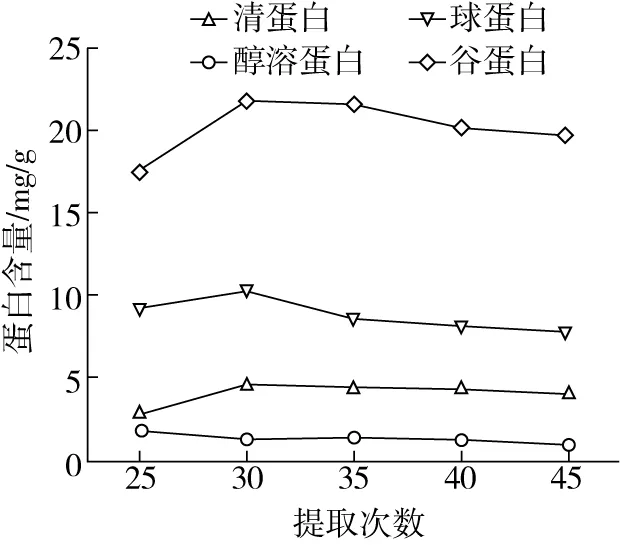
图5 提取次数对各组分蛋白含量的影响
2.3 响应面实验结果及分析
2.3.1 响应面实验设计及结果
基于单因素实验结果拟确定的最佳条件,以稻米中各蛋白组分对应的提取条件:料液比(A)、提取温度(B)、提取时间(C)和提取次数(D) 为自变量,以为响应值 (组分蛋白的含量)为因变量,设计4因素3水平响应面实验,结果见表2。
对表2中的结果进行多元线性回归拟合,得到稻米中各蛋白组分含量对其相应提取的料液比(A)、提取温度(B)、提取时间(C)、提取次数(D) 的二次多项回归方程模型结果如下:
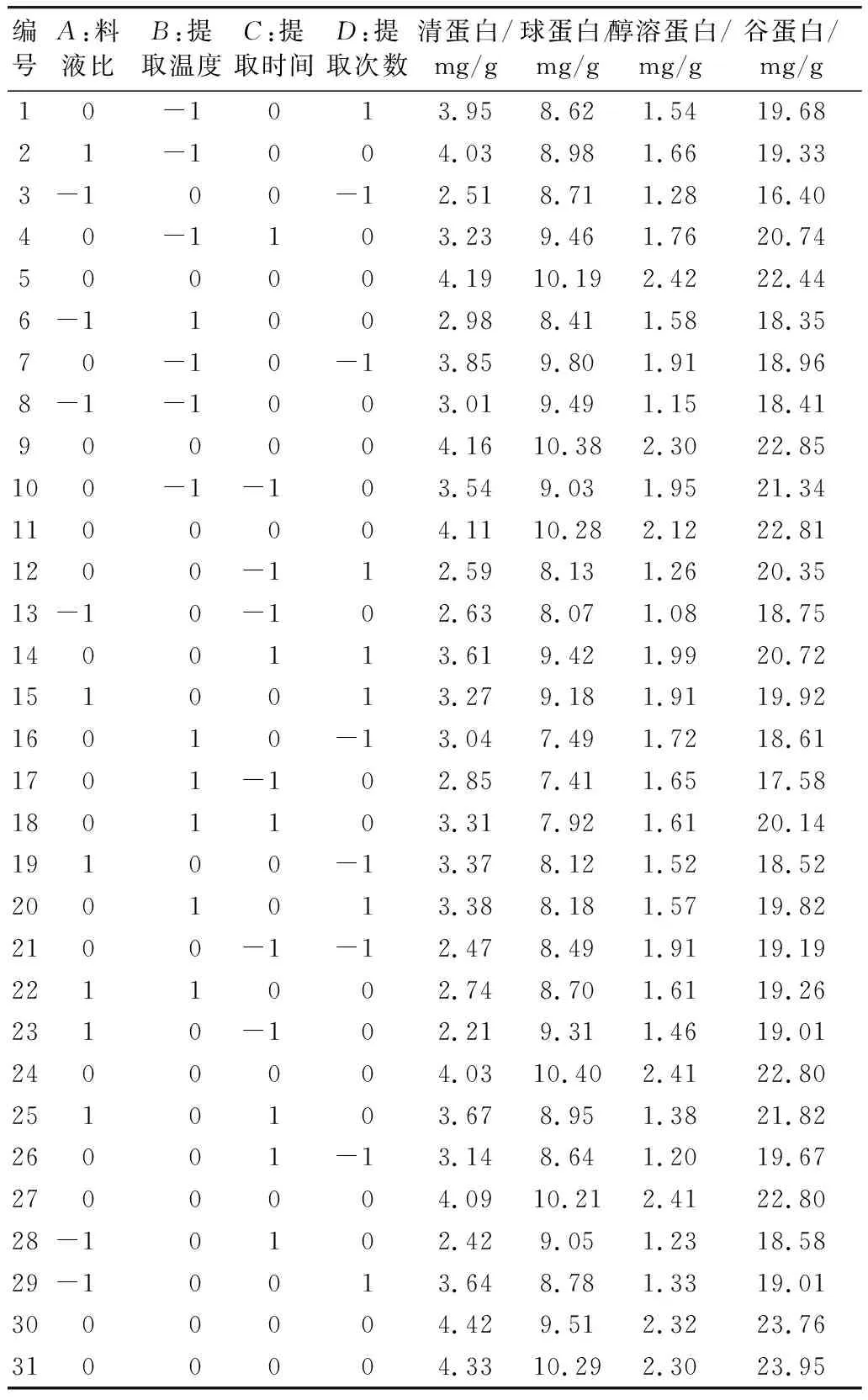
表2 响应面分析方案
清蛋白:Y=1.581 3A+0.781 5B+0.005 5C+3.119 2D-0.012 6AB+0.004 1AC-0.061 5AD+0.001 9BC+0.012 0BD+0.004 4CD-0.027 2A2-0.001 0B2-0.002 0C2-0.385 4D2-29.990 4
球蛋白:Y=0.060 8A-0.605 8B+0.249 2C+0.089 2D+0.200 0AB-0.335 0AC+0.247 5AD+0.020 0BC+0.407 5BD+0.282 5CD-0.552 5A2-0.835 0B2-0.785 0C2-0.825 0D2+10.18
醇溶蛋白:Y=0.1575-0.019 2B-0.011 7C+0.005D-0.120 0AB-050 75AC+0.085 0AD+0.037 5BC+0.055BD+360 0CD-0.566 6A2-0.251 6B2-0.405 4C2-0.322 9D2+2.33
谷蛋白:Y=0.696 7A-0.391 7B+0.454 2C+0.679 2D-0.002 5AB+0.745 0AC-0.302 5AD+0.790 0BC+0.122 5BD-0.027 5CD-2.47A2-0.186B2-1.15C2-2.03D2+23.10
2.3.2 回归模型的方差分析与显著性检验
利用Design-Expert 11软件对回归模型进行方差分析 (analysis of variance,ANOVA),确定各因素对稻米组分蛋白提取的影响程度,同时也检验回归方程的失拟项。从表3~表6可知,经RSM四种组分蛋白获得的模型极显著(P<0.01),失拟项P值为0.103 8(清蛋白)、0.344 1(球蛋白)、0.123 4(醇溶蛋白)、0.271 8(谷蛋白),P值均不显著(P>0.05);相关系数R2=0.896 9(清蛋白)、0.837 4(球蛋白)、0.856 9(醇溶蛋白)、0.900 0(谷蛋白),说明该模型拟合度较好。表明建立的数学模型成功拟合实验数据,在一定范围内对稻米中各组分蛋白提取量具有较好的预测性。
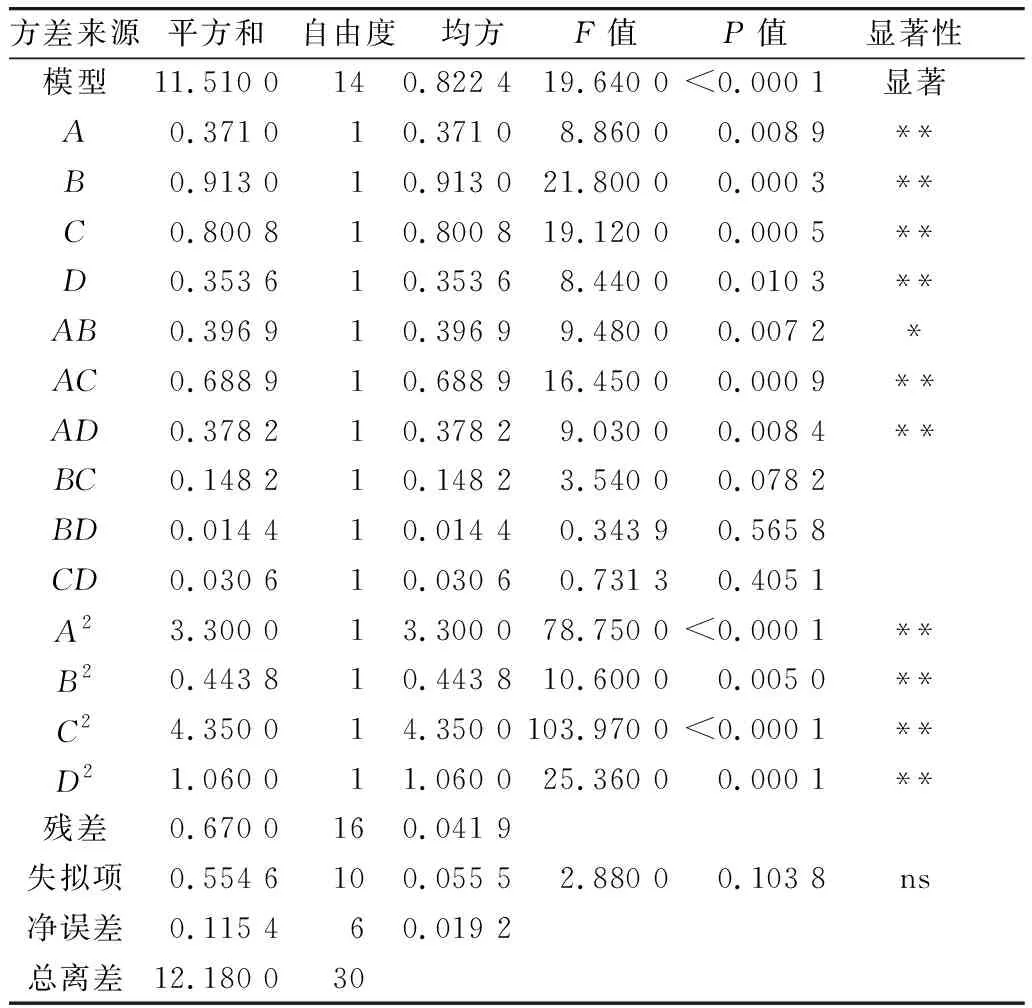
表3 清蛋白响应面回归模型方差分析
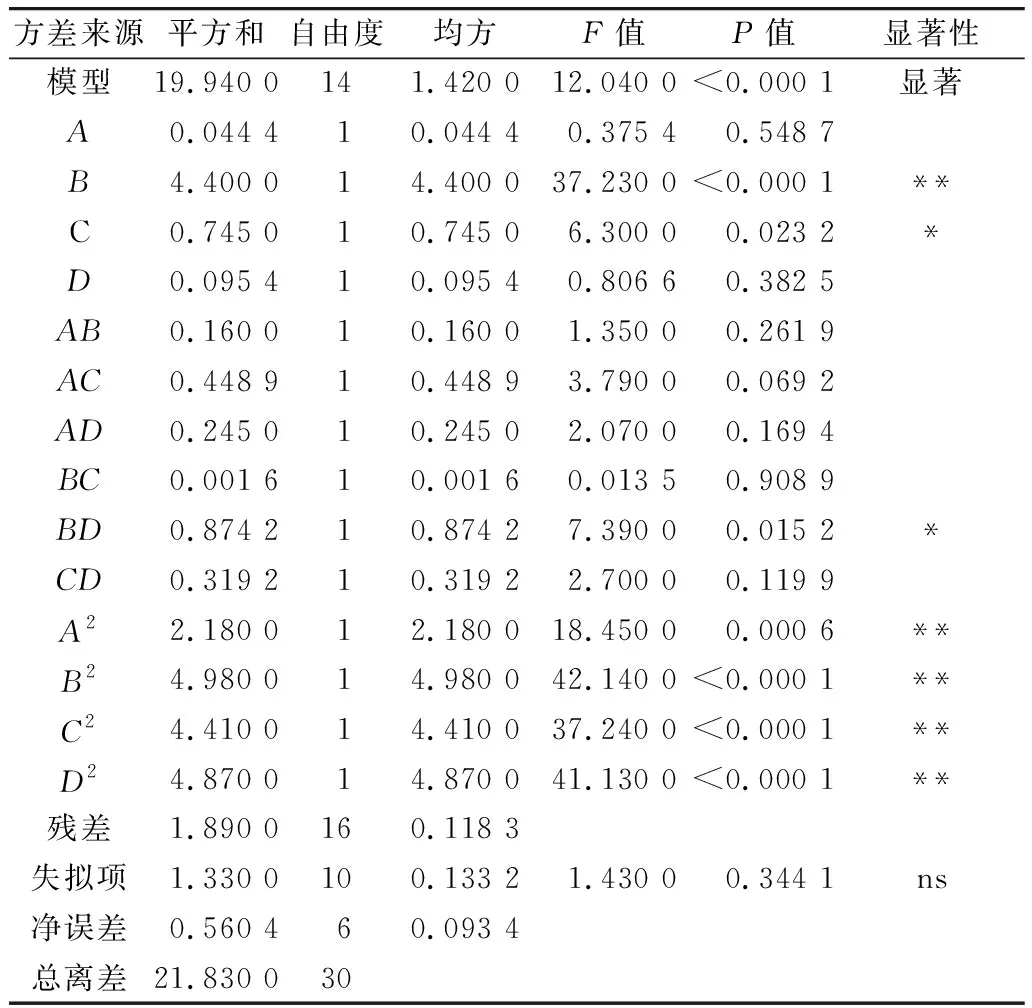
表4 球蛋白响应面回归模型方差分析
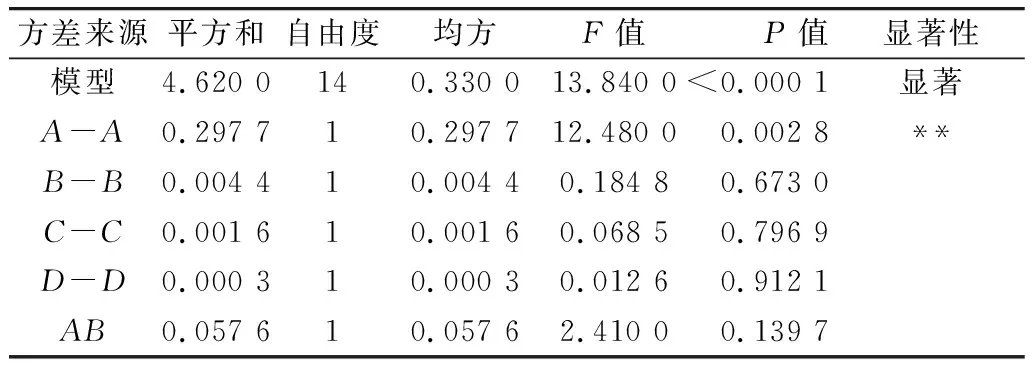
表5 醇溶蛋白响应面回归模型方差分析
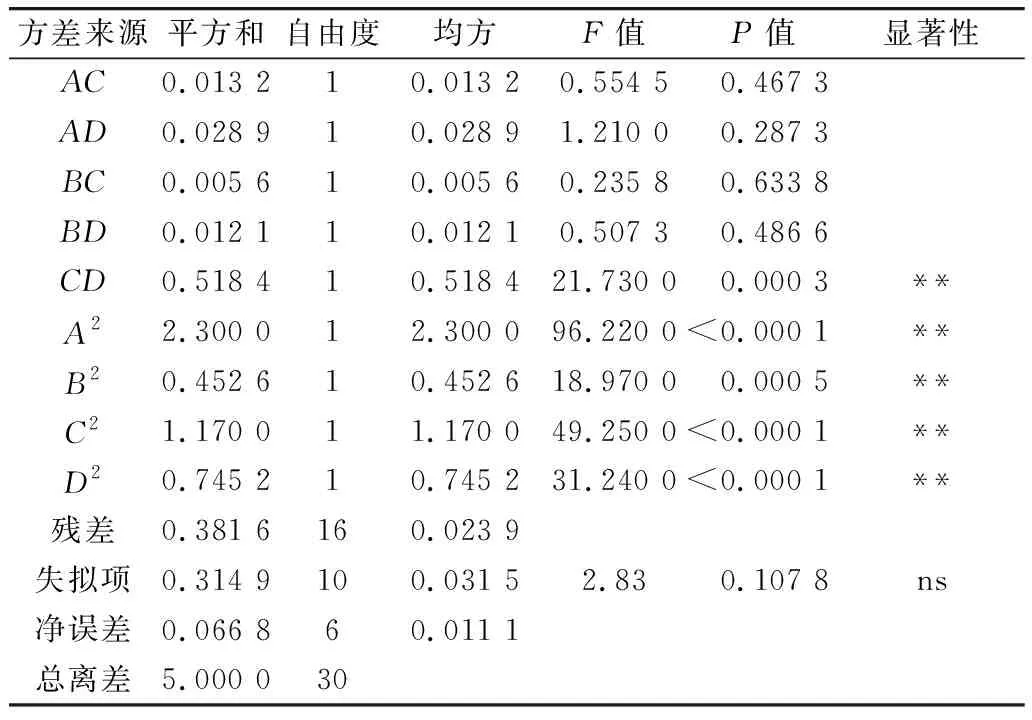
续表5
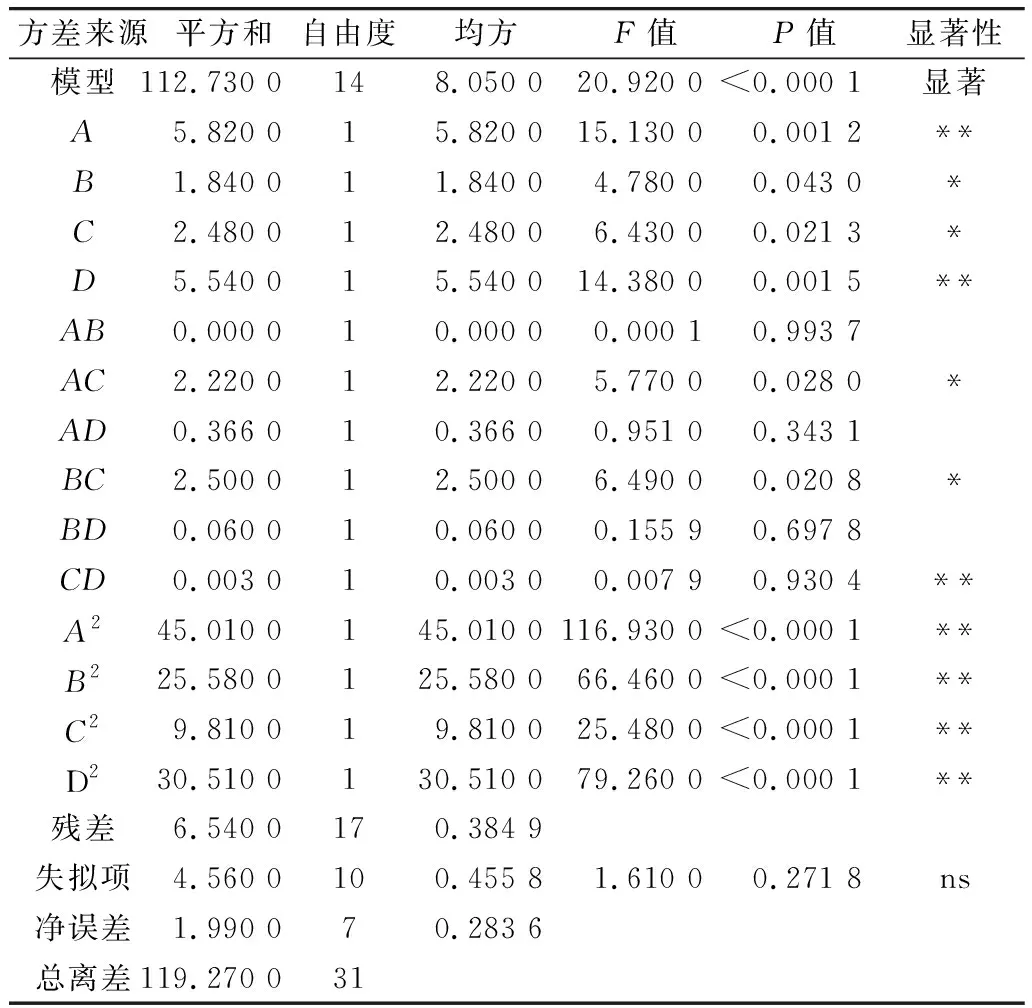
表6 谷蛋白响应面回归模型方差分析
各因素对稻米各组分蛋白含量显著性分析可以看出,清蛋白:A、AC、B、C、D、AD、A2、B2、C2、D2的P值小于0.01,AB的P值小于0.05,且根据F值的大小,可以得出四个因素对清蛋白提取量的影响大小为C>A>B>D;球蛋白:B、A2、B2、C2、D2的P值小于0.01,C、BD的P值小于0.05,且根据F值的大小可以得出四个因素对球蛋白的提取量的影响大小为B>C>D>A,且D、A对球蛋白的提取的影响未达到显著水平,表明D、A对球蛋白的提取影响较B、C小;醇溶蛋白:A、CD、A2、B2、C2、D2的P值小于0.01,且根据F值的大小可以得出四个因素对球蛋白的提取量的影响大小为A>B>C>D,且D、B、C对醇溶蛋白的提取的影响未达到显著水平,表明D、B、C对醇溶蛋白的提取影响较A小;谷蛋白:A、D、A2、B2、C2、D2的P值小于0.01,AC、BC、B、C的P值小于0.05,且根据F值的大小可以得出四个因素对谷蛋白的提取量的影响大小为A>D>C>B。各模型的显著性分析也表明各因素对提取的组分蛋白含量的影响并不是一般的线性关系。
2.3.3 响应面分析
根据实验结果,利用Design-Expert 11软件作图,得到四种组分蛋白在不同提取条件下四个因素交互作用的响应面,可直观反映各因素的交互作用。响应曲面越平缓反应响应值对于因素的改变越不敏感,反之,响应面越陡峭,响应值对于因素的改变越敏感。清蛋白:料液比和提取温度、提取次数、提取时间的交互曲面陡峭,交互作用显著,提取温度与提取时间,提取次数,交互面平缓,交互作用不显著,提取时间和提取次数交互面也平缓,交互作用不显著,与方差分析结果一致。球蛋白:提取温度和提取次数的,交互曲面陡峭,交互作用显著,其余各因素间的交互曲面平缓,交互作用不显著。与方差分析结果一致。醇溶蛋白:提取时间和提取次数的交互曲面陡峭,交互作用显著,其余各项的交互曲面平缓,交互作用不显著,与方差分析结果一致。谷蛋白:料液比与提取时间、提取温度与提取时间、提取时间与提取次数的交互曲面陡峭,交互作用显著,其余各项的交互曲面平缓,交互作用不显著,与方差分析结果一致。随着各因素值的增大,响应值逐渐增大,但当响应值达到最大值之后,随着各因素值的继续增高,响应值则逐渐降低。
2.3.4 验证实验
根据实验所建立的模型,得到各组分蛋白的提取最佳条件分别为,清蛋白∶料液比1∶21.64,提取温度 31.57 ℃,提取时间 43.42 min,提取次数 3.06次;球蛋白:料液比1∶19.65,提取温度 33.1 ℃,提取时间 21.6 min,提取次数2.97次;醇溶蛋白∶料液比1∶20.75,提取温度 34.63 ℃,提取时间39.6 min,提取次数 2.01次;谷蛋白:料液比1∶15.83,提取温度 34.7 ℃,提取时间 22.35 min,提取次数 3.15次。在此条件下各组分蛋白的预测提取质量分数分别为4.34、10.31 、2.34 、23.27 mg/g。
考虑到实验操作的可行性,将优化的提取条件修改为:清蛋白∶料液比1∶22、提取温度31.6 ℃、提取时间43 min,提取次数 3次;球蛋白∶料液比1∶20、提取温度33.1 ℃、提取时间22 min,提取次数3次;醇溶蛋白∶料液比1∶21、提取温度34.6 ℃、提取时间40 min,提取次数 2次;谷蛋白∶料液比1∶16、提取温度34.7 ℃、提取时间22 min,提取次数 3次。在此条件下进行3 次重复实验,稻米各组分蛋白的平均提取量分别为,清蛋白:4.26 mg/g,球蛋白:9.76mg/g,醇溶蛋白:2.27 mg/g,谷蛋白:23.60 mg/g,与预测值的相对误差为 0.018 7(清蛋白),0.056 3(球蛋白),0.030 8(醇溶蛋白),0.014(谷蛋白),表明响应面法优化所得提取条件较好,具有应用价值。
3 结论
提取剂浓度筛选结果表明,稻米球蛋白、醇溶蛋白、谷蛋白随着提取剂浓度的增加呈先增后降的趋势;球蛋白提取最适提取氯化钠溶液浓度为0.6 mol/L、醇溶蛋白最适乙醇体积分数为80%、谷蛋白的最适提取浓度为0.04 mol/L。
单因素实验结果表明,4种组分蛋白的提取量均随着料液比的增加呈现先升高后降低的趋势;清蛋白的提取量随着温度的升高呈现先升高后平缓下降的趋势,而其余3种蛋白的提取量均呈现先升高后降低的趋势;球蛋白和谷蛋白的提取量随着时间的增加呈现平缓下降的趋势,而醇溶蛋白和清蛋白则呈现先升高后平缓降低的趋势;醇溶蛋白的提取量随着提取次数的增加呈现平缓下降的趋势,其余3种蛋白的提取量均呈现先升高后降低的趋势。
通过Design-Expert 11软件和Box-Behnken(BB)实验设计进行响应面优化,得到清蛋白最佳提取工艺:料液比1∶22、提取温度31.6 ℃、提取时间43 min,提取次数3次,球蛋白∶料液比1∶20、提取温度33.1 ℃、提取时间22 min,提取次数 3次,醇溶蛋白∶料液比1∶21、提取温度34.6 ℃、提取时间40 min,提取次数 2次,谷蛋白∶料液比1∶16、提取温度34.7 ℃、提取时间22 min,提取次数 3次。结果表明,相比普通稻米提取,该方法不仅提取率高,还节约了提取成本和提取时间。
