两株无花果活性内生细菌的分离鉴定及生物学特征研究
2021-02-16姜梦珂李孟霜李中源曾忠秀杨林美李淑英
姜梦珂,李孟霜,李中源,曾忠秀,杨林美,杜 欣,李淑英
(玉溪师范学院 化学生物与环境学院,云南 玉溪 653100)
无花果药食兼用,具有较高的药用、营养及经济价值,且无花果适应性强,种植简单,采收期长,产值较高,是一种高效益的特色种植果林品种[1],果实及其叶具有显著的抗癌与抗肿瘤、增强免疫力、抗氧化、抑菌作用[2-3]。无花果的这些营养价值与药用功效一定程度上与其器官中的内生菌有关[4-5]。植物内生菌与高等植物在长时间的协同进化中,与植物体内物质或根际分泌物等相互作用,可以提高宿主植物次生代谢产物生产能力等[6],无花果根、茎、叶及果实中含有丰富的内生菌,包括具有发酵性能酵母菌和具有抑菌性能的细菌、真菌[7],刘瑞[8]等人从无花果叶内筛到5株内生真菌并进行了分类鉴定和抑菌活性测定,陈正培[9]等人从百香果果浆分离到的3株内生细菌研究认为其生长最适pH值均为5.5,分析认为与内生细菌的存在环境有关。本文选择无花果作为实验材料,从其果实内分离筛选出两株活性内生细菌,通过形态特征观察及分子生物学方法鉴定,确定其分类地位,并对它们的耐碱性、耐盐性及产淀粉酶能力等生物学特征进行了研究,为两株无花果活性内生细菌的进一步利用奠定基础。
1 材料与培养基
1.1 材料
无花果(FicuscaricaLinn.):超市购买;菌株:金黄色葡萄球菌(Staphylococcusaureus),湖北保藏中心购买;大肠杆菌(Escherichiacoli)及变形杆菌(P.vulgaris),本校微生物实验室保存。
1.2 培养基
LB培养基:胰蛋白胨10g,酵母提取物5g,NaCl10g,琼脂粉15g,蒸馏水1000ml。
淀粉培养基:牛肉膏5g,蛋白胨10g,可溶淀粉20g,琼脂粉20g,NaCl5g,蒸馏水1000ml。
2 方案设计
2.1 无花果内生细菌分离及纯化
新鲜无花果经无菌水冲洗后用75%乙醇浸泡2min,无菌水冲洗3次,再用3% NaClO溶液浸泡3min,无菌水冲洗3次。无菌刀切为小块后转入研钵加100ml无菌水与灭菌石英砂充分研磨。取0.5ml菌液加入有4.5ml无菌水的试管中,吹打均匀制成稀释梯度为10-1菌悬液,同样方法稀释至10-3,静置15min,取10-1、-10-3菌悬液各0.5ml上清液涂布LB平板,每个稀释梯度接种3个LB平板,35℃恒温培养24~48h,挑选生长良好单菌落纯化2~3次保存于4℃冰箱备用。把最后一遍漂洗无花果的无菌水涂布于LB培养基上,做漂洗液检验法对照,35℃培养24~48h。
2.2 无花果活性内生细菌筛选
采用平板对峙法将金黄色葡萄球菌、大肠杆菌及变形杆菌及分离纯化得到的无花果内生细菌在LB固体培养基平板上划线,35℃下恒温培养48h后观察平板是否有抑菌带产生,筛选出活性内生细菌。
3 无花果活性内生细菌分子生物学鉴定
3.1 活性内生细菌细胞DAN提取
采用改良的CTAB法[10-11]提取DNA,经电泳检测后进行PCR扩增。
3.2 PCR扩增
采用30μl体系:提取所得DNA1μl、前引物和后引物各1μl(细菌通用引物:前引物27F:5'-AGAGTTTGATCMTGGCTCAG-3'和后引物1525R:5'-TCCTCCGCTTATTGATATGC-3')、Taq酶5.5μl(Ex Taq 0,1μl、10x Ex Taq Buffer 3μl、dNTP mixture 2.4μl);
扩增程序为:①94℃预变性4min;②94℃变性30s;③57℃退火30s;④72℃延伸1min;⑤72℃延伸10min,步骤②-④循环33次。
3.3 碱基序列测序
PCR扩增产物经琼脂糖凝胶电泳检测后送至上海捷瑞生物工程有限公司进行碱基测序,将测序得到的16S rRNA基因序列在NCBI数据库进行BLAST比对,与数据库中的已知序列进行同源性分析,选取下载同源性最高的几条序列,用MECA-X10.2.5软件构建系统发育树。
4 活性内生细菌生物学特征研究
4.1 革兰氏染色及芽孢染色
简单染色及芽孢染色参照[12]进行:培养至24h进行简单染色;培养至16h开始进行芽孢染色[13],染色间隔时间为2h,最初出现芽孢的时间即为活性内生细菌开始产芽孢的时间。
4.2 活性内生细菌生长最适pH及耐碱性实验
用5ml无菌水洗脱活性内生细菌斜面,重复3次合并于同一无菌试管中制成菌悬液。
4.2.1活性内生细菌生长最适pH
取1ml菌悬液接种到不同pH(5、6、7、8)LB液体培养基中,3个平行/菌/pH,35℃、120r/min恒温振荡培养24h,于可见光分光光度计600nm测定OD。
4.2.2 活性内生细菌耐碱性
取1ml接种于pH为8、9、10、11的LB液体培养基中,3个平行/菌/pH,35℃、120r/min)恒温振荡培养24h,于可见光分光光度计600nm测定OD。
4.3 活性内生细菌耐盐性实验
将活性内生细菌分别接种到含NaCl为0、5%、10%、15%、20%的LB液体培养基中,35℃、120r/min恒温震荡培养24h后600nm测定OD。
4.4 活性内生细菌解淀粉能力
采用点种[14]方法将活性内生细菌接种于淀粉琼脂筛选培养基平板上,点种3次/平板,35℃倒置培养24h,滴加适量卢戈式碘液于平板,观察菌苔周围是否出现水解圈,并测量水解圈大小。
5 结果与分析
5.1 无花果活性内生细菌筛选结果及形态学特征
根据菌落形态、颜色、湿润度等特征从无花果果实中分离得到19株内生细菌,经金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)和变形杆菌(P.vulgaris)筛选后得到2株活性内生细菌,编号为3251、3252,通过革兰氏染色两株细菌为革兰氏阳性菌、杆状,芽孢染色有芽孢生成,3251芽孢生成时间为25h,3252芽孢生成时间为26h,两株细菌初始芽孢形成时间有一定差异,研究[13]发现1株简单芽孢杆菌芽孢形成时间为16h(六氯苯胁迫宽叶香蒲根际分离得到),1株枯草芽孢杆菌芽孢形成时间为46h,张戈等[15]指出不同的微生物形成芽孢的机制并不相同,对特定的微生物而言,需要探索其合适的条件控制其芽孢的形成。研究认为[16-17]营养缺乏、高浓度矿物元素、pH、温度、水分、高细胞密度和辐射等多种因素都可引发营养体细胞的分化并形成芽孢。
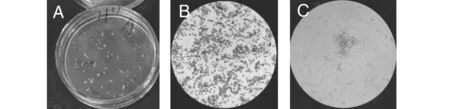
注:A-3251菌落形态,B-3251简单染色,C-3251芽孢染色(总放大倍数:1600)。图1 无花果内生细菌3251菌落及形态特征
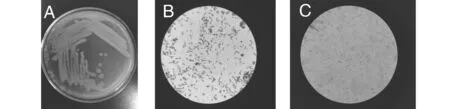
注:A-3252菌落形态,B-3252简单染色,C-3252芽孢染色(总放大倍数:1600)。图2 无花果内生细菌3252菌落及形态特征
5.2 两株活性内生细菌(3251、3252)菌株16S rDNA鉴定
图3看出3251、3252两株活性内生细菌DNA分子量大小为1500bp,将扩增产物进行基因组测序,将测序结果于NCBI中进行BLAST比对,比对结果如表1,并通过MEGA软件构建3251、3252亲系统发育进化树(图4),亲缘关系进化树所示,两株活性内生细菌均属于芽孢杆菌属(Bacillussp.),根据两株芽孢杆菌生理生化特征分别命名为BacillusWHG3251、BacillusstrainBF3252。
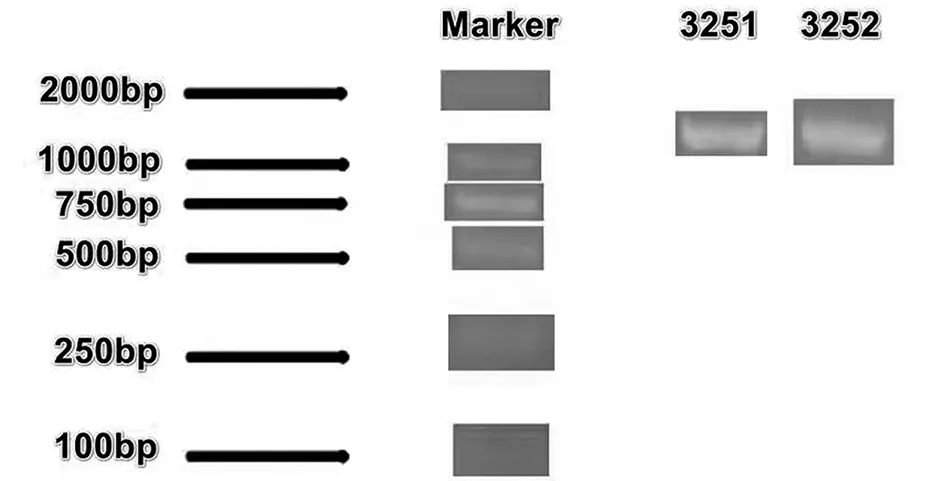
图3 活性内生细菌电泳结果

表1 16SrDNA同源性比对结果表
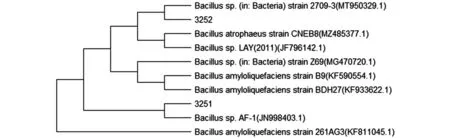
图4 3251、3252系统发育进化树
5.3 两株活性内生细菌生物学特征
5.3.1 pH对两株活性内生细菌生长的影响
图5结果发现BacillusWHG3251和BacillusstrainBF3252生长最适pH为7.0,较多细菌生长的最适pH为6.0~8.0,本实验从无花果中分离到的两株活性内生细菌生长最适pH在此范围内;通过图6耐碱性测定结果发现无花果两株活性内生细菌耐碱性有较大差异,BacillusWHG3251在LB培养基pH=11时生长状态明显好于BacillusstrainBF3252,说明BacillusWHG3251耐碱能力较强,而BacillusstrainBF3252在pH=9时生长状态相对较好,pH=11时BacillusWHG3251生长受到明显抑制,两株无花果活性内生芽孢杆菌对pH的耐受性有明显不同。从植物分离到两株具有芘降解功能内生细菌[18]及银杏内生细菌JX-3进行条件优化}结果发现生长最适pH为7.0,与本实验结果相同。
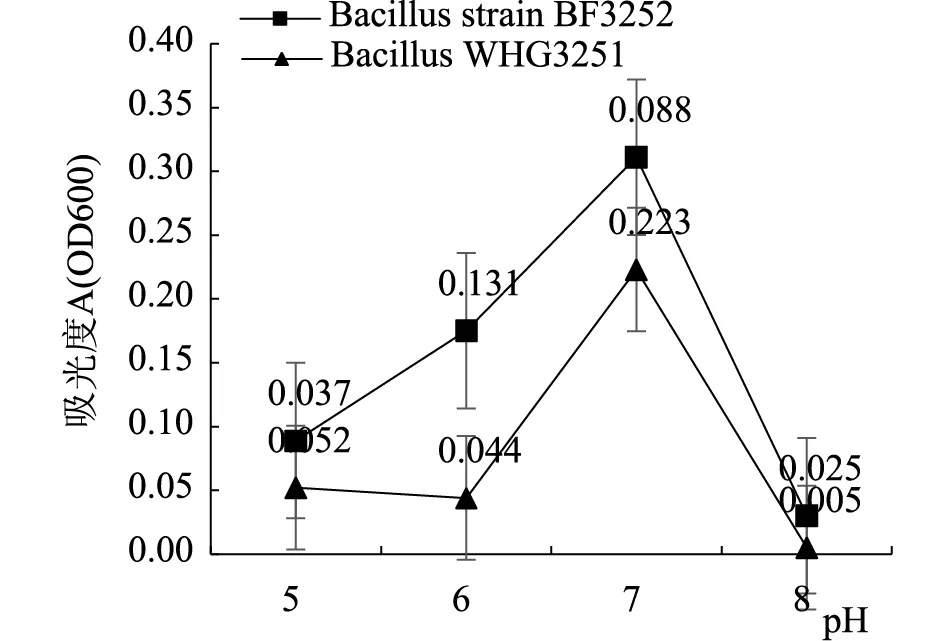
图5 无花果两株活性内生细菌生长最适pH
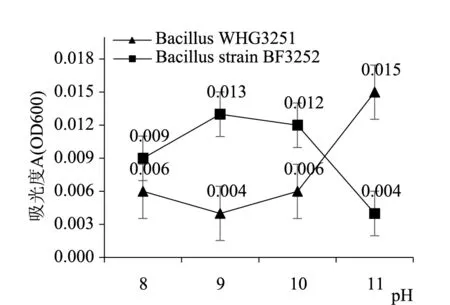
图6 pH对无花果两株活性内生细菌生长的影响
5.3.2 不同浓度NaCl对两株活性内生细菌生长的影响
本实验从无花果分离到的两株活性内生细菌BacillusWHG3251和BacillusstrainBF3252耐盐性测定结果发现(图7),两株活性内生细菌耐盐性也较强,NaCl浓度为10%时对两株无花果活性内生细菌的生长状态良好,其中BacillusstrainBF3252的生长状态明显优于BacillusWHG3251,BacillusWHG3251在NaCl浓度为5%时生长状态比对照好,而NaCl浓度为5%对BacillusstrainBF3252的生长表现出一定抑制作用,当NaCl浓度增加到15%时两株无花果活性内生细菌的生长受到明显抑制,NaCl盐浓度为20%时两株无花果活性内生细菌又表现出生长,一般来说,低浓度盐对厌氧微生物生长有促进作用,高浓度盐对厌氧微生物有抑制作用[20],代金霞[21]等从小叶锦鸡儿分离到78株内生细菌发现内生细菌NaC1的耐受能力差异较大,只有少部分(该实验为5%)能够在NaC1浓度10%的平板上生长。本实验从无花果分离到的两株活性内生细菌为芽孢杆菌属细菌,两株芽孢杆菌芽孢形成时间分别为25h、26h,芽孢出现时间相对较短(本实验室保存的枯草芽孢杆菌芽孢出现时间为46h)[13],芽孢的形成对不良环境条件有一定的耐受性,另外,BacillusWHG3251和BacillusstrainBF3252在盐浓度为20%出现生长可能深度休眠芽孢萌发有关[22],研究[23-24]也发现不同植物分离到的内生细菌能在NaCl浓度为10%的培养基中生长。
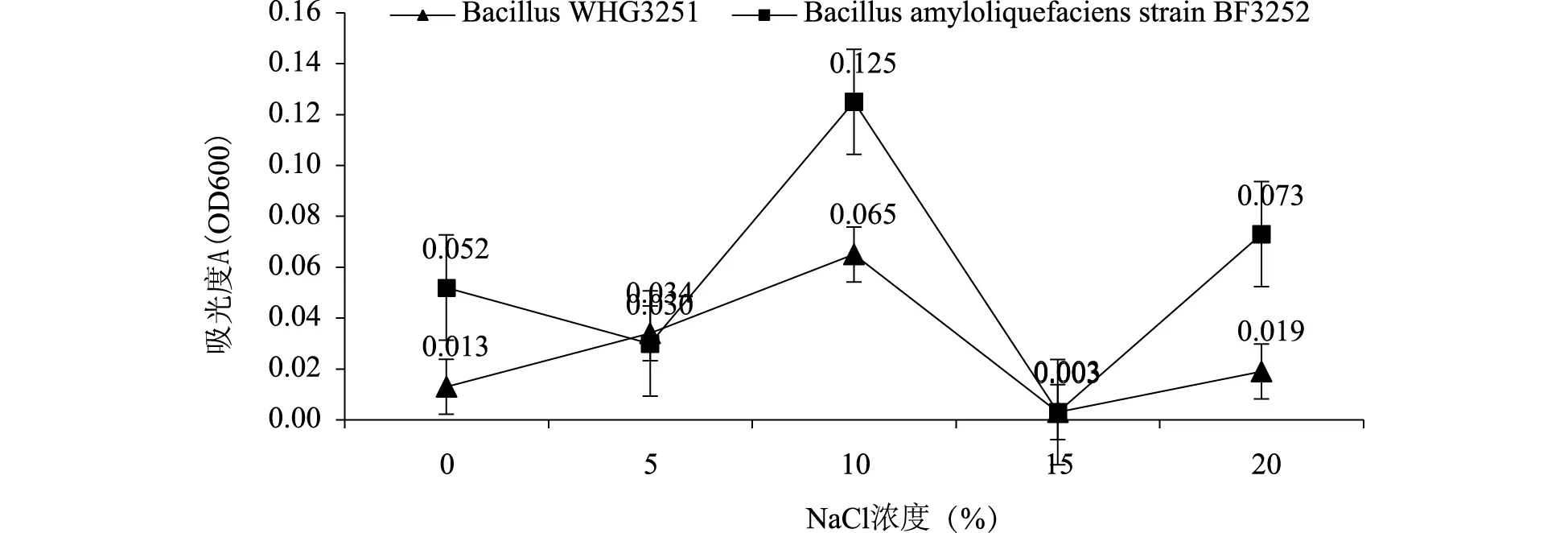
图7 NaCl对无花果两株活性内生细菌生长的影响
5.3.3 两株活性内生细菌菌解淀粉能力结果
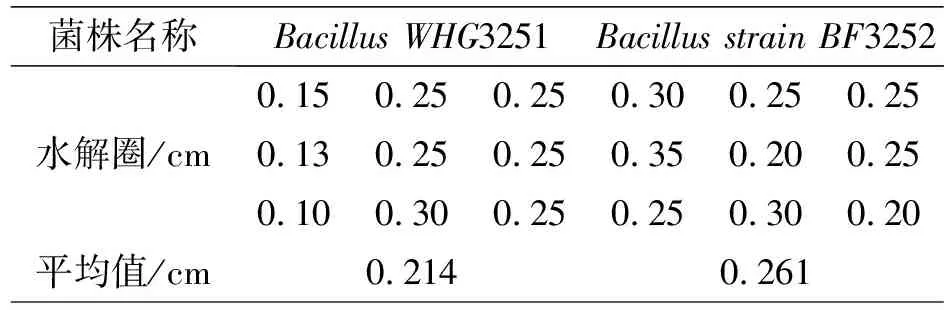
表2 株活性内生细菌解淀粉能力
表2结果显示BacillusWHG3251和BacillusstrainBF3252都能产生淀粉酶,两株无花果活性内生细菌在淀粉培养基上培养24h后,BacillusWHG3251的水解圈平均直径为0.21cm,BacillusstrainBF3252水解圈平均值为0.26cm,两株细菌产淀粉酶的能力有一定差异但比较接近,该水解圈大小不能完全代表这两株活性内生细菌的最大分解淀粉能力,研究[25-26]发现不同植物分离到的内生细菌有产淀粉酶的能力,其中内生芽孢杆菌具有产淀粉酶能力,但产淀粉酶能力有一定差异,微生物分解淀粉能力较弱与其对培养环境的适应能力有关。
6 结论
(1)从无花果果实中分离得到19株内生细菌,金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)和变形杆菌(P.vulgaris)筛选后得到2株活性内生细菌,分子量大小为1500bp,16SrRNA基因序列在NCBI数据库BLAST比对后确定为芽孢杆菌属细菌,生理生化实验后命名为BacillusWHG3251、BacillusstrainBF3252。
(2)两株活性内生细菌形态为杆状,革兰氏阳性菌,芽孢产生时间分别为25h和26h。
(3)BacillusWHG3251和BacillusstrainBF3252的生长最适pH为7.0,BacillusWHG3251比BacillusstrainBF3252有较强的耐碱性;两株活性内生细菌都有较强的耐盐性,BacillusstrainBF3252表现出更强的耐盐性特点;两株活性内生细菌都有产淀粉酶的能力。
