基于双螺旋点扩散函数工程的多焦点图像扫描显微*
2021-02-06李四维林丹樱邹小慧张炜陈丹妮于斌屈军乐
李四维 林丹樱 邹小慧 张炜陈丹妮 于斌† 屈军乐‡
1) (深圳大学物理与光电工程学院,光电子器件与系统教育部/广东省重点实验室,深圳 518060)
2) (广东省科学院航空装备研究所,珠海 519000)
在传统共聚焦显微技术的基础上,图像扫描显微技术使用面阵探测器来代替单点探测器,结合虚拟数字针孔并利用像素重定位和解卷积图像重构算法将传统宽场显微镜的分辨率提高一倍,实现了高信噪比的超分辨共焦成像.但是,由于采用逐点扫描的方式,三维成像速度相对较慢,限制了其在活体样品成像中的应用.为了进一步提高图像扫描显微术的成像速度,本文提出了一种基于双螺旋点扩散函数工程的多焦点图像扫描显微成像方法和系统.在照明光路中,利用高速数字微镜器件产生周期分布的聚焦点阵对样品进行并行激发和快速二维扫描; 在探测光路中,利用双螺旋相位片将激发点荧光信号的强度分布转换为双螺旋的形式;最终,利用后期数字重聚焦处理,从单次样品扫描数据中重构出多个样品层的超分辨宽场图像.在此基础上,利用搭建的系统分别对纤维状肌动蛋白和海拉细胞线粒体进行成像实验,证明了该方法的超分辨能力和快速三维成像能力.
1 引 言
激光扫描共聚焦显微 (confocal laser scanning microscopy,CLSM)技术[1−3]具有良好的成像分辨率和层析能力,被广泛应用于生命科学研究.在传统的CLSM 系统中,利用单个衍射受限的聚焦点对样品进行二维扫描,并在探测光路中放置针孔来阻挡来自样品离焦位置的荧光信号.虽然选用尺寸极小的针孔可以有效地提高CLSM 的成像分辨率,但同时也会阻挡大部分荧光信号,造成图像信噪比(signal-to-noise ratio,SNR)大幅下降.因此,在实际应用中,针孔尺寸通常选择为一个艾里斑的大小,通过牺牲分辨率来确保系统的最佳SNR.为了解决这一问题,Sheppard[4]于1988 年提出了像素重定位理论,利用面阵探测器代替CLSM 中的单像素探测器,通过后期像素重定位的数据处理来获得高SNR 的超分辨图像.但受限于当时的硬件技术,直到20 多年后该理论才被Müller 和Enderlein[5]实验验证,并将该技术命名为图像扫描显微(image scanning microscopy,ISM)技术[6−8],其在保持高SNR 的同时将成像分辨率提升至宽场照明成像的2 倍.Jesacher 等[9]和Roider 等[10]将双螺旋点扩散函数(double-helix point spread function,DH-PSF)工程技术与ISM 结合,提出了一种基于螺旋相位工程的数字重聚焦扫描显微(refocusing after scanning using helical phase engineering,RESCH)技术,其在探测光路中引入DH-PSF 相位片,将样品发射的高斯荧光点转换成双螺旋的形式; 在此基础上,利用DH-PSF 的轴向定位特性和后期数字重聚焦处理方法,RESCH 能够从单次二维扫描的数据中获得轴向400 nm 范围内样品不同层的结构信息,大幅提升了ISM 的三维成像速度.随后,该研究组对RESCH 进行了改进,将PSF工程同时应用于照明和探测光路,提出了一种工程化的ISM (engineered ISM)[11],该方法将RESCH的轴向探测范围扩展到2 µm,进一步减少了ISM的三维成像所需要的时间.虽然这些方法能够有效提高ISM 的三维扫描成像速度,但受到电荷耦合器件(CCD)像素信号读取时间和单聚焦点激发模式的限制,其对尺寸为8 µm×8 µm 样品区域的成像时间约为1 min,远不能满足活体细胞的动态观测.2017 年,Wang 等[12]将螺旋相位工程应用于传统的宽场照明显微系统中,提出了一种三维宽场荧光成像显微技术,该技术仅需要单次相机曝光即可获得一定轴向范围内的样品结构信息,虽然具有较高的时间分辨率,但是由于成像分辨率和层析能力较差,仅适用于稀疏结构的薄生物样品成像.2018 年,本课题组[13]将螺旋相位工程与多焦点结构光显微(multifocal structured illumination microscopy,MSIM)技术[14]相结合,提出了一种快速三维超分辨显微方法,命名为MSIMH (MSIM with helical phase engineering),该技术利用DH-PSF的轴向深度编码特性、反卷积和像素重定位算法,实现了无需轴向扫描即可快速获取焦深范围内样品结构的超分辨三维图像,但是由于轴向重叠部分的样品信息会在重构中丢失,因此,该重构方法无法适用于结构较为密集的生物样品成像,需要进一步发展新的超分辨重构算法来扩展MSIMH 的应用场景.
为了解决上述问题,在RESCH 和MSIMH 的基础上,本文提出一种基于多焦点结构光照明的RESCH,命名为MRESCH,该技术在RESCH的照明光路中引入了数字微镜器件(digital micromirror device,DMD),能够对样品面上的光强进行调制,产生周期分布的聚焦点阵,实现样品不同位置的同时激发,大幅提高了系统的成像速度.在探测光路中,双螺旋相位工程的引入将标准点扩散函数转换为双螺旋的形式,并且结合后期的数字重聚焦处理,从单次二维扫描图像堆栈中重构出样品在不同轴向位置的结构信息,大幅减少三维测量的时间.最终,使用搭建的MRESCH 系统对纤维状肌动蛋白和海拉细胞的线粒体进行成像实验,验证了方法的可行性和成像效果.
2 MRESCH 的基本原理
2.1 MRESCH 的光路设计
MRESCH 的光路示意图如图1(a)所示,在照明光路中,波长为488 nm 的激光经4f 系统准直扩束后直接照射到DMD 面板上,其入射角与DMD 面板呈24°; 接着,激光经DMD 调制后进入后续的4f 系统,其傅里叶面位置上的光阑可以有效阻止多余衍射级的光进入显微系统.最后,4f 后焦面位置形成的聚焦点阵经过管镜和物镜缩小后重新聚焦到样品面上,尺寸为原来的1/90.本文实验中所使用的DMD 面板的像素个数为1024 ×768,像素尺寸为10.8 µm×10.8 µm,对应到样品面上的尺寸为120 nm×120 nm.在探测光路中,样品发出的荧光经物镜(尼康,60×,NA = 1.27水镜)和管镜收集后,然后通过具有双螺旋相位片的4f 系统,最后成像在科学级互补金属氧化物半导体探测器(sCMOS,滨松,ORCA Flash 4.0 V2)上.其中,双螺旋相位片放置在4f 系统的傅里叶面位置,与物镜的后焦面呈共轭关系,双螺旋相位片能够对探测系统的传递函数进行调制,将标准PSF 转换为DH-PSF 的形式.DH-PSF 是一种特殊的三维点扩散函数,常用于细胞内分子的三维定位和成像[15−18],当分子的轴向位置发生改变时,DH-PSF 的两个旁瓣会围绕着光轴进行旋转,如图1(b)所示,因此,可以通过两个旁瓣之间的相对旋转角度来精确确定分子的轴向位置.目前,DHPSF 相位片的设计有多种方法[19−22],本文根据文献[19]中的方法进行设计,并利用荧光珠样品来标定DH-PSF 旋转角度θ与样品激发位置z的线性关系k,如图1(c)所示,经计算DH-PSF 旋转180°对应样品的轴向位移Δz约为5.5 µm.
2.2 MRESCH 的成像原理
在MRESCH 系统中,将特定的投影模式(见图2(a))载入DMD 来产生周期分布的聚焦点阵对样品进行照明激发,在样品面的强度分布如图2(b)所示.当投影模式切换时,“on”像素的位置将沿红色轨迹进行移动(1 pixel/step),实现样品的快速扫描.其中单个激发荧光点在探测面上的强度分布可以表示为

其中ρ表示样品的荧光密度; *表示卷积运算;h1,h2分别为激发与探测点扩散函数.在MRESCH 系统中,由于双螺旋相位片的存在,h2由标准PSF变为DH-PSF,如图2(c)所示,其三维强度分布表示为

式中,rot(h,θ)表示将h逆时针旋转θ角; Δx表示双螺旋两个旁瓣之间的距离;k表示DH-PSF 的旋转角度与样品离焦距离之间的线性关系;g表示单个旁瓣的强度分布,可近似用高斯函数进行表示:

图1 (a) MRESCH 的光路; (b) DH-PSF 在不同轴向位置的强度分布; (c) DH-PSF 旋转角度与对应轴向位置的关系曲线Fig.1.(a) Optical configuration of MRESCH; (b) intensity distribution of the DH-PSF at different positions along z-axis; (c) relationship between the two lobe rotation angles of the DH-PSF and position of z-axis.

图2 (a) DMD 上载入的投影模式; (b) 激发罗丹明染料样品探测到的荧光点阵分布; (c) 存在相位片的条件下,激发罗丹明染料样品探测到的双螺旋荧光点阵分布Fig.2.(a) Project pattern of DMD; (b) the fluorescence image of the excitation foci in a uniform solution of Rhodamine 6G at the sample plane; (c) the fluorescence image of the excitation foci in a uniform solution of Rhodamine 6G at the sample plane with DH phase mask.

其中,σx,σy分别为高斯函数在x和y方向的标准差,为了方便计算可将σx,σy看作近似相等.
当MRESCH 进行三维成像时,样品不同深度发射的荧光信号会在成像面的不同轴向位置形成多个聚焦点,如图3 所示.其中,物镜焦平面上的荧光信号经相位片调制后在相机的探测面上形成一个水平的双螺旋点,而样品离焦位置的信号则在探测面的对应位置形成具有一定旋转角度的双螺旋点.最终,通过计算每个双螺旋点的旋转角度来获得样品的三维信息.
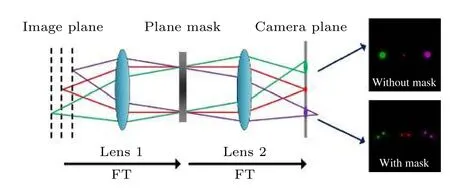
图3 MRESCH 的成像原理(FT,傅里叶变换)Fig.3.Imaging principle of MRESCH (FT,Fourier transform).
2.3 MRESCH 的图像重构过程
在多数图像扫描显微技术中,如ISM,MSIM,MSIMH 等,宽场图像的重构是将所有扫描位置的荧光点信号进行数字处理后线性叠加而成.而MRESCH 的图像重构更加类似于传统的共聚焦显微成像,即将每个扫描位置(i,j)的荧光点信号强度作为重构图像中对应像素位置(i,j)的像素值V(i,j) .由于MRESCH 使用的是面阵探测器sCMOS,需要通过后期数字处理来实现上述过程.另外,由于双螺旋相位片的引入将原本高斯分布的激发荧光点转换成双螺旋的形式,其会根据样品激发位置的深度z不同而产生相应的旋转,如图4(a)所示.基于上述特性,MRESCH 可以利用数字针孔(digtal pinhole,DP)将不同深度的样品荧光信息分别筛选出来进行重构,实现不同样品层的超分辨二维成像.具体过程见图4(b),首先,需要将图像数据中所有双螺旋点附近的灰度值按照扫描的顺序依次截取出来构成一个亚图像堆栈Ri,j(x,y) ;接着,根据需要重构的样品层深度z生成一个二值的数字针孔DP(x,y) ,由两个圆形二值矩阵构成,两个圆心的连线与水平方向的夹角为kz.然后,将DP(x,y)依次附在每个双螺旋点上并对灰度值进行求和,获得像素值V(i,j) ,用公式表示为
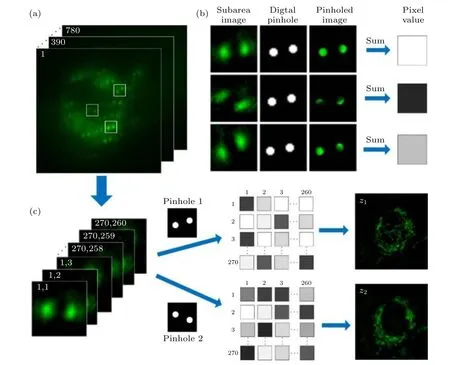
图4 (a) MRESCH 的原始图像数据; (b) 附上数字针孔后的双螺旋点; (c) MRESCH 的图像重构过程Fig.4.(a) Raw images of MRESCH; (b) the pinholed DH-PSF; (c) principle of MRESCH wide-field image reconstruction.

最后,将每个像素值V(i,j) 按照扫描顺序进行排列来重构出样品结构的宽场图像,如图4(c)所示.可以看出,当两个不同角度的DP1和DP2分别应用到同一组MRESCH 数据时,同一个扫描位置的像素值V(i,j) 会因为DP的不同而产生明显的数值差异,最终重构出两个完全不同的宽场图像,它们分别对应不同深度的样品结构信息.
3 MRESCH 的生物学实验
为了确定MRESCH 的成像分辨率,使用牛肺动脉内皮细胞标准样片(F36924,Thermo Fisher Scientific Inc.,USA)作为测试样品.在实验中,首先对细胞中的纤维状肌动蛋白进行宽场照明成像,其结构分布如图5(a)所示,受到背景荧光的影响,蛋白微丝束的周围充斥着大量的噪声,将一些原本微弱的样品结构信号淹没,造成部分细节的丢失和横向分辨率的下降.接着,利用MRESCH 对同一区域进行扫描并重构,结果如图5(b)所示.可以看出,数字针孔的使用有效地将微丝束周围的背景荧光滤除,大幅提高了图像的对比度.为了更好地比较两种方法,对图5(a)和图5(b)中矩形虚线区域进行放大,如图5(c)所示,通过比较发现,MRESCH 能够将原本在图5(c)-1 中难以分辨的相邻微丝束结构区分开来.最后,通过对图5(a)和图5(b)中划线位置横切面强度的半高宽进行计算来确定MRESCH 的横向分辨率,其数值曲线如图5(d)所示,其中宽场照明成像的横向分辨率约为374 nm,MRESCH 约为277 nm,结果表明MRESCH 的横向分辨率约为宽场照明的1.34 倍,与传统的共聚焦显微镜相近.
接着利用MRESCH 对海拉细胞中的线粒体进行三维成像,该样品经染料标记后,能够在488 nm的激光照射下发射高效率的530 nm 绿色荧光信号.在实验中,首先将样品固定在三维位移台上,并对线粒体在不同轴向位置(z= 0,± 1000 nm)的结构分布进行宽场照明成像,结果如图6(a)—(c)所示,可以看出线粒体在整个细胞中呈三维的结构分布,其在不同的轴向位置具有不同的结构形态.接着将样品移回至z= 0 nm 的位置并利用MRESCH 对样品进行二维扫描,扫描点的横纵间距分别为30 pixels 和26 pixels,扫描步数为780 步,每步对应的相机曝光时间为8 ms,成像总时间约6 s.最后根据2.3 节所述的数据处理方法,利用不同角度的数字针孔对不同深度的样品信息进行重构,结果如图6(d)—(f),可以看出重构的线粒体结构相比于宽场照明更加锐利.另外,传统的宽场照明成像只能够获得位于物镜焦面附近的样品结构信息,其他轴向位置的线粒体结构在探测面上会变得模糊而无法分辨,如果想要获得离焦区域的结构信息,需要将物镜重新对焦到离焦面或者利用位移台把样品沿轴向位置移动一定距离,这些过程都会花费大量的成像时间.对于MRESCH 而言,基于双螺旋点扩散函数的特点,可以通过单次扫描和后期数据处理来获得样品在一定轴向范围内的三维空间结构,大幅提高数据采集效率.

图5 宽场照明和MRESCH 对纤维状肌动蛋白的成像结果比较 (a) 纤维状肌动蛋白的宽场照明成像结果; (b) MRESCH 的成像结果; (c) 图(a)和图(b)中白色方块区域的放大; (d)图(a)和图(b)中划线位置的横切面强度图(半高宽分别为: 宽场(WF)照明图像374 nm、MRESCH 图像 277 nm)Fig.5.Comparison of F-actin imaging results with wide-field illumination and MRESCH: (a) Wide-field image of F-actin;(b) MRESCH image of F-actin; (c) magnification of white box region in panels (a) and (b); (d) plots of intensity along the colored lines in panels (a) and (b); the FWHM values are 374 nm and 277 nm for wide-field (WF) and MRESCH,respectively.

图6 宽场照明和MRESCH 对海拉细胞线粒体成像结果比较 (a) 线粒体在z = –1000 nm 位置的宽场成像结果; (b) 线粒体在z = 0 nm 位置的宽场成像结果; (c) 线粒体在z = 1000 nm 位置的宽场成像结果; (d) 线粒体在z = –1000 nm 位 置 的MRESCH 成像结果; (e) 线粒体在z = 0 nm 位置的MRESCH 成像结果; (f) 线粒体在z = 1000 nm 位置的MRESCH 成像结果Fig.6.Comparison of mitochondrial imaging results of HeLa cells with wide-field illumination and MRESCH: (a) Wide-field image of mitochondria at z = –1000 nm; (b) wide-field image of mitochondrion at z = 0 nm; (c) wide-field image of mitochondria at z =1000 nm; (d) image obtained via MRESCH at z = –1000 nm; (e) image obtained via MRESCH at z = 0 nm; (f) image obtained via MRESCH at z = 1000 nm.
4 总 结
本文基于双螺旋点扩散函数工程,提出了一种多焦点图像扫描显微技术.该方法将传统的多焦点结构光照明显微技术与双螺旋点扩散函数工程相结合,通过后期的数据处理,能够从单次二维扫描的信息中重构出不同深度的样品信息,大幅减少了三维成像所需要的二维扫描次数,提高样品采集的速度并减少了光毒性,对于生命科学的研究具有重要的意义.
