建构“2H++O2-====H2O”模型及其在化学计算中的应用
2021-01-23周昌勇张琦
周昌勇 张琦




摘要: 以浙江省近几年选考的有关氧化还原计算问题为素材,分类探讨固体氧化物分解、金屬和金属氧化物混合体系与酸反应、金属与硫酸和硝酸混合溶液的反应以及非金属单质的歧化反应等四类计算问题,建构以“2H++O2-H2O”为主的解题模型。在此基础上对该类计算问题从命题角度进行建模讨论,以加深对该类计算问题的认知,同时为了更直观地呈现解题过程用流程图形式进行了表征。
关键词: 2H++O2-H2O; 氧化物等价模型; 计算模型; 氧化还原
文章编号: 1005-6629(2021)12-0086-07
中图分类号: G633.8
文献标识码: B
建构模型是基于对研究样本进行实践分析和证据推理后利用简化、类比和抽象的方法将研究样本的本质特征和内在关联形成概括性描述或认识思路[1]。近几年浙江选考化学计算能力的考查都与氧化还原反应有关,但对该类问题很少有系统性的研究。基于软硬酸碱理论[2]可知,属于硬碱的O2-和属于硬酸的H+结合力很强,由于水溶液中H+通过氢键形成的特殊通道进行迁移[3],反应速率比氧化还原反应要快得多,因此H+优先于其他离子与O2-结合。基于此理论,本文另辟蹊径建构“2H++O2-H2O”的解题模型,并与其他解题模型进行比较。在此基础上对该类问题从命题角度进行探究,建构该类问题的命题模型,以强化对该类计算问题解题模型的理解。
1 固体氧化物先分解后加酸模型
1.1 解题模型建构
例1 取7.90g KMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体Cl2,产物中锰元素以Mn2+存在,请计算Cl2的物质的量。
[模型1]“2H++O2-H2O”模型。利用固体和O2的质量,计算出剩余固体中m(O),由2H++O2-H2O,算出反应的盐酸的量,再根据电荷守恒,算出Cl2的量。具体见图1。
[模型2]氧化物等价模型。受“一锅法”思想[4]的启发,本文依据等价拆分思想,先确定金属元素的最终价态,然后拆成其对应的氧化物形式,建构如下解题模型。具体见图2。
[模型3]电子守恒模型。0.05mol KMnO4中Mn7+→Mn2+,共转移0.25mol电子,其中第一步分解的O2为0.015mol,转移0.015×4=0.06mol电子,则Cl2转移剩下0.19mol电子,即可得Cl2为0.095mol,流程如图3所示。
1.2 命题模型
以上题为原型进行命题模型的建构,该类物质具有高价态、不稳定性的特点,而分解的产物能把Cl-、Br-、I-、S2-等氧化的特点,其基本模式如图4所示。
按照上面的命题模型,符合此条件的常见物质有: PbO2→Pb3O4+O2, Pb3O4+8HCl3PbCl2+Cl2↑+4H2O; Co2O3→Co3O4+O2, Co3O4+8HCl3CoCl2+Cl2↑+4H2O; ClO-3+5Cl-+6H+3Cl2↑+3H2O等。若酸为HI和H2S,命题素材还可以选取Fe2O3、Fe3O4、CuO等,相关反应如: 2Fe3++2I-2Fe2++I2、2Cu2++4I-2CuI+I2等。
[命题]1mol PbO2分解得到O2,再向剩余固体中加入足量浓盐酸又生成Cl2,若剩余的PbO2、Pb3O4和PbO的物质的量比为1∶1∶4,则生成的O2和Cl2的比为 。
[模型1]“2H++O2-H2O”模型。铅的最终价态为二价,按产物之比确定Pb: O=1.25,即剩下的固体相当于PbO1.25,生成的n(O2)=0.375mol; PbCl2←PbO1.25→2.5HCl,可知多出的0.5Cl→0.25Cl2,即两者之比为3∶2。
[模型2]氧化物等价模型。PbO2→PbO1.25+0.375O2→PbO+0.25O+0.375O2→PbO+0.25Cl2+0.375O2,即两者之比为3∶2。
2 金属和金属氧化物混合物加酸模型
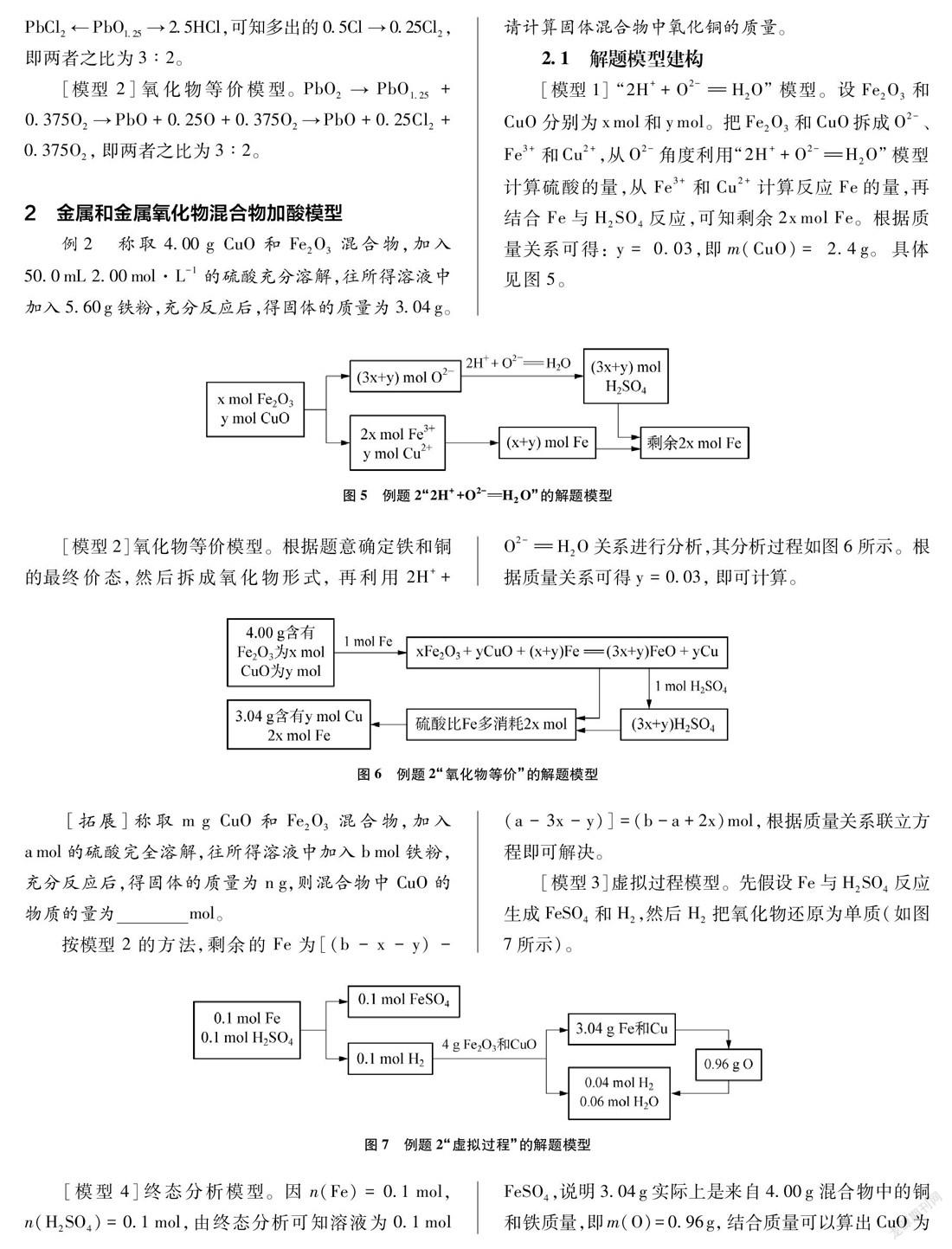
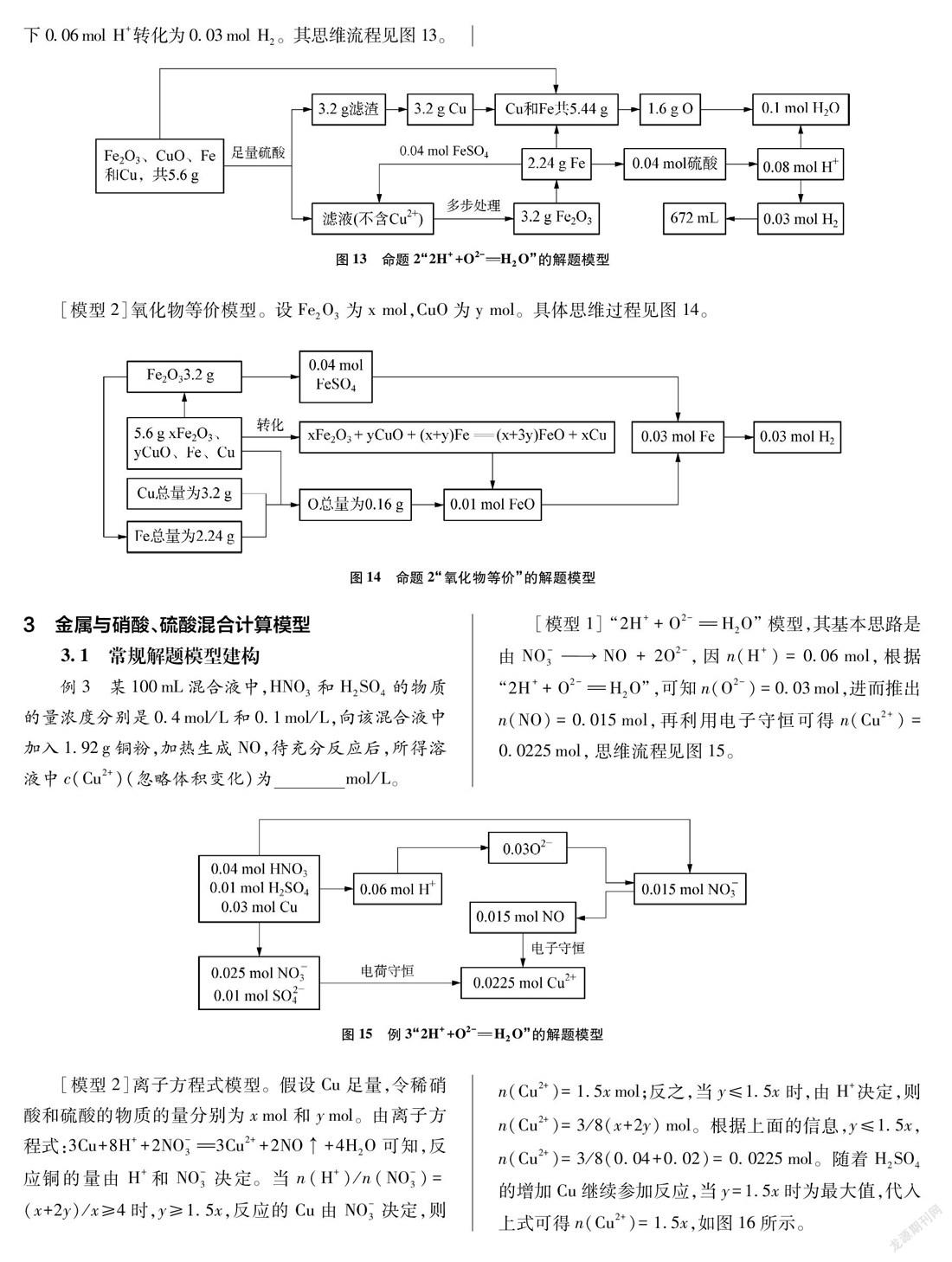
例2 称取4.00g CuO和Fe2O3混合物,加入50.0mL 2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。请计算固体混合物中氧化铜的质量。
2.1 解题模型建构
[模型1]“2H++O2-H2O”模型。设Fe2O3和CuO分别为xmol和ymol。把Fe2O3和CuO拆成O2-、Fe3+和Cu2+,从O2-角度利用“2H++O2-H2O”模型计算硫酸的量,从Fe3+和Cu2+计算反应Fe的量,再结合Fe与H2SO4反应,可知剩余2xmol Fe。根据质量关系可得: y=0.03,即m(CuO)=2.4g。具体见图5。
[模型2]氧化物等价模型。根据题意确定铁和铜的最终价态,然后拆成氧化物形式,再利用2H++O2-H2O关系进行分析,其分析过程如图6所示。根据质量关系可得y=0.03,即可计算。
[拓展]称取mg CuO和Fe2O3混合物,加入amol的硫酸完全溶解,往所得溶液中加入bmol铁粉,
充分反应后,得固体的质量为ng,则混合物中CuO的物质的量为 mol。
按模型2的方法,剩余的Fe为[(b-x-y)-(a-3x-y)]=(b-a+2x)mol,根据质量关系联立方程即可解决。
[模型3]虚拟过程模型。先假设Fe与H2SO4反应生成FeSO4和H2,然后H2把氧化物还原为单质(如图7所示)。
[模型4]终态分析模型。因n(Fe)=0.1mol,n(H2SO4)=0.1mol,由终态分析可知溶液为0.1mol FeSO4,说明3.04g实际上是来自4.00g混合物中的铜和铁质量,即m(O)=0.96g,结合质量可以算出CuO为2.4g。
具体见图8。
[模型5]反应的方程式模型。按反应顺序依次写出相关反应,令n(Fe2O3)=xmol, n(CuO)=ymol,具体见图9。可知硫酸比铁多消耗: 3x+y-(x+y)=2xmol,即剩余的Fe为2xmol,根据质量关系计算即可。
2.2 命题模型
该模型先在一定质量的金属和金属氧化物混合物中加入酸溶解,有固体析出或加入金属或碱等使固体析出,然后根据固体的质量进行相关的计算。其模型如图10所示。
图10 金属及其氧化物加酸的命题模型
命题素材可以选择Fe、Cu、Fe2O3、Fe3O4、FeO、CuO、Cu2O,这些物质的组合,然后对这些混合物加酸,在此基础上设计问题。
[命题1]某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。若a=1/9m,则红色固体粉末中Cu2O的物质的量为 mol。
[模型1]“2H++O2-H2O”模型。假设硫酸刚好完全反应,设Fe2O3为x mol,Cu2O为y mol,由“2H++O2-H2O”模型,建构如下解题流程,具体见图11。再根据质量关系,可得160x+144y=m, 64(y-x)=1/9m,即可得到y=3m/1216。
[模型2]氧化物等价模型。设Fe2O3为x mol,Cu2O为y mol,按模型的方法,根据金属的最终价态先拆成氧化物形式,具体见图12。由于硫酸足量,最后剩余的是铜,根据质量关系即可得到y=3m/1216。
[命题2]含有CuO和Fe2O3的铜铁合金共5.6g,加入足量稀硫酸后得滤渣3.20g和不含Cu2+的滤液,滤液中加入足量碱,灼烧后称其质量为3.2g。计算加入稀硫酸后产生的气体在标况下的体积为 。
[模型1]“2H++O2-H2O”模型。根据题意可知铜为0.05mol、Fe为0.04mol,可推出反应消耗的H2SO4为0.04mol,共有0.08mol H+。由m(Cu)+m(Fe)=5.44g, m(O)=5.6-5.44=0.16g, n(O)=0.01mol。根据2H++O2-H2O,消耗0.02mol H+,则剩下0.06mol H+转化为0.03mol H2。其思维流程见图13。
[模型2]氧化物等价模型。设Fe2O3为x mol,CuO为y mol。具体思维过程见图14。
3 金属与硝酸、硫酸混合计算模型
3.1 常规解题模型建构
例3 某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92g铜粉,加热生成NO,待充分反应后,所得溶液中c(Cu2+)(忽略体积变化)为 mol/L。
[模型1]“2H++O2-H2O”模型,其基本思路是由NO-3NO+2O2-,因n(H+)=0.06mol,根据“2H++O2-H2O”,可知n(O2-)=0.03mol,进而推出n(NO)=0.015mol,再利用电子守恒可得n(Cu2+)=0.0225mol,思维流程见图15。
[模型2]离子方程式模型。假设Cu足量,令稀硝酸和硫酸的物质的量分别为xmol和ymol。由离子方程式:3Cu+8H++2NO-33Cu2++2NO↑+4H2O可知,反应铜的量由H+和NO-3决定。当n(H+)/n(NO-3)=(x+2y)/x≥4时,y≥1.5x,反应的Cu由NO-3决定,则n(Cu2+)=1.5xmol;反之,当y≤1.5x时,由H+决定,则n(Cu2+)=3/8(x+2y)mol。根据上面的信息,y≤1.5x, n(Cu2+)=3/8(0.04+0.02)=0.0225mol。隨着H2SO4的增加Cu继续参加反应,当y=1.5x时为最大值,代入上式可得n(Cu2+)=1.5x,如图16所示。
3.2 命题模型
该模型是在硝酸盐或硝酸中再加入硫酸,硫酸提供的H+与溶液中的NO-3继续其氧化作用,而SO2-4可以平衡金属氧化产生的正电荷,其模型如图17所示。
命题素材可以是Fe、Cu与硝酸、硫酸、硝酸盐、硫酸盐溶液的组合。
[命题1]某100mL HNO3和H2SO4的混合液中,两种酸的物质的量浓度之和为0.6mol/L,向该混合液中加入足量的铜粉,待充分反应后,所得溶液中Cu2+的物质的量浓度(忽略体积变化)最大为 mol/L。
[模型]“2H++O2-H2O”模型。令硝酸和硫酸的浓度分别为x和y,根据NO-3NO+2O2-, c(H+)=x+2y,
可知c(O2-)=0.5x+y,c(NO-3)=0.25x+0.5y;要想使c(Cu2+)最大时硝酸完全被还原,要满足x=0.25x+0.5y,可得y=1.5x,又有x+y=0.6,即x=0.24mol/L,再根据电子守恒可知c(Cu2+)最大为0.36mol/L。
[命题2]某稀溶液中含有3.5mol KNO3和2.2mol硫酸,向其中加入1.2mol Fe,充分反应后(已知NO-3
被还原为NO),则溶液中Fe3+和Fe2+的比是 。
[模型]“2H++O2-H2O”模型。由题意可知NO-3过量,因此反应的Fe由H+决定。根据NO-3NO+2O2-, 2H++O2-H2O,由于H+为4.4mol,可得1.1mol NO,即n(e-)=3.3mol,可算出Fe被氧化的平均价态为3.3/1.2,可算出Fe3+和Fe2+的比为3∶1。其思维过程见图18。
[命题3]某稀溶液中含4mol KNO3和2.5mol H2SO4,向其中加入1.5mol Fe粉,充分反应后产生的气体(NO)在标况下的体积为 L。
[模型]“2H++O2-H2O”模型。由题意可知NO-3过量,因此反应的Fe由H+决定。由NO-3NO+2O2-, 2H++O2-H2O,因H+为5mol,可得1.25mol NO,其体积为28L。
4 非金属单质与碱反应的模型计算
例4 计算2.560g硫单质与60.0mL 1.00mol·L-1热KOH溶液恰好完全反应,只生
成K2Sx和K2S2O3,则x= 。
[模型1]“2H++O2-H2O”模型。根据题意可得0.08S+0.06KOHK2Sx+K2S2O3+H2O,由2H++O2-H2O可知,n(H2O)=0.03mol,再由O守恒,则n(K2S2O3)=0.01mol,再由S和K守恒,可知K2Sx中n(K+)=0.04mol,n(S)=0.06mol,可知x=3。具体见图19。
[模型2]电子守恒模型。由K+守恒可得: 0.08S+0.06KOH→(0.03-a)K2Sx+aK2S2O3+H2O,再由S守恒可得x(0.03-a)+2a=0.08,由电子守恒得到: x(0.03-a)2/x=4a,联立解得a=0.01,x=3。具体见图20。
命题素材选择能歧化的非金属单质如卤素、硫、磷,以及一些NO2、MnO2-4、S2O2-3、Cu2O等。
在酸性体系中歧化的有: S2O2-3+2H+S↓+SO2↑+H2O、3MnO2-4+4H+MnO2↓+2MnO-4+2H2O、Cu2O+2H+Cu2++Cu+H2O;在碱性体系中歧化的有: 2NO2+2OH-NO-3+NO-2+H2O、P4+3OH-+3H2O3H2PO-2+PH3↑等。命题模型如图21所示。
[命题]Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关。用24g NaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化),某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-)= mol·L-1。
[模型]“2H++O2-H2O”模型。根据题意可得: Cl2+0.6NaOH6xNaCl+xNaClO+(0.6-7x)NaClO3+H2O,由2H++O2-H2O可知,n(H2O)=0.3mol,再由O守恒,x+3(0.6-7x)=0.3,可得x=0.075mol,則c(ClO-)=0.3mol·L-1。具体见图22。
5 结语
模型思想是化学学科核心思想中重要的内容,通过建构解题模型可以培养学生系统性研究问题的能力,是培养学生科学素养和研究能力的重要途径。本文以含氧化合物的计算问题为载体,以建构模型为突破点,从“2H++O2-H2O”为切入点对该类问题进行系统性的建构,找到解决该类问题行之有效的方法,以达到减负增效的目的。当然,每种模型都不可能是万能的,需要不断完善与发展。但建构解题模型的方向是正确的,希望此文能起到抛砖引玉之作用,切实改变当前题海战术的现状。
参考文献:
[1]王德胜. 化学方法论[M]. 浙江: 浙江教育出版社, 2007: 134~141.
[2]严宣申等. 普通无机化学[M]. 北京: 北京大学出版社, 2010: 178~179.
[3]傅献彩等. 物理化学[M]. 北京: 高等教育出版社, 1999: 533~534.
[4]周昌勇. “一锅法”在化学解题中的应用[J], 化学教学, 2013, (7): 67~70.
