胰高血糖素样肽-1(GLP-1)类似物研究进展
2021-01-20蒋镜清谈梦璐陈圣福
蒋镜清, 符 玲, 谈梦璐, 陈圣福
(1. 浙江大学 化学工程与生物工程学院, 浙江 杭州 310027)
1 前 言
随着经济的发展和人口老龄化的加剧,糖尿病患者人数飞速增长。国际糖尿病联盟(IDF)于 2019 年公布的第9 版全球糖尿病患者分布地图显示,2019 年全球20~79 岁的糖尿病患病人数约为4.63 亿,预计2045 年糖尿病患病人数将增长到7 亿[1]。庞大的患病群体、慢性疾病长期用药的特征使得糖尿病用药成为全球第二大市场。Ⅱ型糖尿病患者数在糖尿病患者总数中占比约为95%。胰高血糖素样肽-1(GLP-1)作为治疗Ⅱ型糖尿病(T2DM)的重要靶点之一,具有治疗效果明显,半衰期短,容易被清除等特点,因此,GLP-1 长效受体激动剂的开发已成为国内外的研究热点。一些已上市的GLP-1 类似物也因优秀的治疗效果与安全性在近几年得到快速发展。GLP-1 类似物药物在全球糖尿病药物的市场份额,从2015 年的10%飞速增长到2017 年的16%。但由于GLP-1 类似物药物主要被诺和诺德和礼来等制药巨头垄断,国内市场份额仍很小。因此,本文总结GLP-1 类似物的研究进展,分析现有GLP-1 类药物在临床应用中存在的问题,有助于确立未来长效GLP-1 类似物的发展方向。
2 GLP-1 及其治疗T2DM 作用机制
GLP-1 是肠促胰素的一种,它由胰高血糖素原酶切所得,如图1 所示。胰高血糖素原是一种由 160 个氨基酸组成的肽类激素,存在于肠L 细胞或大脑中,它在被前蛋白转化酶 1(PC1)切割后[2-3],裂解为 78-107 和78-108 这 2 种不同存在形式的GLP-1。第1种形式是30个氨基酸组成的GLP-1的酰胺化形式,即 GLP-1(7–36)酰胺[4];第 2 种形式是甘氨酸延伸成的31 肽形式,即GLP-1(7–37)的,如图2 所示。人体中大部分有效GLP-1以GLP-1(7–36)酰胺的形式存在[4-7]。
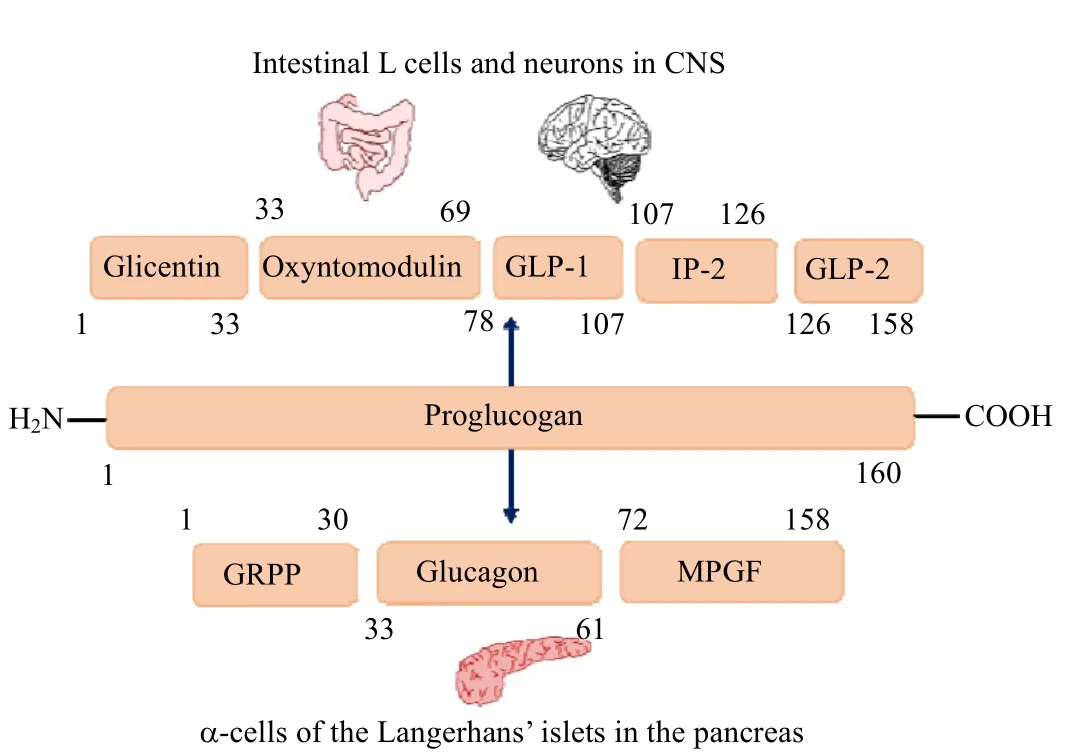
图1 GLP-1 来源示意图Fig.1 Schematic diagram of GLP-1 formation
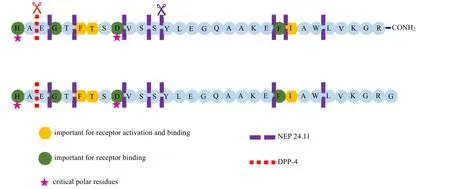
图2 GLP-1 结构特点示意图Fig.2 Schematic diagram of GLP-1 structure
研究表明,GLP-1 中的 His7、Gly10、Phe12、Thr13、Asp15、Phe28 和 Ile29 是影响 GLP-1 与GLP-1受体(GLP-1R)结合主要的氨基酸位点,而His7, Gly10, Asp15 和Phe28 是激活GLP-1R 主要的氨基酸位点[8]。GLP-1 分布在肠道、血液、肝脏和大脑中,在被二肽基肽酶-IV(DPP-IV)识别后,会被切割成GLP-1(9-36)酰胺而迅速失效[9-13]。除了DPP-IV,肽链内切酶24.11(NEP 24.11)也会参与GLP-1 的降解[14]。同时,GLP-1还会快速被肾清除[15]。因此,天然GLP-1 在体内的半衰期通常只有2~3 min。
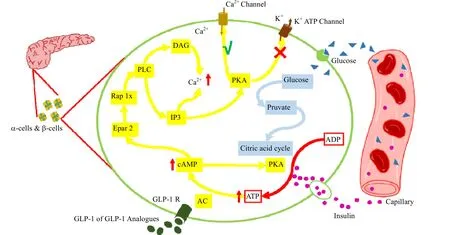
图3 GLP-1 作用机理示意图Fig.3 Schematic diagram of GLP-1 functioning mechanism
正常人血液中的GLP-1 浓度表现出昼夜节律,白天比夜晚更高[16],口服摄入营养物质会促进GLP-1分泌[17-18],从而促进胰岛素分泌,除此之外,口服摄入蛋白质还可促进 GLP-1 合成[19]。与正常人不同,Ⅱ型糖尿病患者与正常人相比,在口服摄入营养物质后,GLP-1 释放能力下降,肠促胰素作用明显减弱。研究表明,除了GLP-1 分泌减少之外,GLP-1R 敏感性降低,肾小球内皮细胞中DPP-IV 的过度活跃,也可能是潜在的Ⅱ型糖尿病的致病机理[20]。因此,静脉注射GLP-1 可以帮助Ⅱ型糖尿病患者提高体循环中的GLP-1 含量,从而控制血糖。GLP-1 控制血糖的机理是通过作用GLP-1R 实现的,在胰岛β 细胞中[21],GLP-1 通过与GLP-1R 结合,使细胞膜去极化,并最终导致细胞内Ca2+水平升高和细胞内胰岛素释放,具体机理如图3 所示。GLP-1 在与GLP-1R 结合后会激活腺苷酸环化酶(AC),激活后的AC 会刺激ATP向环磷酸腺苷(cAMP)转化,从而提高cAMP 浓度,cAMP 进一步激活蛋白激酶A(PKA)和鸟嘌呤核苷酸交换因子(Epac2)。激活后的PKA 一方面可以关闭ATP 依赖的K+通道,使细胞膜去极化,另一方面,可以激活电压依赖的Ca2+通道,使Ca2+内流并产生动作电位[22],此外,PKA 还可以通过激活三磷酸肌醇(IP3)促进Ca2+释放。而激活后的Epac2 可以进一步激活Ras 蛋白1(Rap1)和磷脂酶C(PLC),从而激活IP3 和二酰甘油(DAG)途径,促进Ca2+释放[23]。所有这些途径都会导致细胞内Ca2+浓度增加,从而促进线粒体合成ATP,使胰岛素颗粒可以通过胞吐的形式释放到血液中。值得注意的是,GLP-1 的促胰岛素分泌作用具有血糖依赖性,如图,葡萄糖也会关闭 ATP 依赖的K+通道,使细胞膜去极化,激活 Ca2+通道,导致Ca2+浓度升高,从而促进胰岛素颗粒胞吐释放。研究表明,当葡萄糖或GLP-1 单独作用时都不能影响膜电位变化及细胞内Ca2+浓度,只有二者同时存在,才有激活效应。此外,GLP-1 在Ⅱ型糖尿病患者的胰腺中还具有营养作用,可以抑制胰岛β 细胞凋亡,促进胰岛β 细胞增殖。
3 GLP-1 类似物研究现状
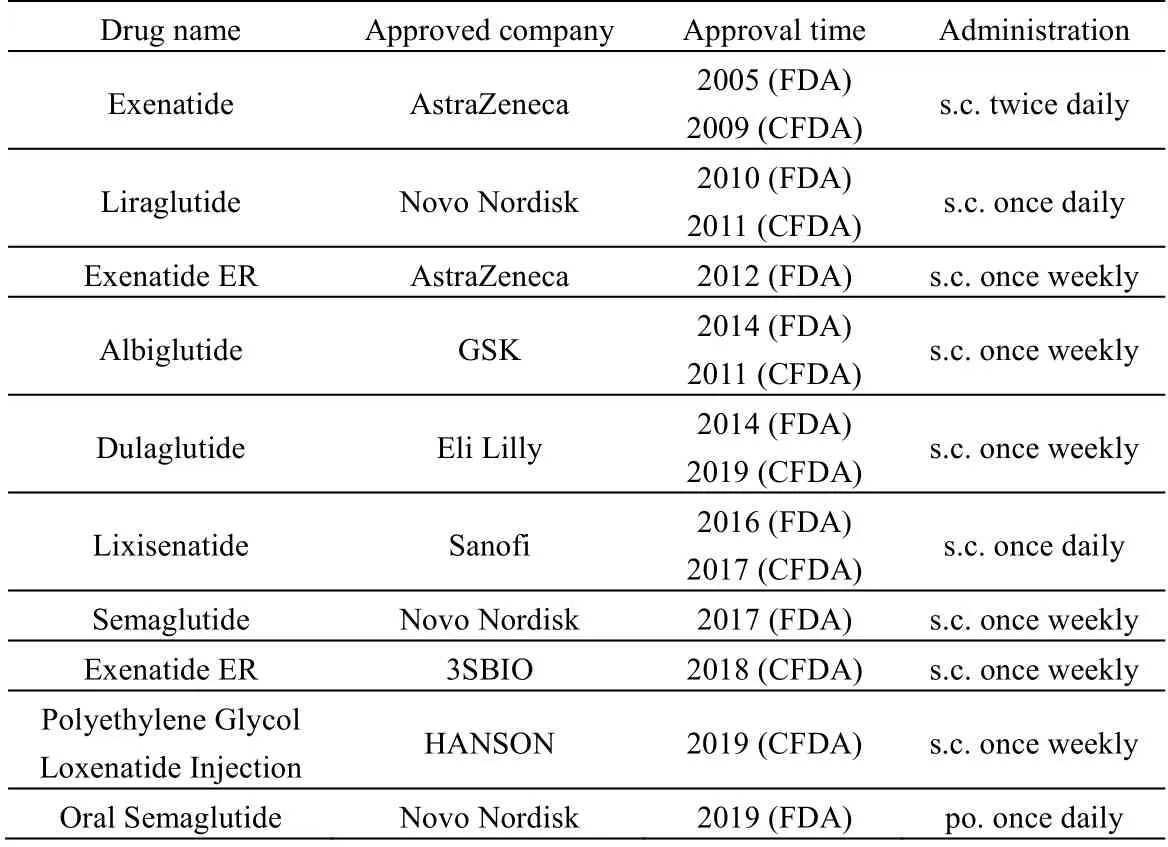
表1 全球已上市的GLP-1 类似物Table 1 GLP-1 analogues available in the market
3.1 已上市GLP-1 类药物开发技术
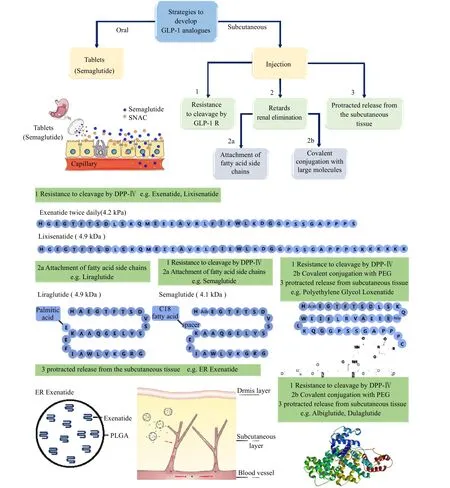
图4 GLP-1 类似物的开发策略Fig.4 Strategies employed for GLP-1 analogue development
已上市GLP-1类药物主要包括贝那鲁肽、艾塞那肽、利拉鲁肽、利西那肽、聚乳酸-羟基乙酸共聚物(PLGA)包载的长效艾塞那肽、阿必鲁肽、杜拉鲁肽、索马鲁肽、聚乙二醇洛赛那肽注射液和口服索马鲁肽[24],如表 1所示。除了口服索马鲁肽是以口服的形式给药,其余都是通过皮下注射给药。皮下注射的GLP-1 类药物,已从一天多次的剂型向长效剂型发展,上述药物前4 种分别为1 天3 次、1 天2 次、1 天 1 次、1 天 1 次剂型,后 5种为周剂型。GLP-1 类药物的开发策略如图4 所示,主要分为3 种:1) 通过改变第8 位氨基酸,从而阻止DPP-IV 的剪切;2) 通过引入脂肪酸链(2a),使脂肪酸与白蛋白结合,从而减缓肾清除,或者通过GLP-1 与白蛋白等大分子融合,或与PEG共价结合(2b),从而减缓肾消除;3) 通过皮下缓释来维持血药浓度。艾塞那肽、利西那肽采用了策略1,利拉鲁肽采用了策略2a,索马鲁肽采用了策略1 和策略2a,聚乳酸-羟基乙酸共聚物包载的长效艾塞那肽采用了策略1 与策略3,聚乙二醇洛赛那肽、阿必鲁肽、杜拉鲁肽采用了策略1, 2b, 3。长效释放的机理主要分为2 类:第1 类是只通过皮下缓释,如聚乳酸-羟基乙酸共聚物微球包载的长效艾塞那肽;第2类是通过皮下缓释,再辅以血液中的长循环机制,如杜拉鲁肽、阿必鲁肽和聚乙二醇修饰洛赛那肽。由于人体对皮下驻留药物存在免疫反应,因此上述长效释放剂型都面临了免疫反应的挑战。
3.2 已上市GLP-1 类药物生产技术
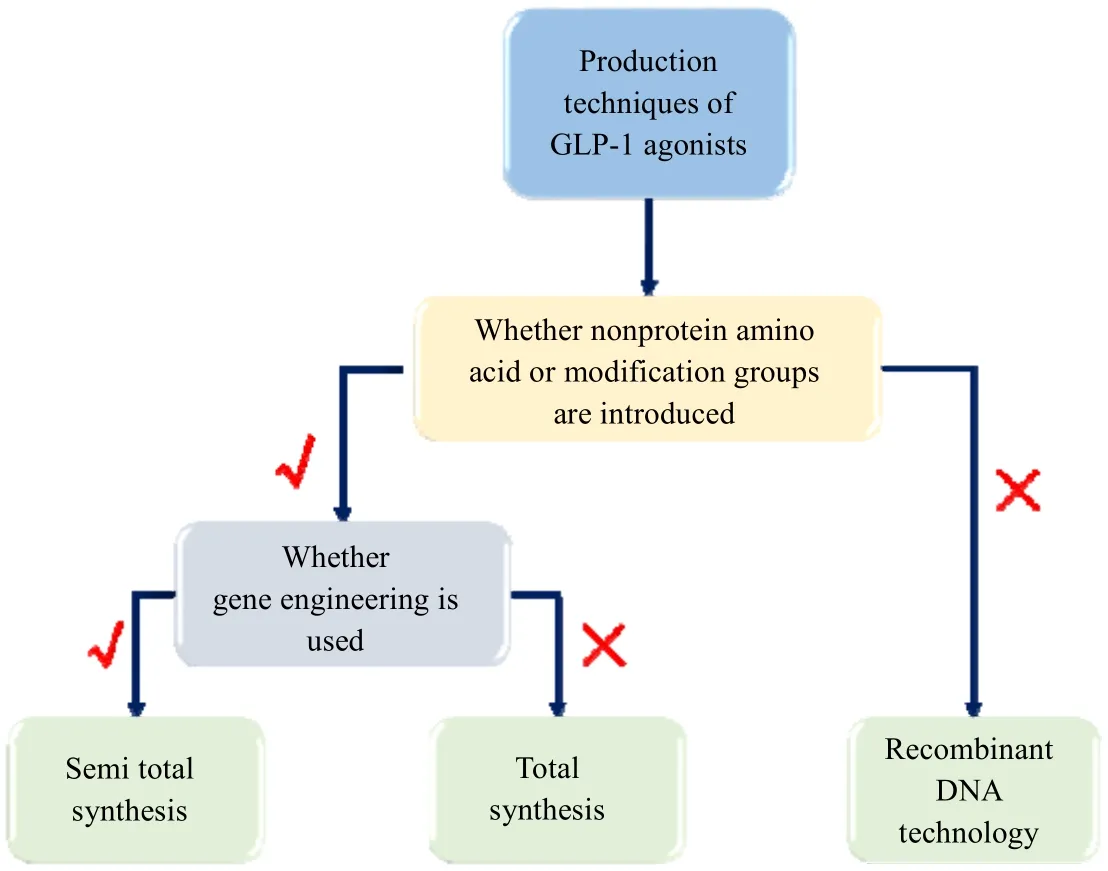
图5 GLP-1 类似物生产技术Fig.5 Production techniques of GLP-1 analogues
GLP-1 长效类似物的生产技术可以分为3 类,如图5 所示,分别是基因重组技术、全合成技术和半合成技术。其中,基因重组技术是通过将重组基因片段导入微生物或动植物等宿主细胞内,表达得到目标多肽的生产技术。现有生产技术中一般用天然氨基酸培养宿主细胞,因此基因重组技术适用于不含有非天然氨基酸或其他修饰基团,且空间构象较为复杂的GLP-1类似物。例如,葛兰素史克的阿必鲁肽和礼来的杜拉鲁肽在原研专利中采用的生产技术都是基因重组技术。基因重组技术虽然前期研发投入成本较高,但后期可以进行大规模生产,生产成本较化学合成技术低,不足之处在于发酵工艺后的纯化难度较大,得到的产品纯度相对较低,质量控制要求较高。
在生产含有非天然氨基酸或其他修饰结构的GLP-1 类似物时,可以根据获得中间体多肽主链(有效活性成分)的方法进行分类,将生产技术分为全合成技术和半合成技术。全合成技术是通过化学合成方法得到中间体多肽主链,再将得到的多肽主链为原料,进一步化学修饰多肽主链。而半合成技术则是采用基因重组方法得到中间体多肽主链。多肽的化学合成方法主要运用固相合成法,并结合液相合成连接较短的多肽链,提高目标多肽的收率。固相合成技术是一种按照已有氨基酸序列,在高分子树脂上依次将侧链和一端带有保护基团的氨基酸循环缩合和脱端基保护的合成技术,简化了分离过程,并结合液相色谱分离技术,可以得到纯度相对较高的产品,不足之处在于相对基因重组技术其生产成本较高。如图4 所示,索马鲁肽的8 位氨基酸为2-氨基异丁酸(Aib),聚乙二醇洛赛那肽第8 位为D-丙氨酸(D-Ala),都属于非天然氨基酸,因此,索马鲁肽和聚乙二醇洛赛那肽的多肽主链在生产时,一般只采用固相合成技术。不同于索马鲁肽和聚乙二醇洛赛那肽的多肽主链,利拉鲁肽主链由于不含非天然氨基酸,既可以采用基因重组技术,又可以采用固相合成技术得到。在利拉鲁肽的原研专利中,诺和诺德采用的是半发酵半合成技术,通过酵母表达得到利拉鲁肽主链,再通过化学修饰得到利拉鲁肽。在国内,除了九源基因申请的专利中采用半合成技术(通过大肠杆菌表达得到利拉鲁肽主链),其他利拉鲁肽仿制药的专利中多数采用全合成法。一方面,半合成技术相对于全合成技术,发酵工艺后的纯化难度大,保持一致性比较困难,另一方面,由于国家食品药品监督管理局不同审批途径的要求不同,采用全合成技术生产利拉鲁肽可以按照6 类化学药进行申报,审批通过后只需要给出生物等效性相关数据,不需要进行临床试验,而采用半合成技术生产利拉鲁肽需要按照10 类生物药进行申报。因此,临床试验、生产审批所需的时间、金钱成本都远远大于6 类化学药的申报。
为了保留原有中间体多肽主链的生物活性,进一步的化学修饰往往在特定位点氨基酸的侧链进行烷基化或PEG 化。利拉鲁肽、索马鲁肽,采用酰化反应在26 位赖氨酸残基上接上谷氨酸介导的十六碳酸或十八碳酸;聚乙二醇洛赛那肽,采用巯基与双键的点击反应在C 端半胱氨酸残基上接上带有双键官能团的聚乙二醇。
3.2.1 艾塞那肽
艾塞那肽的结构和Gila 毒蜥唾液中天然肽Exendin-4 的结构一样,如图4 所示。但与天然GLP-1 只有50%的同源性,采用了图4 中的策略1,将8 位氨基酸改成了Gly,从而阻断了DPP-IV 的酶切位点。其采用固相合成多肽技术得到。血浆半衰期约为2~4 h[25-26],在皮下给药后迅速吸收,并在被DPP- IV 水解降解后通过肾脏消除[27]。它在早餐和晚餐前60 min 服用,主要作用是减少餐后血浆葡萄糖(PPG)[28]。艾塞那肽可使糖化血红蛋白(HbA1c)长期维持在正常值,逐步减轻体重。同时,在服用该药物长达3~4 a的患者中,血脂状况得到改善[29]。
艾塞那肽最常见的不良反应是恶心和呕吐。40%~60% 的临床患者中检验出了抗艾塞那肽抗体。在联用艾塞那肽和胰岛素时会发生低血糖事件[30]。
3.2.2 利拉鲁肽
利拉鲁肽与天然 GLP-1 有 97% 的同源性,采用了图4 中的策略2a,34 位氨基酸被Arg 取代,26位引入了一个 Glu 介导的棕榈酸[31],该棕榈酸可以与血浆中的白蛋白可逆性结合,从而减缓肾消除[32]。利拉鲁肽的生产技术主要有半发酵半合成技术和全合成技术,其中,原研专利中诺和诺德采用的是半发酵半合成技术,而其仿制药的专利中多数采用全合成法。利拉鲁肽半衰期11~13 h,在皮下给药后,经肾途径清除。临床上用于血糖与体重的控制。利拉鲁肽与传统降糖药物格列美脲的降糖效果相似[33]。
由于利拉鲁肽与天然GLP-1 具有97% 的同源性,因此在3 期临床研究中检验出抗体的发生率相对较低,10% 以下的个体中检测到抗体水平升高[34]。不良反应包括恶心和呕吐,T2DM 患者体重过度下降及与传统降糖药物联用时的低血糖事件。
3.2.3 长效艾塞那肽
长效艾塞那肽是艾塞那肽的一种缓释制剂,它采用了图4 中的策略3,通过复乳溶剂挥发法(W/O/W)或凝聚法(W/O/O)制备聚乳酸-羟基乙酸共聚物微球包载的艾塞那肽。该微球通过扩散和降解,释放出药物[35],从而实现长时间缓慢而稳定的血药浓度。长效艾塞那肽每周注射一次,微球载体最终降解产物为乳酸和乙醇酸,并以二氧化碳和水的形式消除[36]。艾塞那肽在改善HbA1c 和减轻体重方面,优于传统降糖药物西他列汀和吡格列酮[37]。长效艾塞那肽(每周2 mg)和利拉鲁肽(1.8 mg⋅d-1)的临床对比结果显示,利拉鲁肽表现优于长效艾塞那肽,表现为 HbA1c,体重和空腹血浆葡萄糖(FPG)降低更多[38]。长效艾塞那肽和艾塞那肽的临床对比结果显示,长效艾塞那肽在HbA1c,FPG 和体重等方面都优于艾塞那肽[39]。
长效艾塞那肽最常见的不良反应除恶心呕吐之外,还有注射部位较强的免疫原性反应[40],这主要是聚乳酸-羟基乙酸共聚物的排异导致的结果。
3.2.4 阿必鲁肽
阿必鲁肽采用了图4 中的策略1 将8 位氨基酸改成了 Gly,阻止 DPP-IV 剪切,并采用策略2b 将GLP-1 与白蛋白融合,减缓肾消除,结构如图6 所示。阿必鲁肽是将活性多肽与人血清白蛋白融合得到。阿必鲁肽每周注射1 次,在利拉鲁肽(1.8 mg)和阿必鲁肽(50 mg)的临床试验中,利拉鲁肽对降低HbA1c 更具优势,但更容易减轻患者的体重[41]。
阿必鲁肽具有较少的低血糖事件和适度的体重减少,但是基于融合蛋白技术的阿必鲁肽因其具有一定功能的蛋白质结构域,从而出现了较多的抗体。
3.2.5 杜拉鲁肽
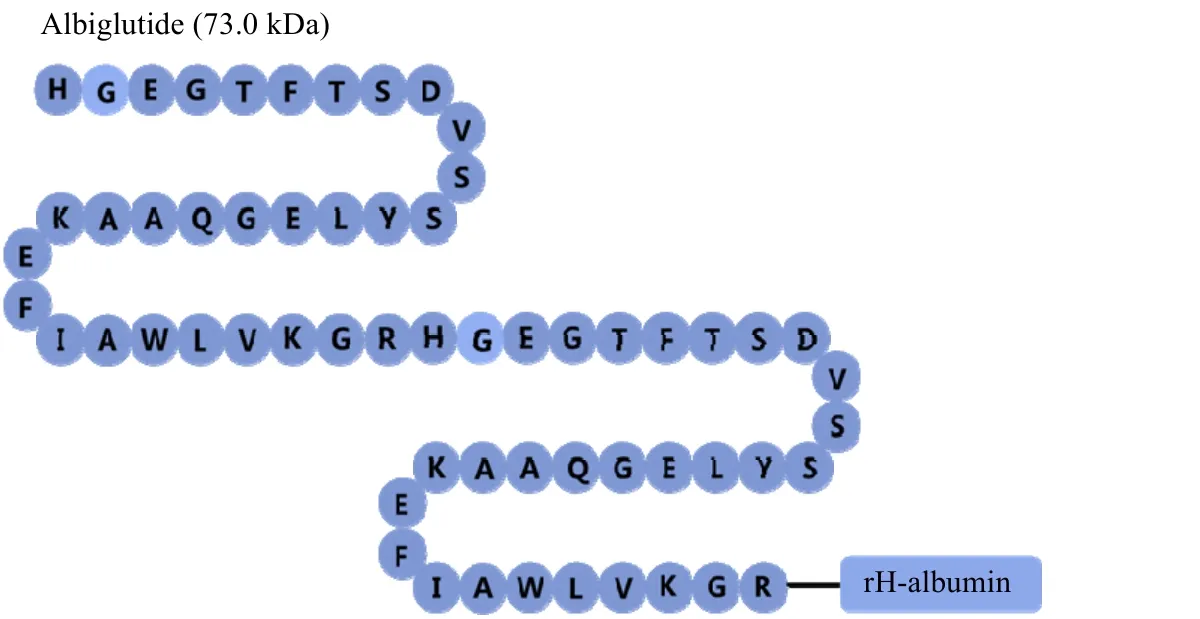
图6 阿必鲁肽结构示意图Fig.6 Schematic diagram of albiglutide structure Dulaglutide (59.7 kPa)
杜拉鲁肽与天然 GLP-1 具有 90%的同源性,结构如图7 所示,它与阿必鲁肽一样,都将8 位氨基酸改成了Gly,防止DPP-IV 酶降解,不同的是通过共价键将 GLP-1 与IgG4-Fc 链接,减少肾清除延长循环时间[42-43]。杜拉鲁肽是将活性多肽与人免疫球蛋白 Fc 片段融合得到的。杜拉鲁肽每周注射 1 次,在利拉鲁肽(1.8 mg⋅d-1)和杜拉鲁肽(每周1.5 mg)的临床试验中,杜拉鲁肽降低HbA1c 的效果不逊于利拉鲁肽,且可以避免体重的大幅减少[44-45]。
杜拉鲁肽最常见的副作用是恶心、呕吐和腹泻。它和阿必鲁肽一样,发生低血糖事件的概率较低,未出现体重的大幅下降,同样,因为具有一定功能的蛋白质结构域,导致体内出现了较多的抗体。
3.2.6 利西那肽
利西那肽是一种具有45 个氨基酸的肽,修饰策略和艾塞那肽类似,采用图4 中的策略1,将8 位氨基酸改成了Gly,从而阻断了DPP-IV 的酶切位点,并在45 位后添加了6 个Lys[46-47]。其每天注射1 次。由于肾脏是消除利西那肽的主要途径,对于轻度或中度肾功能不全的患者无需调整剂量,严重肾功能不全的患者应禁止使用。利西那肽会延迟胃排空,从而降低口服药物的吸收率。
与艾塞那肽相比,利西那肽总体耐受性良好,低血糖发生率低,注射部位免疫反应低,恶心、呕吐等副作用小[48-49]。
3.2.7 索马鲁肽
索马鲁肽和利拉鲁肽的修饰原理相同,采用图4 中的策略1,将其8 位氨基酸改为Aib,34 位氨基酸改为Arg,26 位引入了一个18C 脂肪酸,使其可以与血浆中的白蛋白可逆性结合,从而减缓肾消除。索马鲁肽的制备方法和利拉鲁肽类似,包括半发酵半合成法和全合成法。其半衰期长达47 h。临床用于治疗Ⅱ型糖尿病和肥胖症。每周1 次皮下注射索马鲁肽的降糖效果优于优于西他列汀[50]。
观察到的不良反应多数是胃肠道副作用[51]。肾病恶化的情况降低,但视网膜病并发症(包括失明、玻璃体出血和光凝)相对增加。
3.2.8 聚乙二醇洛赛那肽注射液
聚乙二醇洛赛那肽采用图4 中策略1 将其第8 位改成了D-Ala,从而减轻DPP-IV 的降解。并通过图4中的策略 2b,采用聚乙二醇化技术,利用了聚乙二醇的抗蛋白质非特异性吸附能力和较大的水动半径,减缓肾消除延长血液循环时间。聚乙二醇洛赛那肽采用全合成法得到。聚乙二醇洛赛那肽注射液每周注射1 次,用于成人Ⅱ型糖尿病患者的血糖控制。 但由于体内广泛存在抗PEG 抗体以及PEG 补体激活现象,因此聚乙二醇洛赛那肽限制了适用人群[52]。
3.2.9 口服索马鲁肽
口服索马鲁肽是第一个上市的口服GLP-1 受体激动剂[53-55]。口服索马鲁肽是通过SNAC 技术实现的(SNAC,即N-(8-(2-羟基苯甲酰基)氨基)辛酸钠),如图4 所示。SNAC 技术可防止胃里的索马鲁肽被破坏,并通过胃膜促进细胞吸收,使索马鲁肽能够完整到达体循环。口服索马鲁肽虽然加强了患者的顺应性,但生物利用度远远低于皮下注射索马鲁肽的生物利用度。
3.3 临床试验中的GLP-1 类药物
处于临床试验中的GLP-1 类药物也都采用图4 中提到的3 种策略进行修饰。
3.3.1 依普列那肽
依普列那肽是在研的处于临床III 期GLP-1 类药物。其设计原理与杜拉鲁肽相似,如图4 中的策略1,2b,3。结构如图8 所示,采用柔性接头将CA-exendin-4 与IgG4-Fc 片段缀合,以减缓肾消除,将药物的半衰期从1 周延长至1 月。与杜拉鲁肽不同的是,依普列那肽活性成分CA-exendin-4 是exendin-4 的改进版,CA-exendin-4 在exendin-4 一位组氨酸的氨基上引入了一个4-咪唑乙酰基[56],从而减轻DPP-IV 的降解。依普格列奈在II 期研究中显示出对血糖控制的有益作用,每周4 mg 剂量的HbA1c 降低1.61%,而利拉鲁肽每天1.8 mg 的剂量降低1.38%。持续时间更长的药物不仅可以产生患者依从性,还可以减少各种不良反应,包括注射部位反应、恶心和其他胃肠道副作用,但是尚未发布任何有关免疫原性反应数据的结果。
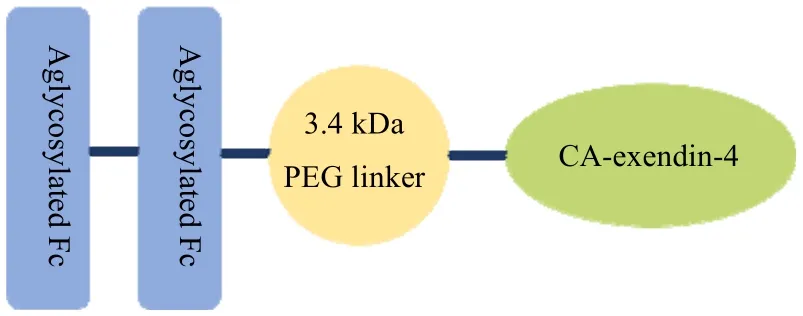
图8 依普列那肽结构示意图Fig.8 Schematic diagram of efpeglenatide structure
3.3.2 ITCA 650
ITCA 650 是一款小型火柴式渗透微型微型泵输送系统,设计原理如图9 所示,本质上与图 4 中的策略 3 相同,利用 Intarcia专有的Medici Drug Delivery System™置于患者腹部区域的皮肤下方,实现长效施用艾塞那肽。该渗透泵通过渗透微管缓慢平稳释放艾塞那肽,将药物半衰期延长至 1 a。Intarcia Therapeutics 于 2019 年 9 月 9 日向FDA 第2 次提交了ITCA 650 的新药申请,用于Ⅱ型糖尿病的治疗[57]。
3.3.3 国内在研的GLP-1 类药物
国内在研的 GLP-1 类药物主要包括昆药集团的苏帕鲁肽、常山生化的 CJC-1134-PC 和贝达药业的BPI-3016,如表2 所示。苏帕鲁肽的结构和度拉鲁肽的设计原理相似,不同之处在于苏帕鲁肽与IgG2 亚型的Fc 进行融合,而度拉鲁肽与优化后的IgG4 亚型的Fc 片段融合。CJC-1134-PC 和阿必鲁肽的设计原理相似,它将Exendin-4 和重组白蛋白融合而成。BPI-3016 的设计原理与利拉鲁肽、索马鲁肽相似,它们都将34 位的赖氨酸改为精氨酸,并在26 位的赖氨酸上接一个脂肪酸,从而能与白蛋白结合减缓肾消除,不同的是,BPI-3016 用含有-CF3-的结构片段替代了His7 和Ala8 之间的肽键,从而阻止DPP-IV 的剪切。
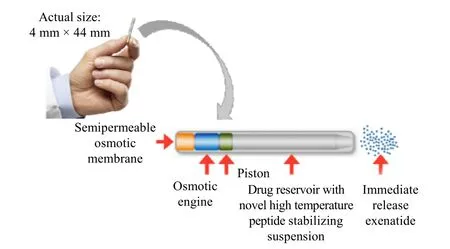
图9 ITCA650(艾塞那肽)作用机理示意图Fig.9 Schematic diagram of ITCA650 (Exenatide) functioning mechanism

表2 在研GLP-1 类似药物Table 2 GLP-1 analogues under development
3.4 未进入临床试验的GLP-1 类似物
未进入临床试验的GLP-1 类似物的研究,主要聚焦于不同生物大分子与GLP-1 的融合及其融合技术的改善[58],基于温敏性水凝胶的GLP-1 类似物输送系统,基于脂质体的GLP-1 类似物输送系统,以及两性离子多肽修饰的GLP-1 类似物的研究。
阿斯利康全球生物制剂研发公司(medImmune ltd)的Meena 等设计了一种抗前蛋白转化酶枯草溶菌素9(PCSK9)单克隆抗体与GLP-1 融合的新型GLP-1 类似物[59],名为MEDI4166,旨在治疗患有心血管疾病风险的T2DM 患者。在评估其有效性的试验中,发现在超重或肥胖的T2DM 患者中,患者的低密度脂蛋白胆固醇水平显著降低,但是具有剂量依赖性,而不同剂量的MEDI4166 对患者餐后血糖水平均没有显著影响。
复旦大学的 Chen 等[60-64]研究了基于温敏性水凝胶的 GLP-1 类似物输送系统。他们设计了PCGA-PEG-PCGA 和PLGA-PEG-PLGA 2 种共聚物,这2 种共聚物都可溶于水,并且都能够在温度诱导下实现溶胶-凝胶的相转变,结果显示负载利拉鲁肽的 PCGA-PEG-PCGA 热凝胶制剂在体外和体内均显示持续1 周以上的药物释放,因此,PCGA-PEG-PCGA 热凝胶有望实现每周1 次的利拉鲁肽输送,从而改善患者的依从性。
加利福尼亚大学的Schneider 等[65-66]设计Tetra-PEG 水凝胶-艾塞那肽缀合物,它在大鼠中提供艾塞那肽的时间长达7 d,随后,他们发现艾塞那肽28 位Asn 在经历脱酰胺后具有体外和体内约2 周的半衰期,因此制备了2 种不同的水凝胶-[Gln28]艾塞那肽缀合物,将提供艾塞那肽的时间延长至2 周~1 个月。
沈阳药科大学的 Zhan 等[67]开发皮下装载利拉鲁肽的多囊脂质体(Lrg-MVLs)作为治疗糖尿病的持续药物输送系统,结果表明Lrg-MVLs 持续降低葡萄糖的效果持续了近1 周。
杜克大学的Samagya 等[68]基于弹性蛋白GLP-1 融合肽进行的研究,他们借助具有弹性蛋白重复序列的多肽在皮下凝胶化和降解控释获得较平稳的血药浓度,作用机理如图 10所示。研究发现两性离子化类弹性蛋白比正常弹性蛋白融合的 GLP-1 对二型糖尿病大鼠血糖控制从2 d 延长到3 d。这显示了两性离子多肽与PEG 一样因其抗蛋白质非特异性吸附能力,增加了药物在体内的存留时间,但可能由于类弹性蛋白结构的干扰,其长效性并不理想。
此外,中国药科大学的Ruan 等[69]在原有的PLGA 缓释微球中,掺入锌离子,有效减少初始突释,并获得了均匀的药物分布。
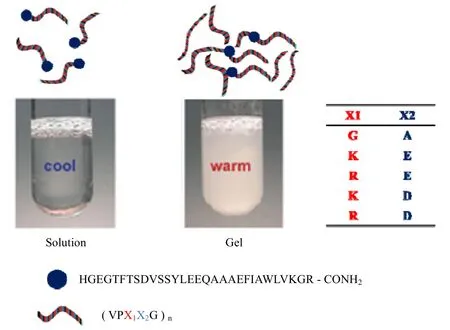
图10 类弹性蛋白GLP-1 融合肽作用机理示意图Fig.10 Schematic diagram of functioning mechanism of GLP1-ZIPP fusions
4 GLP-1 类似物临床应用中存在的问题
GLP-1 类药物在临床应用中的不良反应主要表现为恶心、呕吐等胃肠道反应,而GLP-1 类药物最大耐受剂量往往取决于这些不良反应。一些研究表明,静脉输注天然GLP-1 可使Ⅱ型糖尿病患者的血糖水平趋于正常化。相比之下,在使用长效GLP-1 受体激动剂的患者中,尚未观察到血糖水平完全正常化的现象。因此,如果不减轻恶心、呕吐等不良反应,未来长效GLP-1 受体激动剂将难以实现比现有药物更优秀的血糖控制效果。
与此同时,聚乙二醇洛赛那肽、阿必鲁肽、杜拉鲁肽类药物还会给Ⅱ型糖尿病患者带来肾损伤甚至肾衰竭等问题,最近研究表明,杜拉鲁肽会造成患者肾功能恶化,而利拉鲁肽可降低高危患者发生糖尿病肾病的概率[70-71]。因此,通过图4 中策略2b 改进后得到的该类药物不可用于严重的肾功能损害患者,肾功能不全者应谨慎使用该类药物。
虽然GLP-1 类药物对胰岛素和胰高血糖素分泌的影响存在葡萄糖依赖性,但是GLP-1 类药物在和一些传统降糖药物联合使用时,低血糖事件也是潜在的用药安全问题。
最后,GLP-1 类药物还面临着免疫反应的挑战,长期多次注射或通过图4 中策略3 改进后的药物在皮下滞留时间过长这两点都会引起免疫反应。例如,聚乳酸-羟基乙酸共聚物微球包载艾塞那肽因聚乳酸-羟基乙酸共聚物的异体排斥导致了注射部位较高的免疫反应,基于融合蛋白技术的杜拉鲁肽和阿必鲁肽因具有一定功能的蛋白质结构域的应用出现了较多的抗体,PEG 化洛赛那肽由于体内广泛存在抗PEG 抗体以及PEG 补体激活现象限制了适用人群。
因此,发展高效、低免疫原性、血药浓度平稳、低肠胃不良反应的长效GLP-1 类似物对Ⅱ型糖尿病治疗具有重要意义。
5 展 望
GLP-1 类药物的最大耐受剂量往往取决于其在临床应用中出现的不良反应。不良反应主要表现为恶心、呕吐等胃肠道反应。因此,一方面,可以通过改变分子结构,减小恶心、呕吐等胃肠道反应及其他不良反应从而提高GLP-1 类药物的最大耐受剂量;另一方面,可以通过平稳可控的释药系统,使GLP-1类药物可以在体内以低于耐受量的浓度持续释放。
GLP-1 类药物在与传统降糖药物联用时,常常会引发低血糖事件,因此如何降低低血糖事件发生的概率,是GLP-1 类药物在与其他传统降糖药物联用时需要特别关注的一点。
此外,GLP-1 类药物在使用时,需要频繁使用针头进行皮下给药,以及药物在皮下的滞留,都将引起注射部位的免疫反应。因此,未来GLP-1 类药物不仅需要进一步延长药物作用时间,以减少给药次数,还需要研发一些具有良好生物相容性和可降解性的,无免疫原性的修饰材料,以解决药物皮下滞留带来的免疫原性的问题。
再从GLP-1 类药物的临床应用来看,现阶段GLP-1 类药物仅用于T2DM 和肥胖症的治疗,相信未来GLP-1 类药物还可以开发出更多的临床应用场景。
