海水酸化和碱化对斑点海链藻光合生理特性的影响
2021-01-15范佳乐李富田徐军田
范佳乐,李富田,徐军田,2,3*
( 1. 江苏海洋大学 江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;2. 江苏海洋大学 江苏省海洋生物技术产业协同创新中心,江苏 连云港 222005;3. 江苏海洋大学 江苏省海洋生物技术重点实验室,江苏 连云港 222005)
1 引言
硅藻分布广泛,在碳的生物地球化学循环中起到不可替代的作用,其贡献约20%的全球初级生产力和40%的海洋初级生产力[1]。在近海水域,硅藻作为初级生产者,构成海洋食物网的基础,支持着沿岸渔业;而在大洋水域,从表层沉降下来的硅藻有机体是深海生物的重要食物来源[2]。
在过去的几十年间,大气CO2浓度从工业革命前的280×10−6升高到了现在的400 ×10−6[3]。作为主要的温室气体,大气CO2浓度的升高导致全球变暖。与此同时,海水吸收了人类排放CO2的30%左右,这在一定程度上缓解了全球变暖的趋势,但也导致了海水pH 下降,即海洋酸化。大气CO2的溶入会引起海水碳酸盐系统发生一系列变化:碳酸根离子( CO23−)浓度大幅下降,碳酸氢根离子( HCO−3)浓度略有升高,而溶解的CO2和氢离子(H+)浓度显著增加[4]。研究还表明,大气CO2的溶入会导致海水缓冲能力的降低,这意味着生物代谢活动对海水碳酸盐系统的改变会在一定程度上加剧[5]。
在近海水域,海水碳酸盐系统受诸多因素影响,呈现季节性甚至昼夜动态变化的特点。生物代谢是影响近海水域pH/pCO2的重要因素之一[6]。全球气候变化和人为因素的共同作用导致近海富营养化程度加大,这将加剧沿岸海域浮游植物的暴发性增长[7],使海−气界面的气体交换速度低于水体内的无机碳消耗速度,最终将抑制浮游植物的生长[8]。有研究发现,在封闭的海湾发生藻华时,海水pH 会达到10,而pCO2会降至50 μatm 以下[9–12]。因此,近海水域的浮游植物不仅会面临海洋酸化的影响,海水碱化也是一个不可忽略的因素。
在表层海水中,与 HCO−3相比,溶解性CO2浓度相对较低,在当前海水平均pH(约8.8)条件下,CO2占溶解性无机碳(Dissolved Inorganic Carbon, DIC)的比例不到1%。而CO2是光合作用关键酶1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)所催化的羧化反应的唯一底物。硅藻Rubisco 的CO2半饱和常数(Km)为20~60 μmol/L,高于当前海洋中溶解CO2浓度[13]。为避免细胞受到碳限制,硅藻进化出了CO2浓缩机制(CO2Concenteating Mechanism, CCM)以提高Rubisco 周围的CO2浓度,削弱光呼吸,提高光合固碳效率[14]。不同硅藻的CCM 差异显著,虽然大部分硅藻都可以利用CO2和H CO−3,但是两者利用的优先性及比例不同[15]。研究发现,在当前海水pCO2水平下,威氏海链藻(Thalassiosira weissflogir)对CO2和 HCO−3的吸收速率相同,三角褐指藻(Phaeodactylum tricornutum)优先吸收 HCO−3[16],而中肋骨条藻(Skeletonema Costatum)则优先利用CO2[17]。也有一些硅藻只能利用CO2,如斑点海链藻[18]。因此,对于硅藻而言,能吸收利用 HCO−3的物种比那些依赖于CO2作为唯一碳源的种类来说具有更大的竞争优势。
pCO2升高和海水酸化对硅藻的影响,在生物碳泵和硅的生物地球化学循环中起着至关重要的作用,引起科学界的广泛关注。研究发现,pCO2升高会下调硅藻的CCM[19],CCM 的下调所节省的能量可以用于促进光合作用与生长[20]。同时,pCO2升高,海水酸性的增加,会导致细胞内pH 降低,从而增加维持胞内pH 平衡的能量投入[21]。海水酸化也有可能会导致藻类生理调节机制发生变化(如电子传递、营养代谢、酶活等),引起负面效应[22]。因此,海水酸化对硅藻的影响取决于CO2浓度升高和pH 下降的正负效应的平衡。
pCO2降低和海水碱化会引起硅藻细胞碳酸酐酶活性的升高[23],导致细胞消耗大量能量去维持碳酸酐酶的运转,从而没有足够的能量去维持较高的生长速率。低pCO2水平也有可能导致硅藻合成碳骨架能力的降低[23]。前期研究表明硅藻的生长可能受到低pCO2水平的抑制或者不受pCO2水平变化的影响[11,24–25],而也有研究发现表明低pCO2甚至可以促进菱形藻的生长,这可能是因为低pCO2条件下,菱形藻进行光合作用所利用 HCO−3的比例升高[26]。另外,胞外pH 升高可能导致细胞膜转运H+的过程发生改变并消耗能量,或导致细胞氨基酸含量降低以及有机物质泄露[27],从而影响细胞生长[28]。同时,还有研究发现较高的海水pH 可能会推动群落演替,受高pH 影响较小的物种如三角褐指藻将占优势地位[29]。pH 变化还会影响硅藻细胞的细胞毒性,研究发现,拟菱形藻(Pseudonitzschia)的细胞毒性在高pH 条件下比酸化条件下高70 倍[30]。这些研究结果各不相同的原因可能是探究的pCO2水平不同或者是种间差异,也有可能是实验中不同的碳酸盐系统调控手段造成的。
尽管关于pCO2变化对浮游植物群落的生态效应已经有了大量的认识,但是在之前的研究中通常只设置1~2 个pCO2水平,而且大多聚焦于pCO2升高导致的效应,忽略了pCO2降低的影响。在本实验中,我们 在7 个pCO2水 平( 25 μatm、 50 μatm、 100 μatm、200 μatm、400 μatm、800 μatm、1 600 μatm)下培养斑点海链藻,研究海水酸化和碱化对其光合生理特性的影响,因为这种藻只利用海水中的CO2[18],所以实验能够更好地反映pCO2变动导致的生理学效应,为预测近岸海水碳酸盐系统变化对初级生产力的影响提供一定的数据支持。
2 材料与方法
2.1 培养条件
本实验选取斑点海链藻(Thalassiosira punctigera)(CCAP 1085/19)为研究对象。培养条件设置温度为20°C、光暗比12 h∶12 h、光强以光量子计为150 μmol /(m2·s)。实验所用海水为高温灭菌的人工海水[31],营养盐按f/2 培养基配方[32]进行加富。通过向未加DIC 的人工海水中加入不同量的NaHCO3将海水调成不同DIC浓度(见2.2 节)。将藻细胞培养在500 mL 的聚碳酸酯瓶(Nalgene,Thermo Scientific)中,采用半连续培养的方式,每48 h 稀释1 次,培养过程中将藻细胞浓度控制在1 500 cell/mL 以下,以减小细胞代谢对海水碳酸盐系统的影响。
2.2 实验设置
本实验设置7 个pCO2梯度,分别为25 μatm、50 μatm、100 μatm、200 μatm、400 μatm、800 μatm、1 600 μatm,藻细胞在7 个pCO2水平处理下适应10~15 代后测定其生理生化参数。在本实验中,在密闭条件下,通过向无碳人工海水中加入经细菌过滤头(孔径:0.22 μm,Millipore Express)过滤灭菌的NaHCO3(CNaHCO3= 1 mol/L)使海水达到实验设置的pCO2水平。加入NaHCO3的体积可以通过以下公式计算:
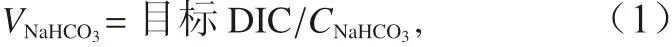
式中,目标DIC 根据实验pCO2水平和总碱度(Total Alkalinity, TA)(TA 设 置 为2 300 μmol/kg)通 过CO2SYS 软件计算得到。最后在密闭条件下加入HCl 或NaOH 将海水pH 调至CO2SYS 软件计算得到的pH,pH 使 用3 点 校 准 的pH 计(FE20, Mettler Toledo)测定。每个处理3 个重复。
2.3 海水碳酸盐系统参数测定
培养48 h 后,取100 mL 藻液,用细菌过滤头(孔径:0.22 μm,Millipore Express)过滤样品后测定总碱度,总碱度根据Gran 滴定法测定[33]。根据TA 和pH使用CO2SYS 软件计算海水中的其他海水碳酸盐系统参数。
2.4 生长速率、细胞体积和表面积测定
生长速率根据48 h 内细胞浓度变化计算得到的日相对生长速率,生长速率(μ,单位:d-1)用以下公式计算:
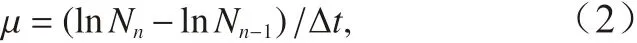
式中,Nn和Nn−1分别 代表 第n次稀 释前和第n– 1 次稀释后的细胞浓度;∆t表示相邻2 次稀释之间的时间间隔。
在本实验中,通过显微镜和Toupview 软件测量细胞的底面直径(l)和高(h)。斑点海链藻的体积以及表面积使用圆柱体体积(V)和表面积(SA)公式计算[34]:
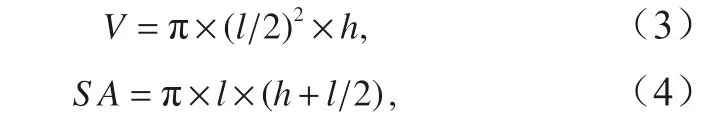
再根据V和SA的比值计算细胞比表面积V∶SA。
2.5 叶绿素a 含量和生物硅含量测定
取100 mL 藻液抽滤到GF/F 膜(直径25 mm,Whatman)上,加入5 mL 无水甲醇提取叶绿素a,放在4°C 的冰箱中,避光过夜。测定叶绿素a含量时,将甲醇提取液放在高速冷冻离心机中离心(5 000 g,10 min),取出上清液测定。叶绿素a的测定使用紫外−可见光分光光度计(Lamda35,Perkin Elmer),测定632 nm、665 nm、750 nm 3 个波长的吸光度,叶绿素a(Chla)的浓度使用Ritchie[35]的公式计算:
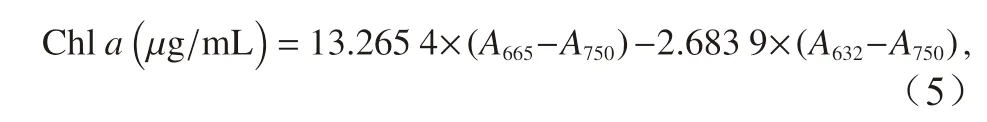
式中,A632、A665和A750分别表示样品在对应波长下的吸光度,公式计算所得结果再根据藻细胞浓度和藻液体积计算为单位细胞的叶绿素a浓度。
生物硅(BSi)测定时,取100 mL 的藻液,将其抽滤到混合纤维膜上,80°C 条件下烘干24 h。BSi 的测定使用Brzezinski 和Nelson[36]的钼酸盐显色法,用浓度为0.2 mol/L 的NaOH 处理样品40 min,然后加入浓度为1 mol/L HCl 中和。再加入钼酸铵和还原剂反应后,使用分光光度计测定样品在波长为810 nm 处的吸光度,通过标准品梯度稀释建立标准曲线,计算样品中BSi 含量,再根据藻细胞浓度和藻液体积计算得到单位细胞的BSi 含量。
2.6 叶绿素荧光参数测定
使用AquaPen-C(AP-C100,Photon Systems Instruments)叶绿素荧光仪测定叶绿素荧光参数。测定前,将藻液浓缩到一定体积(细胞浓度约为10 000~20 000 cell/mL),暗适应15 min 后,测定其光系统II 的最大量子产量(Fv/Fm)。然后测定其快速光响应曲线(RLCs),响应曲线中光强设置7 个梯度,光量子数分别为:10 μmol/(m2·s)、20 μmol/(m2·s)、50 μmol/(m2·s)、100 μmol/(m2·s)、300 μmol/(m2·s)、500 μmol/(m2·s)和1 000 μmol/(m2·s)。快速光响应曲线中相对电子传递速率(rETR)用下式[37]计算:
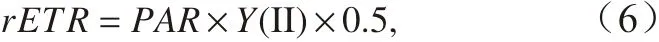
式中,PAR表示光化光强度;Y(Ⅱ)表示光系统II 的有效光化学量子产量。快速光响应曲线用下式进行拟合:
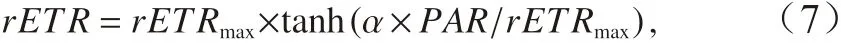
公式拟合得到的参数有最大相对电子传递速率(rETRmax)、表观光能利用效率(α)以及饱和光强(Ik),Ik可以用如下公式[38]计算:

2.7 光合作用和呼吸作用测定
光合作用速率和呼吸作用速率使用液相氧电极(Oxygraph+, Hansatech)进行测定。测定时使用低温恒温水浴槽(DHX-2005,南京先欧仪器制造有限公司)将氧电极反应槽水温控制在20°C。测定光合放氧速率时光强设置为150 μmol photons/(m2·s)(与培养条件相同),光源为卤素灯,在黑暗条件下测定呼吸作用速率。将藻液添加到反应槽中,通过记录反应槽中氧气增加的速率和降低的速率来计算光合作用和呼吸作用速率。光合作用速率(Pn)和呼吸作用速率(Rd)使用以下公式计算:
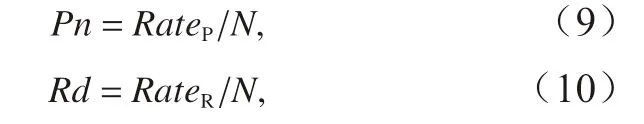
式中,RateP和RateR分别表示记录的放氧速率和耗氧速率;N表示测定时反应槽内细胞浓度。
2.8 数据处理
所有数据都用(平均值±标准偏差)表示。不同处理之间的显著性差异用one-way ANOVA 分析,显著性水平设置为0.05。数据的处理和分析使用软件Origin 9.0 和SPSS 18 软件。
3 结果
不同pCO2水平的海水,随着pCO2水平的升高,海水总碱度没有变化,pH 从(9.01 ± 0.01)降至(7.63 ±0.01),DIC、 HCO−3和CO2(aq) 浓度逐渐升高(表1)。

表1 不同pCO2 水平的海水的碳酸盐系统参数Table 1 Carbonate chemistry parameters of different pCO2 levels
斑点海链藻的生长速率随pCO2水平的升高呈现先升高后降低的趋势(图1),在pCO2400 μatm 水平下,细 胞 生 长 速 率 达 到 最 大,为(0.54 ± 0.05) d−1,25 μatm 处理下,细胞生长速率最低,为(0.10 ± 0.04 )d−1,相比于400 μatm 处理下的藻细胞,生长速率降低了81%(p< 0.01)。pCO2水平为800 μatm 和1 600 μatm处 理下的细胞 生 长 速 率分别为(0.45 ± 0.20) d−1和(0.37 ± 0.05) d−1,与400 μatm 处理下的生长速率相比,分别下降了17%(p< 0.01)和32%(p< 0.01)。
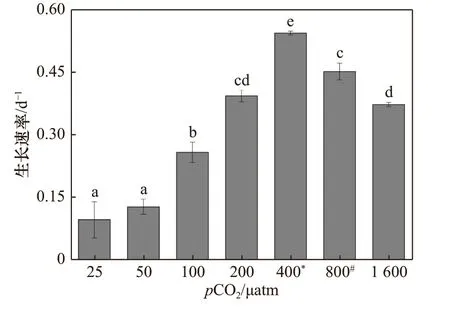
图1 斑点海链藻在不同pCO2 水平下的生长速率Fig. 1 Specific growth rates of T. punctigera at different pCO2 levels
不同pCO2水平处理的斑点海链藻细胞体积、表面积和单位表面积的生物硅含量没有明显变化(体积:31 630~37 543 μm3,表面积:6 136~6 979 μm2,单位表面积的生物硅含量:53~81 fmol/μm2),pCO2水平对斑点海链藻细胞比表面积也没有显著影响(表2)。
pCO2水平对斑点海链藻叶绿素a含量的影响与生长速率一致,都是随着pCO2的升高而呈现出先升高后降低的趋势。叶绿素a浓度的最大值也出现在400 μatm 时,为(74.98 ± 7.33)pg/cell(图2)。适应pCO2水平为25 μatm 的斑点海链藻叶绿素a含量在本实验7 个不同pCO2水平处理中最低,为(9.83 ± 8.43)pg/cell,仅为400 μatm 时的13%。当CO2浓度逐渐增高,超过400 μatm 时,叶绿素a含量逐渐降低。适应pCO2水平800 μatm 和1 600 μatm 的斑点海链藻叶绿素a含量,分别为(56.98 ± 4.46)pg/cell 和(48.14 ± 1.01) pg/cell,相比当前pCO2水平(400 μatm)分别降低24%(p= 0.02)和36%(p= 0.01)。
斑点海链藻的Fv/Fm、rETRmax和α在低pCO2水平(25~200 μatm)时随pCO2升高而升高,在400~1 600 μatm处理下没有显著变化(图3A 至图3C)。与400 μatm相比,斑点海链藻的Fv/Fm在25 μatm 和50 μatm 处理下,分别降低了76%(p< 0.01)和29%(p= 0.01),在25 μatm 时 藻 细胞rETRmax相比 于400 μatm 处 理 降低了66%(p< 0.01),而α降低了69%(p= 0.01)。不同pCO2水平下,斑点海链藻的饱和光强没有显著差异(图3D)。
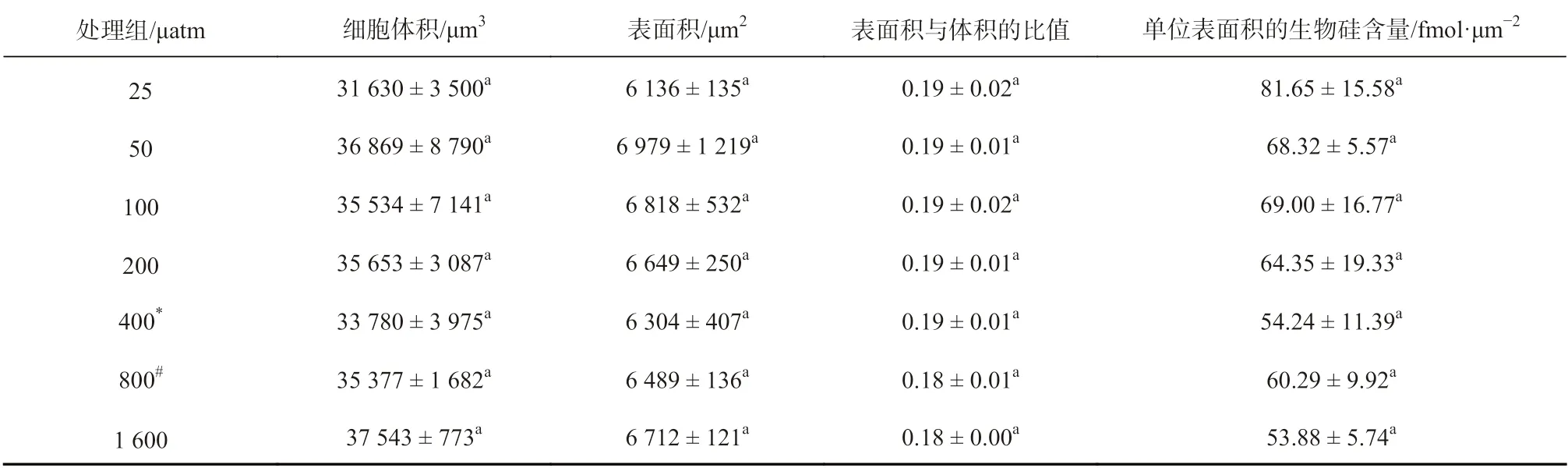
表2 不同pCO2 水平的斑点海链藻的细胞体积、表面积、表面积与体积的比值和单位表面积的生物硅含量Table 2 Cell volume, surface area, surface area-to-cell volume ratio, and BSi content per surface area of T. punctigera cells grown at different pCO2 levels
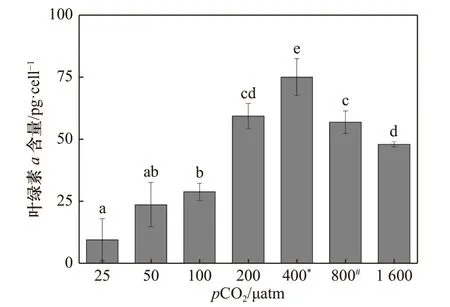
图2 斑点海链藻在不同pCO2 水平的叶绿素a 含量Fig. 2 Chlorophyll a content of T. punctigera at different pCO2 levels
斑点海链藻的光合作用速率随着pCO2的升高也呈现出先升高后降低的趋势。但是在酸化条件下(800 μatm、1 600 μatm),细胞的光合速率相比400 μatm处理没有显著性差异。当pCO2水平从25 μatm 升高到400 μatm 时,斑点海链藻的光合作用速率(以O2计)从(8.32 ± 0.44)pmol/(cell·h)升高到(22.13 ± 5.03)pmol/(cell·h),增幅为166%(p= 0.01)(图4A)。pCO2水平在25~100 μatm 的范围内,呼吸作用速率随着pCO2水平的升高而降低,从(27.54 ± 9.75)pmol/(cell·h)降至(13.54 ± 3.11) pmol/(cell·h);随着pCO2水平的继续升高,呼吸作用速率呈现下降趋势,但在100~1 600 μatm 范围内没有显著性差异(图4B)。
4 讨论
在本实验中,低pCO2水平对斑点海链藻的影响比高pCO2水平的影响更大,即海水碱化比酸化对斑点海链藻的影响更为显著。在低pCO2水平(25~200 μatm)处理下,斑点海链藻的生长速率仅有400 μatm 下生长速率的18%~72%。同时光合作用速率、叶绿素a含量也受低pCO2水平影响较大。在海水酸化条件(800 μatm、1 600 μatm)下,斑点海链藻的生长速率为400 μatm 时的83%和69%,但光合作用没有显著变化,这些结果表明当前海水pCO2水平(400 μatm)比较适合斑点海链藻的生长,400 μatm 可能是海水pCO2升高对斑点海链藻光合生理影响的转折点,海水碱化(25~200 μatm)和海水酸化(800 μatm、1 600 μatm)均会抑制其生理过程,且海水碱化对其影响更显著。
pCO2水平从200 μatm 降低至25 μatm,斑点海链藻的生长速率、叶绿素a含量和光合作用速率逐渐降低,此时溶解的CO2和 HCO−3浓度降低,pH 升高 ,其中,CO2从(6.1 ± 0.1)μmol/kg 降至0.8 μmol/kg,HCO−3从(1 588 ± 35)μmol/kg 降至(827 ± 9) μmol/kg,pHNBS从(8.43 ± 0.01)升至(9.01 ± 0.01)。研究发现,斑点海链藻只能利用CO2[18],在低pCO2水平下,细胞可利用的溶解性CO2较少,而溶解性CO2作为光合作用的直接底物,其浓度在25 μatm 时仅为0.8 μmol/kg,远低于硅 藻Rubisco 的CO2半 饱 和 常 数20~60 μmol/kg[13]。虽然细胞可通过上调CCM 浓缩胞内CO2浓度,但是这一过程需耗费大量能量,因此分配到细胞分裂过程的能量变少。此外,较低的底物浓度会减少细胞的光合固碳量,即细胞分裂的物质基础下降,这可能是低碳处理下细胞生长速率较低的原因。低碳条件下,叶绿素a含量降低会减小光系统的捕光面积,即细胞通过色素所捕获的光能下降[39],这些都反映了斑点海链藻受到了低碳限制。
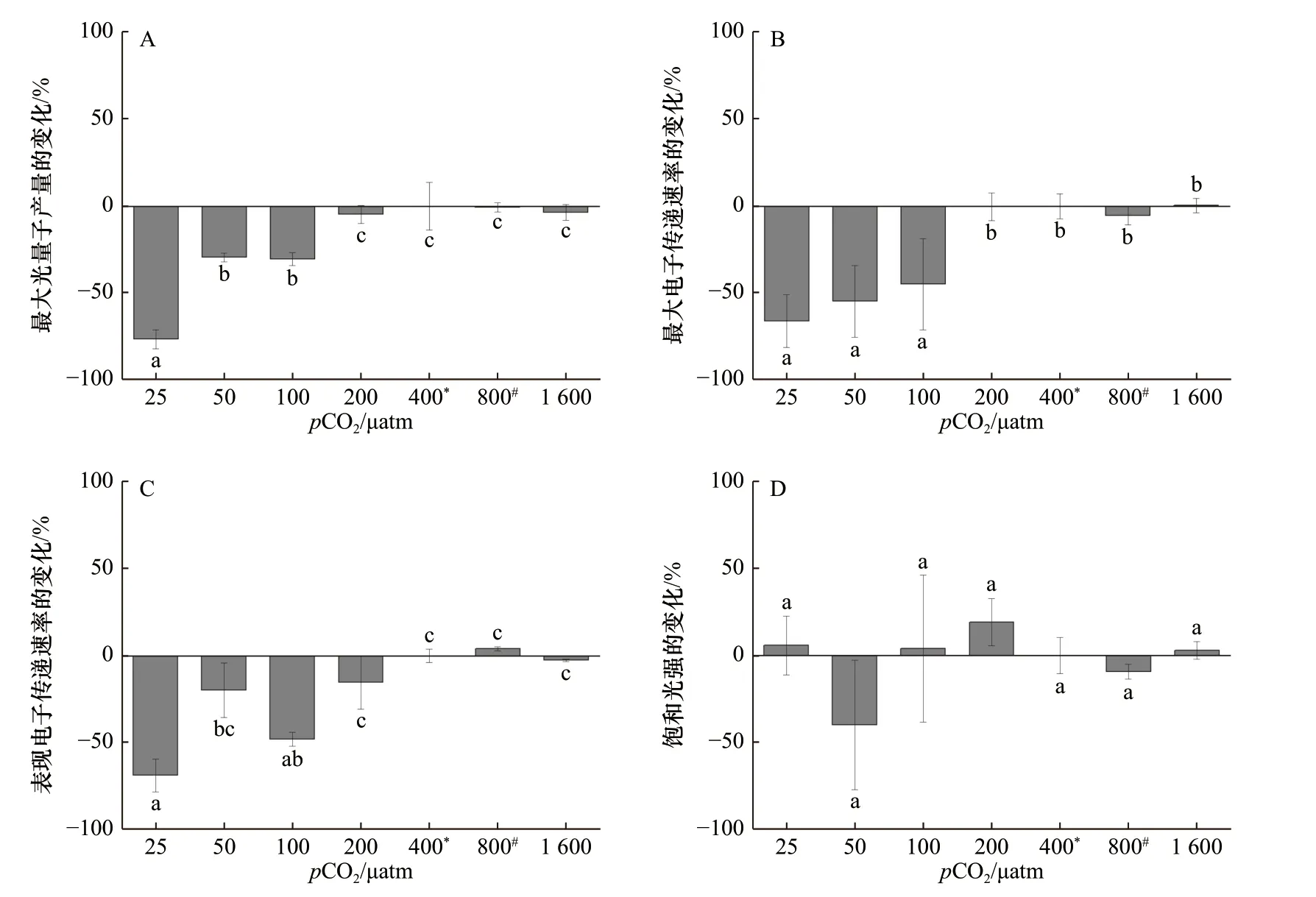
图3 在不同pCO2 水平下生长的斑点海链藻的最大光量子产量(A)、最大电子传递速率(B)、表观电子传递速率(C)和饱和光强(D)相对400 μatm 处理的百分比变化Fig. 3 Percentage changes of maximum photochemical quantum yields (A), relative maximum electron transport rate (B), apparent photon transfer efficiency (C), and light saturation point (D) (%) of T. punctigera cells grown at different pCO2 levels relative to 400 μatm treatment
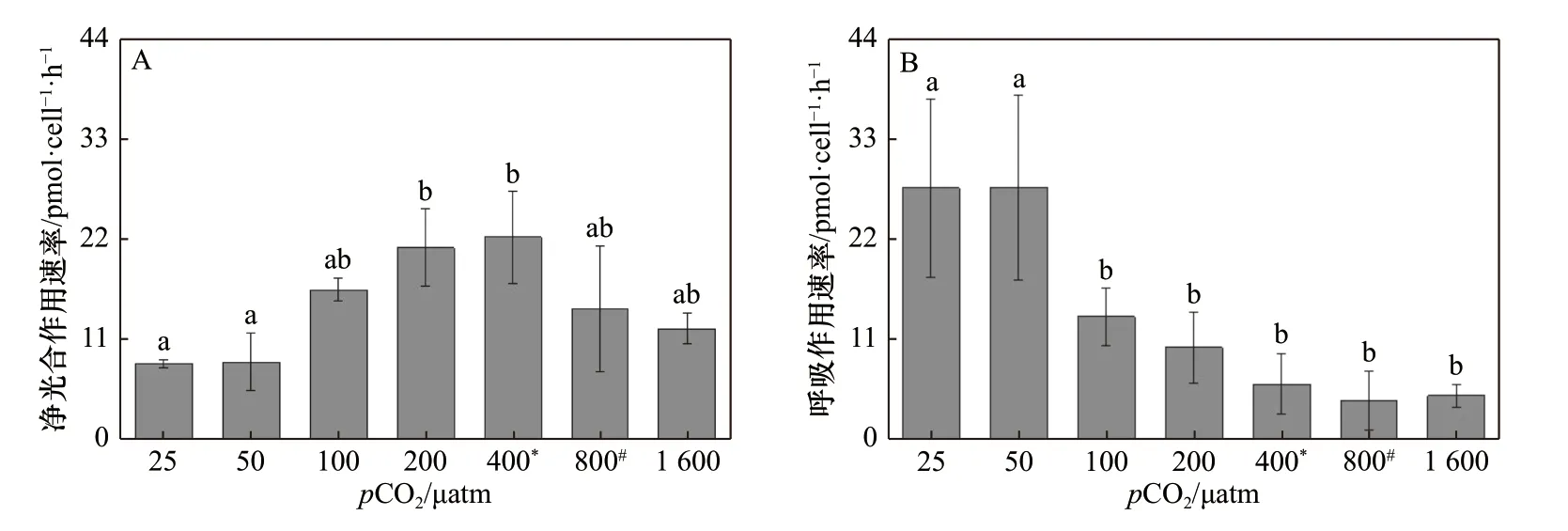
图4 斑点海链藻在不同pCO2 水平的净光合作用速率(A)和呼吸作用速率(B)Fig. 4 Net oxygen evolution (A) and dark respiration rates (B) of T. punctigera cells at different pCO2 levels
已有研究发现,低pCO2条件下,粒径较小的浮游植物,细胞比表面积较大,扩散边界层较薄,可以转运更多的CO2,以缓解低碳对光合作用的限制[40]。但在本实验中,斑点海链藻细胞在不同pCO2水平处理下比表面积没有变化,可能无法缓解低碳对光合作用的限制。另一方面,Rubisco 可以催化两种反应:氧化反应和羧化反应,在低pCO2水平下加氧反应理论上更具有优势[41],因此光合作用会被抑制,正如本实验中所观察到的较低的光合放氧速率。
研究表明,海洋酸化可能会对海洋初级生产者产生深远的影响[42]。但是由于种间差异性和其他环境因子的影响[43−44],海水pCO2水平升高可能会促进、抑制或不影响浮游植物的光合作用和生长速率[45–48]。在本研究中,酸化条件抑制了斑点海链藻的生长速率和叶绿素a含量。随着海水pCO2水平(400~1 600 μatm)升高和pH 下降,酸性的增加可能导致斑点海链藻生理调节机制的变化,产生负面效应。在酸化条件下,细胞内的酸碱平衡被破坏,胞内光合作用相关的酶活性降低,生长速率降低[49]。研究发现,在高pCO2水平下,藻细胞光合基因的转录会受到抑制,与碳转运和固定相关的几种光合酶水平降低,叶绿素a含量降低,光合作用受抑制[50–51]。但酸化对斑点海链藻生长的影响并没有碱化的影响显著。在使用类似实验方法、相同pCO2水平对硅藻威氏海链藻影响的研究[52]中发现,在酸化条件下,威氏海链藻的生长不受影响。这可能是由它们的种间差异造成的,不同粒径的硅藻对pCO2水平变化的适应能力不同[53]。这与之前发现的研究一致,小粒径(< 20 μm)的硅藻对海洋酸化的耐受能力更强,而大粒径(> 20 μm)的硅藻对海洋酸化的耐受能力较低,在未来长期海洋酸化的背景下,浮游植物群落中,大粒径的硅藻丰度将下降,而小粒径的硅藻丰度将升高[54]。但也有研究显示,海洋酸化时,pCO2水平的增加会减小细胞生长所需的碳和扩散到细胞表面的CO2之间的差额,大粒径的硅藻可能因此而受益[55]。因此,硅藻对海洋酸化的响应机制需要进一步的研究。
在近岸海域,海水碳酸盐系统震荡剧烈,海水pH日变化较大,有些地区海水pH 日变化甚至会超过1 个单位[6]。因此,对pH 变化适应能力的强弱将决定近岸海域浮游植物群落的结构和初级生产力的变化[56]。威氏海链藻和斑点海链藻对低pCO2水平的响应一致,但对高pCO2的响应差异较大,因此,未来海水中威氏海链藻和斑点海链藻的相对丰度可能发生变化。本研究结果有助于加深对近岸浮游植物在环境变化条件下竞争能力以及地理分布的理解,对探究近岸浮游植物如何适应动态环境变化具有一定的生态学意义。
值得注意的是,在本实验中,由于实验条件所限,我们只研究了斑点海链藻对不同pCO2水平的短期响应,而没有考虑斑点海链藻对不同pCO2水平的进化适应。不同类群的浮游植物对长期和短期海洋酸化表现出不同的适应机制,在蓝藻和颗石藻中发现,无论酸化处理时间如何,其生长都受到酸化的促进[57–58]。但也有研究表明,在长期(1800 代)和短期(20 代)处理下,硅藻三角褐指藻的生长和光合作用对海水酸化的响应截然相反[59]。因此,在研究未来海洋环境变化对浮游植物影响时,还应考虑其进化适应。
