“素养为本”指导下的高三化学复习策略
—— 以“合成氨工业”为例
2021-01-12黄琼玉
黄琼玉
(江苏省张家港市沙洲中学 215600)
一、问题的提出
2016年,教育部考试中心权威发布“一体四层四翼”,从顶层设计上回答了高考“为什么考”“考什么”“怎么考”,其中对“学科素养”考查要求是:学生能够在不同情境下综合利用所学知识和技能处理复杂任务,具有扎实的学科观念和宽阔的学科视野,并体现出自身的实践能力、创新精神等内化的综合学科素养.《普通高中化学课程标准(2017年版)》中提到:高中化学学科素养反映了社会主义核心价值观下化学学科育人的基本要求,全面展现了化学课程学习对学生未来发展的重要价值.新高考、新课程标准都推动了广大化学教师要在“素养为本”的视域下进行化学教学.
传统的高三化学的复习教学注重知识点的反复梳理,虽然也有方法归纳和迁移应用,但少了新意和生趣,不能很好地激发学生的求知欲望,以致于在有限的复习时间里没有达到最好的复习效果.如何在化学核心素养要求下使高三复习课绽放精彩,值得每位高三化学教师思考与研究.
二、教学案例的选择
笔者在多年的高三教学中关注到与化工工业相关的知识一直是考试的热点,也是高三复习的重点,在实际教学中,通过各种尝试,发现如果在化学核心素养指导下,将元素化合物知识结合化工生产,渗透物质结构和反应原理等知识,形成主题式复习模式,可以激发学生的主观能动性,让课堂更鲜活更有激情.下面笔者以“合成氨工业”为例,谈谈“素养为本”指导下的高三化学复习策略.
三、教学过程的实施
环节一:合成氨工业的原理
【创设情境】播放录像:化学史—— 诺贝尔化学奖三次握手合成氨工业,介绍哈伯、博施、埃特尔的事迹.
【学生活动】
1. 写出哈伯的合成氨工业的原理.
2.该反应过程中的能量变化如图1所示.已知H—H键、N—H键、N≡N键键能分别为436、391、946 kJmol-1,请写出其热化学方程式____.
3.在25℃时该反应的化学平衡常数为5×108,可为什么常温下氮气、氢气不能合成氨?
【设计意图】体现了“宏观辨识与微观探析”的核心素养.通过化学方程式的书写,认识元素从游离态到化合态的转化,形成“元素观”,以此建立起一种工业合成新物质的认识框架.通过化学反应能量图的分析,能从“化学反应的本质是旧化学键的断裂,同时新化学键的形成”这一微观层面来认识宏观的能量变化,并对物质及其变化进行分类和表征.
环节二:合成氨工业条件的选择
【创设情境】合成氨工艺条件的成熟经历了很多艰辛的研究过程,凝聚了很多科学家的心血,他们通过大量实验来提炼资料,得到结论.
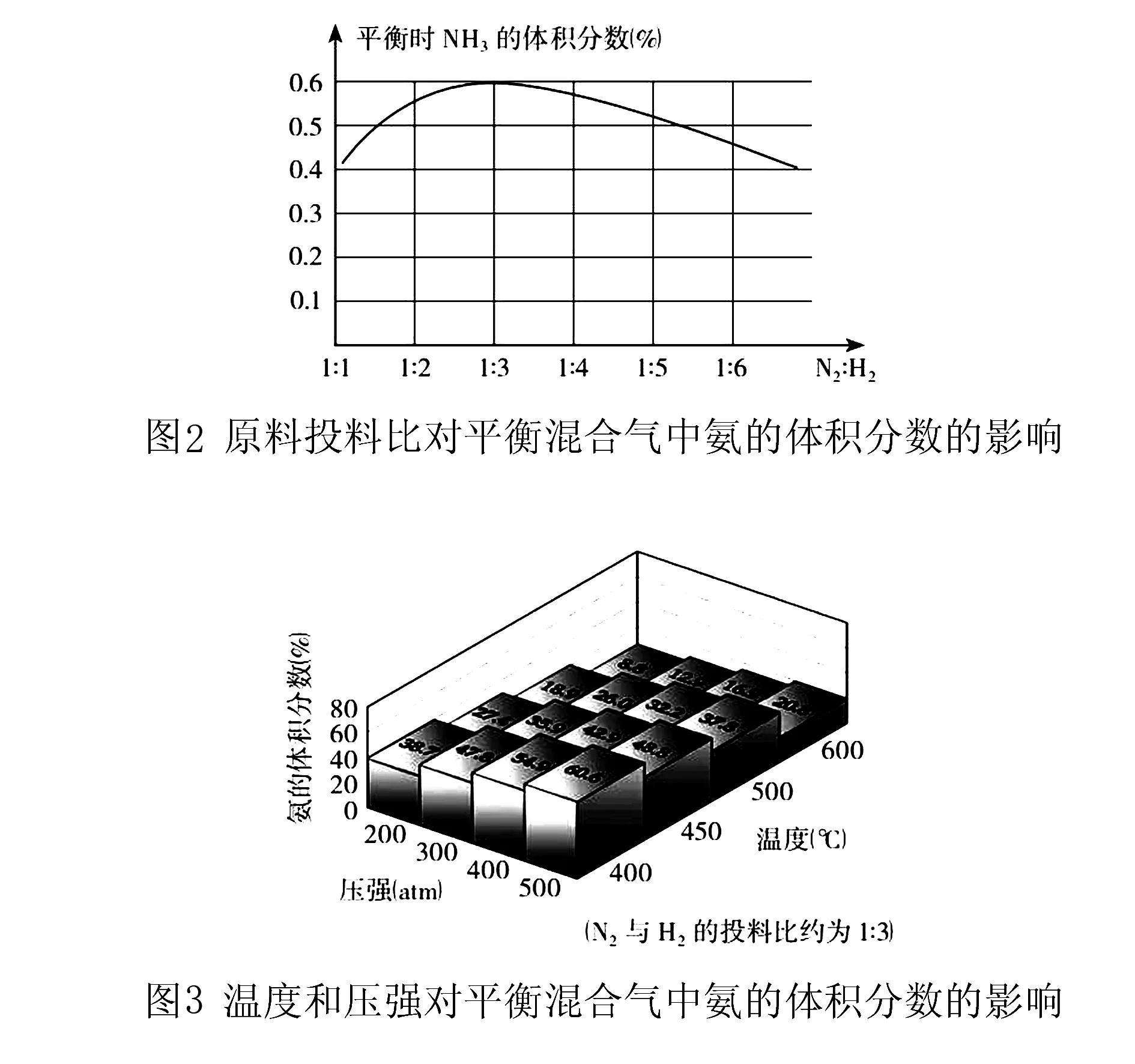
表1

研究者压强/atm温度/℃催化剂平衡混合气中NH3所占的体积分数)能斯特50685铂粉、锰粉等0.96%哈伯150~250550锇或铀8.25%
【学生活动】
1. 结合图2、图3和表1的信息,从化学反应速率和化学反应平衡的角度来选择合成氨工业的条件.
2. 在密闭容器内的反应:

(1)若初始投入:N21mol、H23mol,则N2和H2的平衡浓度比是____.
(2)平衡时,等容容器中充入惰性气体,平衡将____移动.
(3)平衡时,将3种物质的浓度同时增大1倍,平衡将____移动.

①氢气的消耗速率与氨的生成速率为3∶2;
②N2、H2、NH3的分子数目比为1∶3∶2;
③N2、H2、NH3的浓度保持不变;
④混合气体的总压强不再改变.
【设计意图】体现了“变化观念与平衡思想”的核心素养.通过图像和数据分析来概括合成氨工业的条件,认识反应条件对化学反应速率和化学平衡的影响,学会运用变量控制的方法研究化学反应;根据稀有气体对该反应的影响以及平衡标志的判断来理解化学反应中量变和质变的关系,学会运用对立统一思想和定性定量的方式揭示化学变化的规律,并运用于生产、生活实际中去.
环节三:合成氨化学平衡中的等效思想

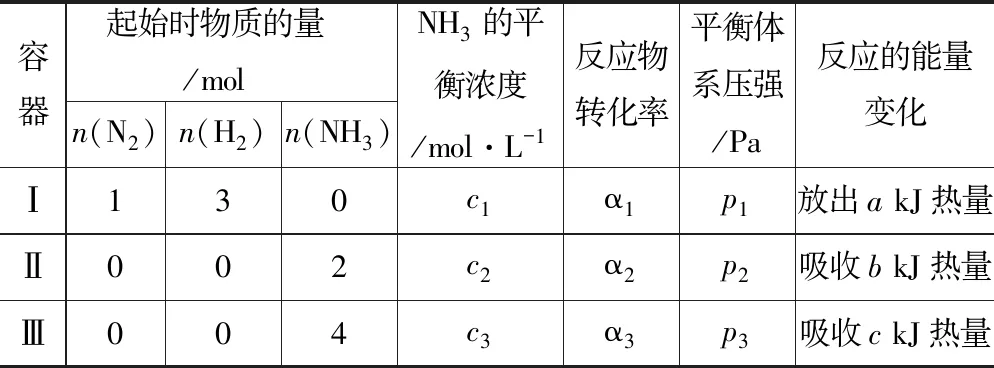
容器起始时物质的量/moln(N2)n(H2)n(NH3)NH3的平衡浓度/mol·L-1反应物转化率平衡体系压强/Pa反应的能量变化Ⅰ130c1α1p1放出a kJ热量Ⅱ002c2α2p2吸收b kJ热量Ⅲ004c3α3p3吸收c kJ热量
【学生活动】构造解题模型(如图4所示).一般先建立等效平衡(将恒容容器先变为恒压容器),再确定反应过程中体积的变化,然后将体积复原,确定平衡移动的方向,分析平衡移动引起的量的变化.
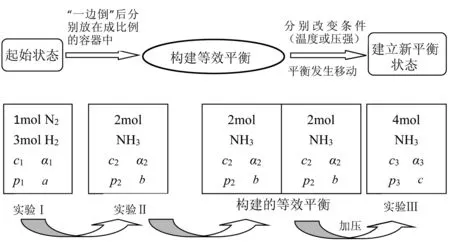
图4
【设计意图】体现了“证据推理与模型认知”的核心素养.面对复杂的等效平衡问题,帮助学生对情境中的关键要素(“一边倒”后是否相同或成比例、等温等压、等温等容、绝热容器)进行分析以建构相应的模型.这是一种极其重要的思想方法,其一般步骤是:分析抽象问题→构建化学模型→建立化学关系→回归解决问题.
环节四:合成氨工业的发展
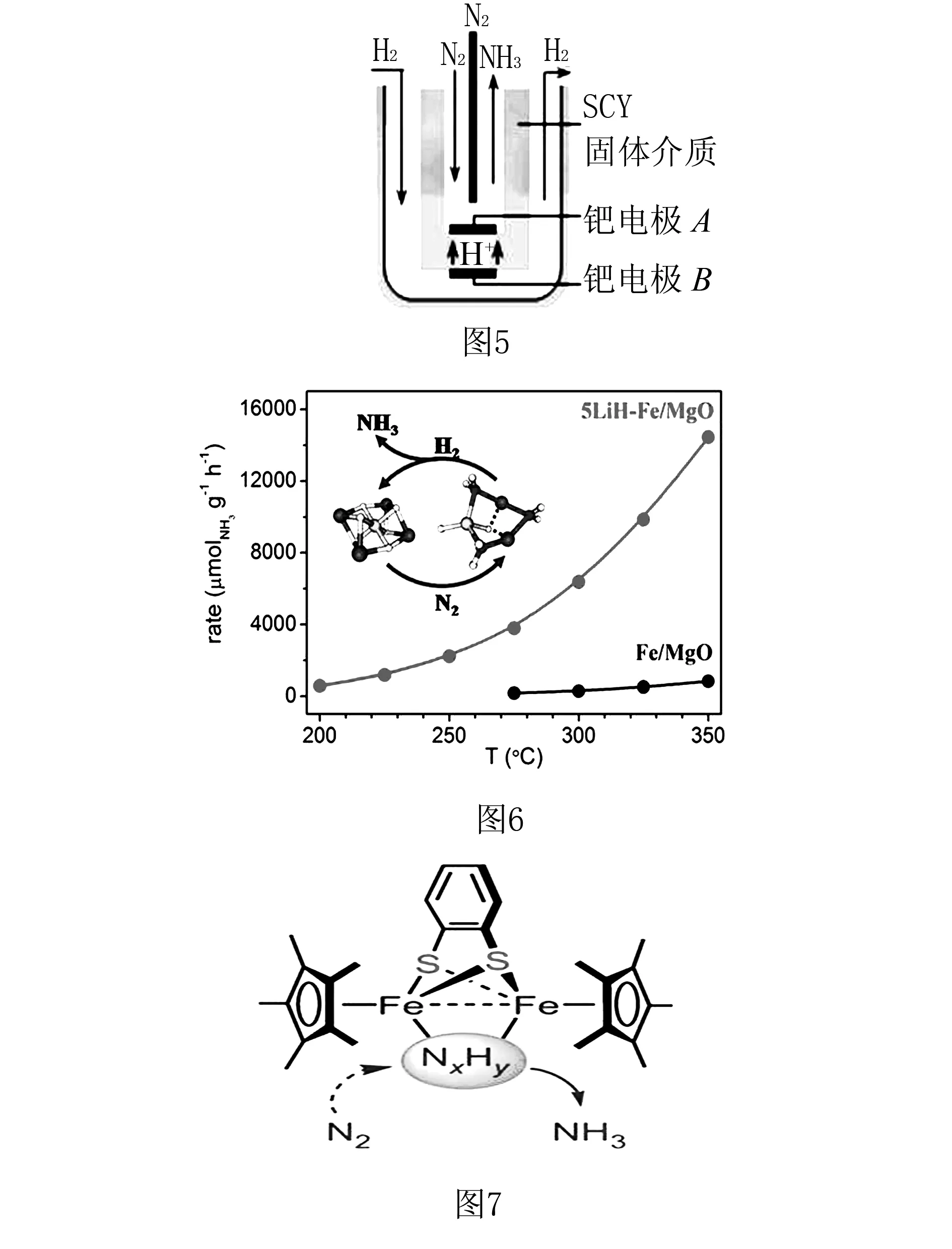
【创设情境】合成氨工业关系到全人类的生存和发展,常温常压下合成氨的探索一直是科学家研究的热点.下面图5是2001年两位希腊化学家提出了采用高质子导电性的SCY陶瓷(能传递H+)为介质电解合成氨的方法.图6是化学模拟生物固氮新的功能分子模型,实现了在双铁中心上,氮烯(NxHy)还原转化成氨气.图7是大连化物所在合成氨反应机理中对复合催化剂的部分研究结果.
【学生活动】
1. 由图5写出电极反应式.
2. 由图6选择催化性能较好的催化剂.
3. 由图7写出生成NH3的化学方程式.
4. 请从原料气的来源、净化,催化剂的选择,节能减排等方面谈谈你对合成氨工业未来发展的设想.
【设计意图】体现了“科学探究与创新意识”的核心素养.科学技术是第一生产力,而只有创新才能推动科学技术的进步.这一环节通过对合成氨工业的创新发展历史的学习和讨论,培养学生的问题意识,让学生能根据文献和实际需要提出综合性探究方案,善于合作,勇于创新.
环节五:合成氨工业与绿色化学
【创设情境】全世界每年约有15%的氨用于非化肥领域,如氨是固定装置排放NOx的还原剂.利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术.
【学生活动】
1.写出SCR技术核心反应

的化学平衡常数表达式K=____.
若K随温度T的升高而减小,则该反应的ΔH____0.(填“>”、“<”或“=”).
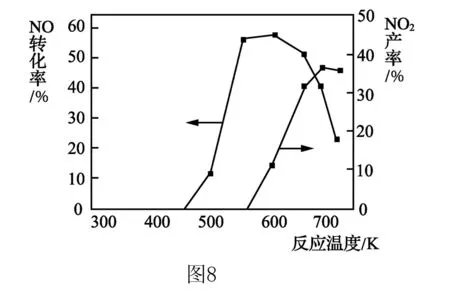
2.如图8所示,在有氧及Ag2O催化下,还会发生:

ΔH=-1627.2 kJ·mol-1
试分析当温度为550~700℃,NO转化率下降、NO2产率上升的可能原因____.
【设计意图】体现“科学态度与社会责任”的核心素养.通过了解合成氨的产品氨气能参与含氮污水的处理,树立“绿色化学”理念.解决社会热点问题,逐步形成节约成本、循环利用、保护环境等观念.
四、教学反思
本节课依托“合成氨工业”进行主题式复习,从诺贝尔化学奖到合成氨工艺的条件及平衡状态,再挖掘发展前景及参与绿色化学等,将元素化合物知识、化学反应与能量变化、等效平衡、电化学等知识串联起来,打破了原有知识的孤立性和零散性,拓展了复习的广度和深度,不仅提高了学生综合解决问题的能力,还树立了学生的社会责任意识.这样的高三复习课既迎合了高考“一体四层四翼”的高层要求,又体现了五大化学核心素养,真正让化学课堂成为落实立德树人根本任务、发展素质教育、弘扬科学精神、提升学生核心素养的重要载体.这种“素养为本”的主题式高三复习课,要求教师在课前花费大量的时间去思考如何最大限度地将各知识点结成一张立体的大网,再创设情境,构思问题,设计成一堂不断迸发思维火花的课堂.笔者相信,在高考“一体四层四翼”和化学学科核心素养的正确指导下,通过广大化学教师不懈的努力,肯定能让原本枯燥的高三化学复习课大放异彩!
