水位对洞庭湖湿地4种典型沉水植物的影响*
2021-01-12刘向东侯志勇谢永宏于晓英
刘向东,侯志勇 ,谢永宏,于晓英,李 旭,曾 静
(1:中国科学院亚热带农业生态研究所,农业生态过程重点实验室,洞庭湖湿地生态系统观测研究站,长沙 410125) (2:湖南农业大学园艺学院,长沙 410128)
洞庭湖是典型的湖泊湿地生态类型,也是中国第二大淡水通江湖泊[1]. 近年来,极端气候、频繁旱涝灾害及高强度人类活动的影响,洞庭湖水位不断降低,洲滩湿地提前出露,三峡工程运行后这种现象更为明显[2-3],导致洞庭湖湿地植被呈现明显的正演替趋势,呈现群落分布带不断下移、生物多样性受损等多种生态环境问题[4]. 洞庭湖湿地是国际重要湿地,水位下降导致浅水洼地减少,生境破坏,沉水植被消失、多样性明显下降等问题,亟需得到解决.
沉水植物是洞庭湖主要的生物类群,沉水植物在湖泊生态系统中发挥着重要的生态作用,被认为是湖泊生态系统恢复的重要工具. 湿地水文控制着湿地生态系统的基本生态格局和生态过程[5],是影响湿地生态系统的结构和功能的决定性因素. 湿地水文影响着沉水植物的物种组成和多样性,沉水植物与湖泊环境相互作用,其生长发育、种群结构对维持洞庭湖湿地水生生态系统的稳定具有重要意义. 水深是影响浅水湖泊沉水植物生长、分布和繁殖策略的主要因素之一[6-7]. 一般通过降低水位迅速提升水体光照条件,为沉水植被的恢复创造条件[8-9]. 因此,深入研究洞庭湖低水位变化的幅度对水生植物的生长,对预测水生植被动态和水生态系统的恢复均有指导意义.
竹叶眼子菜(Potamogetonmalaianus)、黑藻(Hydrillaverticillata)、苦草(Vallisnerianatans)、金鱼藻(Ceratophyllumdemersum)是洞庭湖湿地分布范围最广、分布面积最大的典型沉水植物种类. 本研究以这4种典型沉水植物为研究对象,模拟野外沉水植物主要分布区域浅水洼地的水文环境,设置4个水位梯度(25、50、75和100 cm),通过对比分析目标植物在不同水位条件下生态生理指标的差异性,揭示水位变化对沉水植物的影响.
1 材料与方法
1.1 研究区域概况
洞庭湖( 28°44′~29°35′N,111°53′~113°05′E) 素有“长江之肾”的美誉. 洞庭湖区为冲积平原,平均海拔低于40 m,天然湖泊面积2 625 km2. 东洞庭湖、南洞庭湖和西洞庭湖最低生态水位分别为22.62、27.19和28.11 m. 洞庭湖属亚热带季风性气候,春、夏季冷暖气流交替频繁,夏、秋季晴热少雨,秋寒偏旱,多年平均气温16.5~17.0℃,年平均降水量1250~1450 mm,无霜期260~280 d,年平均湿度80%[10].
1.2 实验设计
实验在中国科学院洞庭湖湿地生态系统观测研究站的综合控制实验场完成,选择洞庭湖4种典型沉水植物竹叶眼子菜、黑藻、苦草、金鱼藻,培养底质为河沙∶洞庭湖泥土1∶1比例均匀混合.
2018年5月3日,选择相同规格大小的4种沉水植物壮苗,每种植物数量约为500株. 将其培养于装有15 cm 底质的塑料盆中,再将塑料盒(60 cm×35 cm×20 cm)放置于实验水池(4.0 m×4.0 m×1.1 m)中,幼苗培养的水位为60 cm,培养时间为2周.
以野外调查的洞庭湖沉水植物生长密度为参考,4种沉水植物的种植密度设置为100株/盆(株/m2). 将实验水池用砖块分割成1.0 m×1.0 m×1.1 m的小水池. 2018年5月17日,将株高为20 cm的竹叶眼子菜、金鱼藻、黑藻和株高为6 cm的苦草实验苗种植于装有18 cm底质的塑料盒(60 cm×35 cm×20 cm),并置于小水池中. 实验设置(25、50、75和100 cm)4个水位梯度,每个水位设计4个重复,共64个小水池. 采用随机区组设计. 实验持续时间为2个月. 每3 d对水位进行监测,使其保持在实验范围内. 2个月后采取4个水位水池的水样,用5点取样法采取4个水位下底质,取实验植物顶端第3节以上的叶片测酶活性. 从沉水植物的生长、生物量、生理生化指标等方面探讨其对不同水位的响应.
1.3 指标测定
实验结束(2018年7月17日)后,测试目标植物的酶活性和生长情况(株高、节间距、分枝数、节数、叶片数等生长指标),最后采集所有实验植株测定生物量. 并测定水质和底质养分含量.
沉水植物超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛、可溶性糖、可溶性蛋白等指标采用试剂盒(苏州科铭生物技术有限公司)测定. 底质测定指标包括有机质、总氮、总磷、总钾、速效磷、速效钾、碱解氮、硝态氮、氨氮、有机碳、pH、氧化还原电位(Eh). 底质总氮采用元素分析仪 (2400II CHNS/O Elemental Analyzer, Perkin-Elmer, USA) 测定,总磷采用氢氧化钠熔融-钼锑抗比色法测定,总钾采用氢氧化钠碱-火焰光度法测定,速效磷采用氟化铵浸提-钼锑抗比色法测定,速效钾采用乙酸铵浸提-原子吸收法测定[11],碱解氮采用碱解扩散法测定,硝态氮和氨氮用1 mol/L的氯化钾浸提,流动注射分析仪测定(FIAstar 5000 Analyzer, Foss Tecator, Denmark),有机碳采用重铬酸钾容量法-外加热法测定,底质pH(水土比为2.5∶1)采用PB-10酸度计[12]测定,Eh采用便携式氧化还原电位仪测定. 水质指标包括总氮、总磷、pH、磷酸盐、碱度和氯化物. 水样总氮、总磷、磷酸盐浓度采用流动注射分析仪(FIAstar 5000 Analyzer, Foss Tecator, Denmark)测定,水样碱度采用盐酸滴定法测定,水样氯化物采用硝酸银滴定法测定,水样pH采用PB-10酸度计测定.

表1 不同水位的底质指标对比*
1.4 数据分析
使用Excel 2010整理数据,使用Origin Pro 2018作图,使用SPSS Statistics 17.0进行方差分析,多重比较采用Duncan法,以P<0.05表示差异显著,相关性分析采用Pearson相关分析.
2 结果与分析
2.1 不同水位下底质和水质的比较
本实验起始底质养分含量为:总氮0.09%、总磷0.09%、总钾3.04%、碱解氮20.87 mg/kg、速效磷10.70 mg/kg、速效钾326.67 mg/kg、硝态氮6.97 mg/kg、氨氮6.59 mg/kg、有机碳1.21%、有机质2.09%,由表1可知,水位可改变底质理化性质[13]. 2个月后不同水位下的底质养分含量发生了显著性变化. 4个水池的底质中,高水位水池比低水位水池底质总氮含量高,100 cm水位水池底质总磷含量最高(0.08%). 50 cm水位水池底质总钾含量最高. 100 cm水位水池底质碱解氮含量与25 cm水位水池底质碱解氮含量有显著性差异(P<0.05),100和75 cm水位水池底质速效磷、速效钾含量高,4个水池底质的硝态氮含量无显著性差异,25 cm水位水池的氨氮含量最高(11 mg/kg),与其他3个处理有显著性差异,25 cm水位水池底质的有机碳和有机质含量最高,50 cm的含量最低,4个水池底质的pH值在7.78~8.30之间,沉水植物能正常生长,温度均在25.18~26.55℃之间,4个水池底质Eh均无显著性差异,在197.57~233.46 mV范围内. 综上所述,100和75 cm水位水池的养分含量高于50和25 cm水位水池,氨氮、有机质和有机碳含量在25 cm水位水池较高.
从表2可知,实验2个月后,水位对水质有显著性影响(P<0.05). 4个水池总氮含量有显著性差异(P<0.05),75 cm水位水池总氮含量最高(4.36%),磷酸盐含量均小于0.002%,总磷含量均无显著性差异,硝态氮和氨氮浓度在0.004~0.05 mg/L之间,低水位水池比高水位水池水的碱度高,75 cm水位水池的氯化物浓度高(3.13 mg/L),4个水池水体的pH值在7.39~8.23之间. 因为沉水植物有改善水质的作用,所以水质的差异性取决于不同水位环境下的生长情况.

表2 不同水位水池水质指标对比
2.2 水位对4种沉水植物生长的影响
从表3可知,不同水位对沉水植物生长影响明显. 竹叶眼子菜在25和50 cm水位下株高低,分枝数少,节数多,节间距短,叶片数多,茎细;在75和100 cm水位下株高高,分枝数多,节数较多,节间距较长,茎直径长. 黑藻在75 cm的水位下株高最高(107.67 cm),25 cm水位下株高最低(55.67 cm);75和100 cm水位下分枝多;100 cm水位下的节数最多(30.33节);50 cm水位的节间距最短(1.57 cm). 苦草的株高和叶片数与水位呈正比,水位越深,株高越高,且叶片数越多. 金鱼藻的叶片为轮生,裂片丝状,分布全株,故本实验金鱼藻的叶片观测为叶片长度. 金鱼藻在100 cm水位条件下株高最高(88.67 cm),叶片长,茎直径为2.74 mm;过低和过高的水位不利于金鱼藻分枝;25 cm水位条件下金鱼藻的茎细. 由此可见,株高、分枝数、茎直径与水位基本呈正比,25 cm极低水位明显抑制沉水植物株高、分枝、茎直径等生长,75和100 cm的高水位有利于沉水植物的生长.
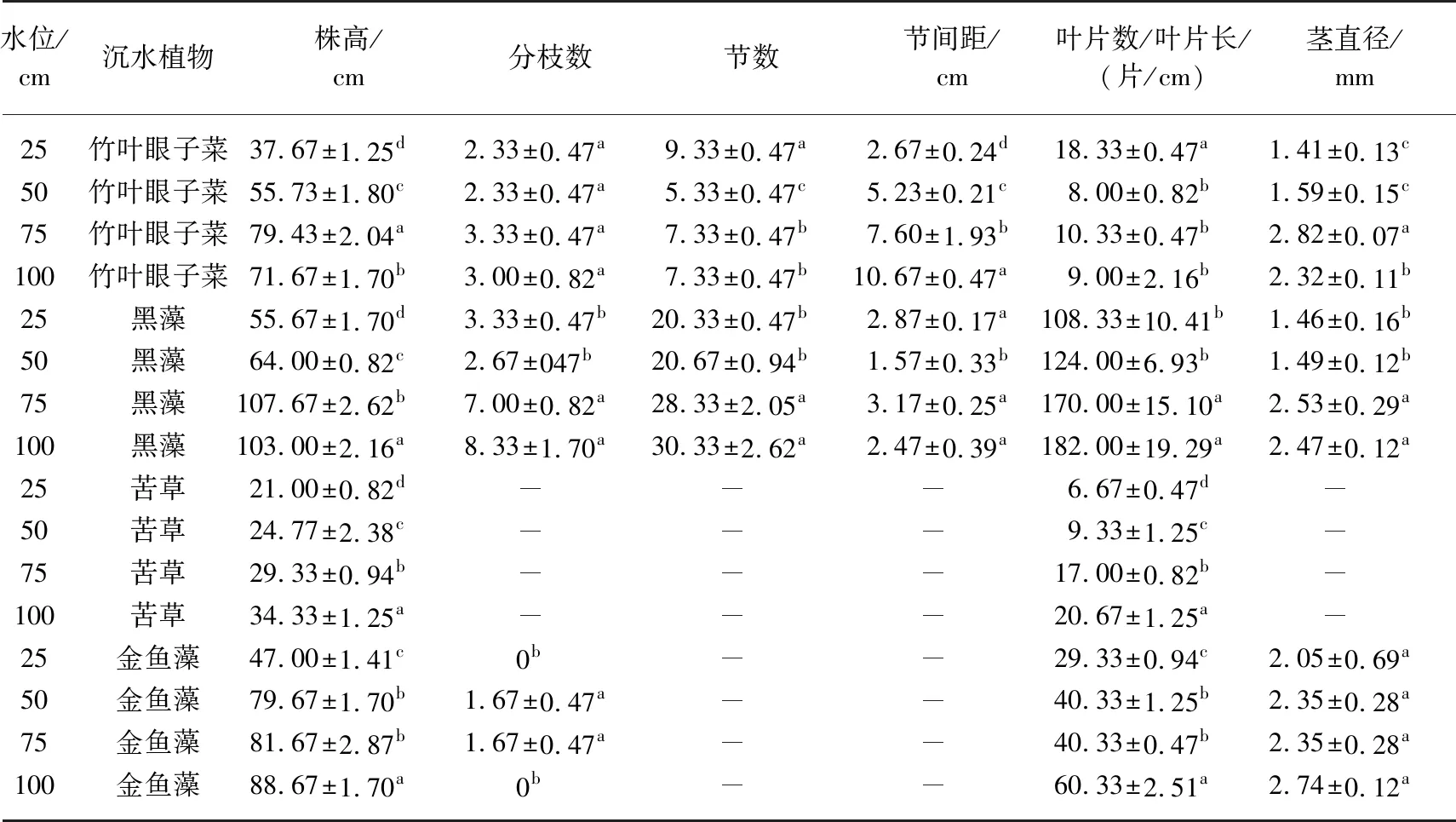
表3 不同水位对4种沉水植物生长的影响*
2.3 水位对4种沉水植物生物量的影响
各处理最初种植为10株/盆,2个月后,竹叶眼子菜在25 cm水位下繁殖量最低(14株/盆),相对最初种植时增长40.0%,100 cm水位下繁殖量最高(91.67株/盆),相对最初种植时增长816.7%. 黑藻在50 cm水位下繁殖量为61.33株/盆,相对最初种植时增长513.3%,在75 cm水位下繁殖量最高(123.33株/盆),相对最初种植时增长1133.3%. 苦草在25 cm水位的繁殖量最低(55.33株/盆),相对最初种植时增长453.3%,50 cm水位下繁殖量最高(238株/盆),相对最初种植时增长2280%. 金鱼藻在75 cm水位下的繁殖量(48.67株/盆)显著高于其他水位下,相对最初种植时增加率为386.7%. 可见,水位对沉水植物的繁殖有显著影响,4种沉水植物在25 cm水位下繁殖量均相对较低(图1).
从图2可知,竹叶眼子菜植株总长度随水位增加而增加. 黑藻在50 cm水位条件下总长度(68.00 cm)显著短于其他水位下,在75 cm水位下的总长度(89.33 cm)显著长于其他水位下,4个水位的黑藻地下部分长度无显著性差异(P>0.05). 苦草在25 cm水位下地上和地下部分长度均显著短于其他3个水位下,其地上部分长15 cm,地下部分长8.33 cm,100 cm水位下地上部分长度最长(31.67 cm),地下部分长度为11.67 cm. 金鱼藻在25 cm水位下总长度显著短于其他3个水位,其地上部分长度为30.00 cm,地下部分长度为17.67 cm;50 cm水位下地上部分长度为61.33 cm,地下部分长度最长(19.33 cm). 可见,不同水位环境下的沉水植物生长长度有显著性差异(P<0.05),4种沉水植物在不同水位环境下的地上部分长度均显著长于地下部分长度,竹叶眼子菜、苦草、金鱼藻在50 cm水位条件下植株地下部分生长情况好. 4种沉水植物在75和100 cm水位条件下植株地上部分生长情况均较好.
不同水位对沉水植物的鲜重和干重的影响均有显著性差异(P<0.05). 25 cm水位下竹叶眼子菜、苦草、金鱼藻的总重显著小于其他水位条件下的总重,地上部分鲜重与地下部分鲜重呈正比. 黑藻在25 cm水位下总重最高,50 cm水位下最低. 金鱼藻在75 cm水位的总重显著高于其他3个水位处理. 竹叶眼子菜和苦草在100 cm水位下的总重最高. 可见,竹叶眼子菜、苦草、金鱼藻在50 cm水位条件下地下部分生长好,100和75 cm的高水位对地上部分生长有促进作用. 100 cm水位有利于竹叶眼子菜的生长繁殖,其生物量高,黑藻和金鱼藻适合在75 cm的水位条件下生长繁殖,苦草适合在50 cm水位条件下生长繁殖. 25 cm极低水位环境下沉水植物相对繁殖能力较弱(图3,图4).

图1 不同水位对4种沉水植物株数的影响(不同小写字母表示差异显著,P<0.05)Fig.1 Effect of different water levels on the number of four submerged plants
2.4 不同水位下沉水植物生理指标的比较
植株POD、SOD、CAT、MDA、可溶性蛋白和可溶性糖等是衡量沉水植物对逆境环境耐受性的重要指标. 在酶促清除系统中,SOD是最有效的抗氧化酶之一,可清除有潜在危险的超氧阴离子,从而减轻植物受到的危害[14]. 从表4可知,各水位间竹叶眼子菜的SOD活性大小为:100 cm>75 cm>50 cm>25 cm,黑藻的SOD活性大小为:100 cm>50 cm>75 cm>25 cm,苦草的SOD活性大小为:100 cm>75 cm>25 cm>50 cm,金鱼藻的SOD活性大小为:25 cm>50 cm>75 cm>100 cm. 各处理的过氧化物酶(POD)均有显著差异(P<0.05),其中75 cm水位下的竹叶眼子菜和黑藻POD活性最高,分别为4008.04和1052.40 U/mg,100 cm水位下的苦草和金鱼藻POD活性最高,为1988.05和1492.82 U/mg. 4种沉水植物在水位25和50 cm的环境下MDA较高,这说明25和50 cm的水位会造成沉水植物细胞的氧化损伤. 100 cm水位下竹叶眼子菜、黑藻、苦草的CAT活性较高,75 cm水位下的金鱼藻CAT活性较高. 竹叶眼子菜和黑藻在不同水位下的可溶性糖含量无显著性差异(P<0.05),25 cm水位下苦草的可溶性糖含量显著高于其他3个水位下,50 cm水位下金鱼藻的可溶性糖含量显著高于其他3个水位下. 25 cm水位沉水植物可溶性蛋白含量显著低于其他水位下. 整体来看,100 cm水位下的沉水植物酶活性较强,75和50 cm水位下的沉水植物酶活性次之,25 cm水位下的沉水植物酶活性较弱.

表4不同水位对4种沉水植物生理的影响*
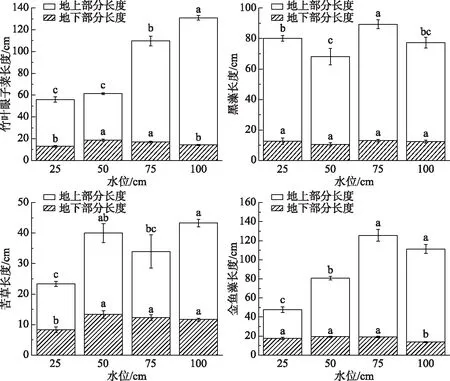
图2 不同水位对4种沉水植物总长度的影响(不同小写字母表示差异显著,P<0.05)Fig.2 Effect of different water levels on the length of four submerged plants

图3 不同水位对4种沉水植物总鲜重的影响(不同小写字母表示差异显著,P<0.05)Fig.3 Effect of different water levels on total fresh weight of four submerged plants

图4 不同水位对4种沉水植物总干重的影响(不同小写字母表示差异显著,P<0.05)Fig.4 Effect of different water levels on the total dry weight of four submerged plants
2.5 水位与沉水植物各指标的相关性分析
由表5可知,水位与竹叶眼子菜的可溶性蛋白含量、植株总长度、地上部分鲜重、地下部分鲜重、地上部分干重、地下部分干重、总干重呈显著正相关(P<0.05,0.952≤R≤0.989),与总鲜重、节间距呈极显著正相关(P<0.01,R=0.999). 水位与黑藻地下鲜重、叶片数呈显著正相关(P<0.05,R=0.990,R=0.972). 水位与苦草叶片数呈显著正相关(P<0.05,R=0.983),与苦草株高呈极显著正相关(P<0.01,R=0.998). 水位与金鱼藻SOD含量呈显著负相关(P<0.05,R=-0.964),与MDA含量呈极显著负相关(P<0.01,R=-0.995).

表5 水位与4种沉水植物各相关指标的相关性分析
3 讨论
沉水植物生长需要适宜的水深,当水深环境适合其生长时,能对水生生态系统起到最大的修复作用[15]. 沉水植物为了适应水位变化,其株高、叶长、叶数、生物量及分配格局、生理活性等也会随之改变[16-18]. 尹杰等[19]通过原位模拟实验,比较在同一水位幅度变化下不同高水位持续胁迫水平,认为持续高水位胁迫下(<8 d),竹叶眼子菜和狐尾藻仍具有较好的形态和生长适应性. 高汾等[20]模拟水位抬升,发现高水位促进了竹叶眼子菜为代表的冠层型植物的生长,而水位抬升不利于以黑藻为代表的直立型植物的生长,抑制了莲座型植物密刺苦草的生长. 本研究表明100和75 cm水位能促进4种沉水植物株高的生长. 25 cm低水位抑制竹叶眼子菜的株高生长,导致植物个体节数增加、节间距缩短、叶片数增加和直茎变细. 这与竹叶眼子菜属于冠层型植物所形成的生态位密切相关,竹叶眼子菜为了获取充足光照,通过增加节数、缩短节间距以降低胁迫,从而形成一种对水位变化的适应机制.
随着水位降低,沉水植物生物量增加[21-23]. 本实验研究表明,苦草的株高和叶片数与水位呈正比,株高和叶片数随着水位的增高而增加,高水位下苦草会通过增加地上部分的分配获取更多的光源,从而保证植株资源利用有效率. 50 cm的低水位下苦草接受的阳光充足,生长活动横向繁殖扩展,占据更大的生存空间. Zhang等[24]通过M-SAVM模拟5种水力情景生物量与水位的关系,认为沉水植物生物量与水位之间存在着显著的负相关(P<0.01,R=-0.97). 本实验研究结果有所不同,认为不同类型的沉水植物在不同水位下的生物量存在差异,25 cm极低水位不适合竹叶眼子菜、金鱼藻冠层型植物和苦草莲座型植物的向上生长及地上部分伸长,横向繁殖扩展及生物量积累也受到影响,25 cm极低水位适合黑藻繁殖能力强的直立型植物的生物量积累.
水位可通过改变水质直接影响植物生长[25]. 本研究表明75 cm水位下金鱼藻生长好,生理活性强,生物量多,其次为100 cm水位下. 这可能与水体氨氮浓度呈正相关,实验证明水位为75 cm的实验处理氨氮浓度最高、水位100 cm次之,显著高于其他水位处理. Best[26]研究氮素对金鱼藻的生长和其体内氮含量的影响,发现水体中氮素浓度≤1 mg/L时,氮增加可以促进金鱼藻的生长,氮素浓度≥5 mg/L时抑制金鱼藻的生长. 周金波等[27]研究认为在低浓度氨氮范围内, 氨氮升高有利于植物生长.
沉水植物对逆境环境的响应还包含植物光合作用速率和酶活指标. 光合作用是沉水植物最重要的代谢活动,本实验设计水位为低水位,水透明度为100%,光合速率对沉水植物的生长影响较小. 植株SOD、POD、CAT、MDA、可溶性糖和可溶性蛋白是衡量沉水植物对逆境环境耐受性的重要指标. 当植物受到胁迫时,将导致一系列生理代谢紊乱[28]. 刘俊初等[29]研究表明菹草(Potamogetoncrispus)、伊乐藻(Elodeacanadensis) 和微齿眼子菜(Potamogetonmaackianus)的可溶性糖含量随着水位的降低而下降,穗花狐尾藻(Myriophyllumspicatum)的可溶性糖含量随着水位的降低有升高趋势. 本实验75和100 cm水位下竹叶眼子菜SOD、POD、CAT、可溶性蛋白和可溶性糖含量显著高于25和50 cm水位. 这说明100和75 cm水位的沉水植物保护酶有效清除体内的活性氧,植物体内活性氧的产生与清除的动态平衡维持在良好的水平. 除活性氧方面,并非所有的保护酶都表现出一致性的变化规律,某些保护酶活性增加并不意味着清除活性氧能力同步增强. MDA含量是植物细胞膜质过氧化程度的体现,SOD是机体内天然存在的超氧自由基清除因子. 100和75 cm水位下金鱼藻SOD含量低于25和50 cm水位下,其原因可能在于SOD分解植物体内积累的超氧阴离子自由基来保护细胞受损[30]. 75和100 cm水位下4种沉水植物的MDA含量维持在较低水平,说明此时整个防御系统的协调作用发挥至最佳水平,随着保护酶活性的上升,活性氧的清除能力最强.
