圆叶葡萄籽原花色素稳定性及其抗氧化性研究
2021-01-10管敬喜廖秋眉黄江流盘丰平
管敬喜,廖秋眉,黄 羽,黄江流,黄 竟,盘丰平,杨 莹
(1.广西壮族自治区农业科学院葡萄与葡萄酒研究所,南宁 530007;2.广西壮族自治区农业科学院农产品加工研究所,南宁 530007)
圆叶葡萄(Vitis rotundifolia)为葡萄科(Vitaceae)圆叶葡萄亚属,起源于美国东南部地区[1]。圆叶葡萄引种至我国,已在广西、浙江、成都[2-3]等地栽植成功,且可实现一年两熟。圆叶葡萄品种颜色有绿色、铜色、红色、黑色等,果实具有特殊的芳香和风味,既可鲜食,又可加工成果酒、果汁、果脯、果酱等[4]。圆叶葡萄具有良好的抗氧化、抗菌、消炎、抗癌等功效[5-7],这些都得益于其含有的多种酚类物质。圆叶葡萄的果皮和种子中含有大量的儿茶素、表儿茶素及其多聚体,还含有鞣花酸、没食子酸、山柰酚、槲皮素等[8]。
原花色素(proanthocyanidins,PAs)是植物中广泛存在的一大类多酚化合物的总称,由儿茶素、表儿茶素单体和不同数量的儿茶素或表儿茶素聚合体组成[9],能够抗氧化、清除自由基,已广泛应用于食品、医药、化妆品等领域[10]。葡萄籽中的原花色素,是一种有着特殊分子结构的生物类黄酮,是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂[11]。葡萄籽中所含多酚类物质占整个葡萄果实酚类物质的60%左右,葡萄籽中酚类物质原花色素含量高达90%以上,因此提取原花色素的最好原料为葡萄籽[12]。
本研究对诺贝尔(Noble)圆叶葡萄籽所提取的原花色素的稳定性及抗氧化性进行研究,以期为圆叶葡萄进一步开发和综合利用提供参考依据。
1 材料与方法
1.1 材料与试剂
圆叶葡萄籽:取自发酵后的诺贝尔(Noble)圆叶葡萄皮渣中,葡萄产地为广西都安县。
原花青素标准品(葡萄籽提取物,含原花色素95%):上海源叶生物科技有限公司。
1,1-二苯-1-苦基苯肼(1,1-dipheny1-2-picryhydrazy1,DPPH)(分析纯):美国Sigma公司;硫酸亚铁、三氯化铁、香草醛、抗坏血酸(均为分析纯):天津市大茂化学试剂厂;铁氰化钾(分析纯):成都金山化学试剂有限公司;三氯乙酸(分析纯):国药集团化学试剂有限公司;石油醚、过氧化氢(均为分析纯):天津市富宇精细化工有限公司;浓盐酸(分析纯):廉江市爱廉化试剂有限公司;无水乙醇、甲醇(均为分析纯):成都市科隆化学品有限公司;水杨酸、磷酸二氢钠、磷酸氢二钠、氯化钾、氯化钠、氯化镁(均为分析纯):天津博迪化工股份有限公司。
1.2 仪器与设备
UV-1801紫外/可见分光光度计:北京瑞利分析仪器有限公司;HH-S4数显恒温水浴锅:江苏金怡医疗仪器厂;FA2004N分析天平:上海明桥精密科学仪器有限公司;TG16-WS台式高速离心机:湖南湘仪实验室仪器开发有限公司;雷磁pH-3C酸度计:上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 圆叶葡萄籽中原花色素提取
把葡萄籽粉碎后,加一定量的石油醚浸泡脱脂,干燥。以料液比1∶20(g∶mL)加入体积分数70%的乙醇溶液超声波浸提20 min后,50 ℃水浴80 min,得到原花色素提取液,3 000 r/min离心10 min后置于4 ℃条件下保存备用[13-14]。
1.3.2 圆叶葡萄籽原花色素的光谱特性
取一定量的原花色素提取液,用UV-1801紫外/可见分光光度计在波长350~700 nm范围内测定其吸光度值,绘制特征吸收光谱。
1.3.3 原花色素含量的测定
采用香草醛-盐酸法[15]:准确称取原花青素标准品配制成质量浓度为0.6 mg/mL的对照品标准溶液,分别取1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL定容至10 mL。各取1.00 mL(另取1.00 mL甲醇液为空白液)于比色管中,分别加入5.00 mL显色剂,摇匀后在30 ℃避光水浴30 min,然后测定A500nm值,绘制标准曲线,得到回归方程为y=0.773 3x+0.007 2(其中y为吸光度值,x为原花色素质量浓度,R2=0.999 1)。
1.3.4 圆叶葡萄籽原花色素稳定性的研究
温度对原花色素稳定性的影响:量取一定的原花色素提取液,分别于20 ℃、40 ℃、60 ℃、80 ℃、95 ℃条件下避光保温,每隔0.5 h取样冷却后,测定其吸光度值。
pH值对原花色素稳定性的影响:量取一定的原花色素提取液,配制成pH值3.0、4.0、5.0、6.0、7.0、8.0、9.0的溶液,混匀后室温避光放置4 h、8 h、12 h、24 h、48 h后,测其吸光度值。
金属离子对原花色素稳定性的影响:量取一定的原花色素提取液,分别加入浓度相等的K+、Na+、Mg2+、Ca2+、Zn2+、Cu2+、Fe3+溶液,混匀后室温避光放置,设对照,按2 h、24 h、48 h取样测定其吸光度值。
还原剂、氧化剂对原花色素稳定性的影响:量取一定的原花色素提取液,分别加入质量分数为0.1%、0.5%、1.0%的抗坏血酸溶液和过氧化氢溶液,混匀后室温避光放置,设对照,每天取样测定其吸光度值。
光照对原花色素稳定性的影响:量取一定的原花色素提取液,置于室内避光、室内自然光条件下,每5天取样测定其吸光度值。
1.3.5 圆叶葡萄籽原花色素体外抗氧化活性的测定
DPPH自由基(DPPH·)清除率的测定[16]:取不同浓度样品各0.2 mL倒入试管,加入3.8 mL质量浓度为80 mg/L DPPH·的无水乙醇溶液,摇匀,室温条件下黑暗处放置30 min,于波长517 nm处分别测定吸光度值Ai;另取不同浓度样品各0.1 mL倒入试管,加入3.9 mL无水乙醇,于波长517 nm处分别测定参比吸光度值Ab;再取0.1 mL无水乙醇,加入3.9 mL 80 mg/L的DPPH·无水乙醇溶液,于波长517 nm处测定空白吸光度值A0,计算DPPH·清除率,其计算公式如下:
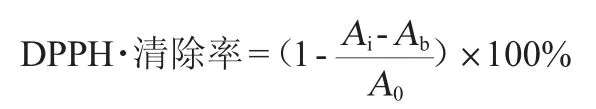
羟基自由基(·OH)清除率的测定[16]:取不同浓度样品各2 mL倒入试管,加入2 mL 6 mmol/L FeSO4溶液,再加入6 mmol/LH2O2溶液,摇匀,静置10 min后,加入2 mL 6 mmol/L水杨酸溶液,摇匀,静置30 min。于波长510 nm处分别测定其吸光度值Ai;另用蒸馏水代替水杨酸溶液重复上述试验,测得参比吸光度值Ab;另用蒸馏水代替样品溶液重复上述试验,测得空白吸光度值A0,计算·OH清除率,其计算公式如下:
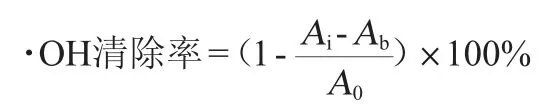
还原力(铁离子还原能力)的测定[17]:将5 mL原花色素溶液、1 mL、pH 6.6、0.2 mol/L的磷酸钠缓冲液和1.0 mL 1%的铁氰化钾混匀,于50 ℃水浴反应20 min后急速冷却。然后在上述溶液中加入1.0 mL 10%的三氯乙酸溶液,3 000 r/min离心10 min,取上清液2.0 mL。在上清液中加入2.0 mL蒸馏水及0.5 mL 0.1%三氯化铁溶液,混匀,10 min后于波长700 nm处测定其吸光度值。吸光度值越高说明样品的还原能力越强。
1.3.6 数据处理
采用Office 2010统计和处理各数据,试验重复3次,采用Origin 8.5作图。
2 结果与分析
2.1 圆叶葡萄籽原花色素的光谱特性
圆叶葡萄籽原花色素在波长350~700 nm之间有一最大吸收峰,该峰峰值在波长500 nm处,因此选定500 nm作为最佳吸收波长。
2.2 圆叶葡萄籽原花色素稳定性的研究
2.2.1 温度对圆叶葡萄籽原花色素稳定性的影响

图1 温度对原花色素稳定性的影响Fig.1 Effect of temperature on the stability of proanthocyandin
由图1可知,温度为20 ℃、40 ℃、60 ℃时,原花色素溶液吸光度值随时间的延长,无显著变化。温度为80 ℃时,其原花色素溶液吸光度值相较于20 ℃、40 ℃、60 ℃缓慢升高,但增幅不大。在95 ℃条件下,随着加热时间的延长,原花色素溶液吸光度值则显著上升,颜色由橘黄色变为褐色,吸光度值明显变大。这可能是由于高温条件下葡萄籽原花色素受热分解为其他物质所致[18]。由此可说明圆叶葡萄籽原花色素在温度低于80 ℃时具有良好的稳定性,但更适合于低温条件下保存和应用。
2.2.2 pH值对圆叶葡萄籽原花色素稳定性的影响
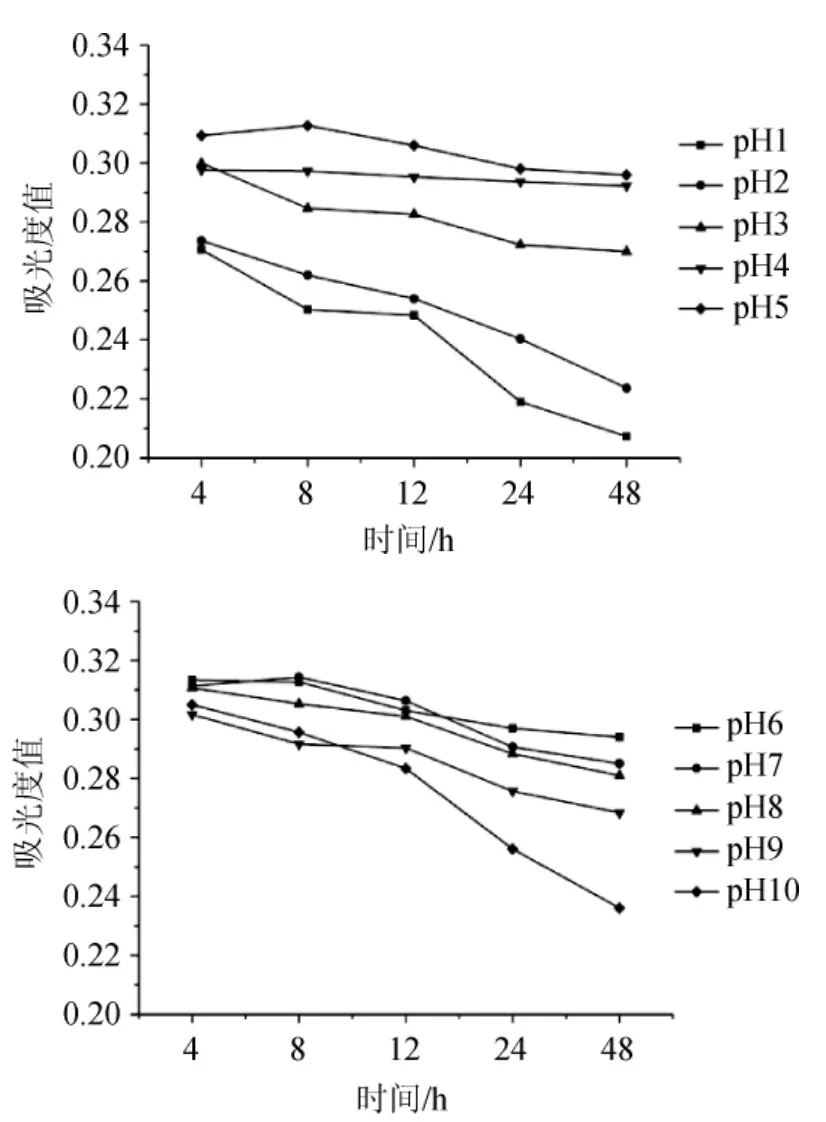
图2 pH值对原花色素稳定性的影响Fig.2 Effect of pH on the stability of proanthocyandin
由图2可知,不同pH对原花色素的影响差异较大,特别是pH≤3、pH≥9时,原花色素溶液吸光度值随着时间的推移而显著变小,而当pH为4~8时,原花色素溶液吸光度值下降不明显,稳定性较好。由此可见,酸性或碱性过强都会破坏原花色素的结构,在弱酸、弱碱性(pH4~8)条件下其相对比较稳定。
2.2.3 金属离子对圆叶葡萄籽原花色素稳定性的影响
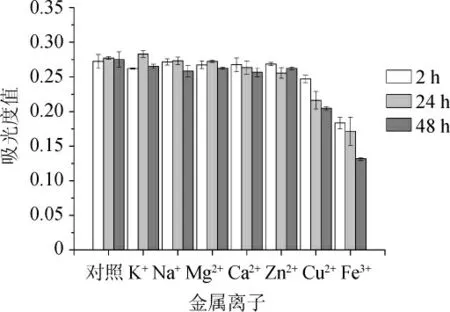
图3 金属离子对原花色素稳定性的影响Fig.3 Effect of metal ions on the stability of proanthocyandin
由图3可知,在含有K+、Na+、Mg2+、Ca2+、Zn2+金属离子的溶液中,原花色素的吸光度值随时间变化不明显,与对照组变化相似,对原花色素稳定性影响不大。而当原花色素遇Cu2+时,溶液颜色立刻转变为棕绿色,吸光度值明显减小;加入Fe3+后溶液颜色立刻转为绿褐色,并带有轻微浑浊现象,吸光度值减小,常温放置24 h后有絮状沉淀产生。由此可以看出Cu2+、Fe3+对原花色素有明显的破坏作用。
2.2.4 还原剂、氧化剂对原花色素稳定性的影响

图4 抗坏血酸对原花色素稳定性的影响Fig.4 Effect of ascorbic acid on the stability of proanthocyandin
由图4可知,与对照相比,抗坏血酸对原花色素的影响不明显。0.1%抗坏血酸对原花色素几乎无影响,而0.5%和1%抗坏血酸随着时间的延长,引起原花色素溶液吸光度值小幅下降。因此,还原剂抗坏血酸对圆叶葡萄籽中原花色素无明显的破坏作用。
由图5可知,与对照相比,0.1%与0.5%过氧化氢溶液对原花色素稳定性影响较小,而1.0%过氧化氢溶液对原花色素影响较大,吸光度值明显下降,表明氧化剂浓度越高,对原花色素溶液破坏越大。

图5 过氧化氢对原花色素稳定性的影响Fig.5 Effect of hydrogen peroxide on the stability of proanthocyandin
2.2.5 光照对圆叶葡萄籽原花色素稳定性的影响
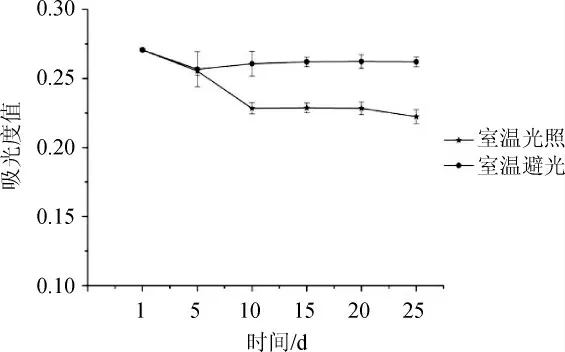
图6 光照对原花色素稳定性的影响Fig.6 Effect of light on the stability of proanthocyandin
由图6可知,在室温条件下,圆叶葡萄籽原花色素易受光照影响,随着时间的延长,原花色素的吸光度值逐渐下降。避光条件下原花色素的稳定性明显较好,其降解速度较慢,在使用和保存时应该避光处理。
2.3 圆叶葡萄籽原花色素体外抗氧化活性分析
2.3.1 圆叶葡萄籽原花色素对DPPH·的清除作用
原花色素分子中含有大量的酚羟基,使其具有强大的抗氧化和自由基清除能力[19]。
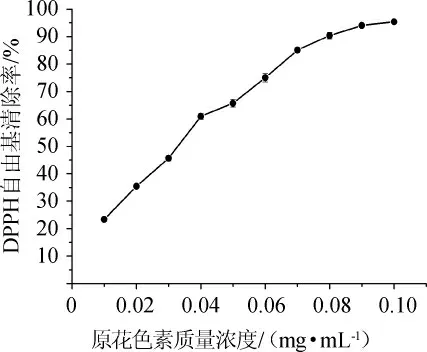
图7 原花色素对DPPH自由基的清除作用Fig.7 Scavenging effect of proanthocyandin on DPPH free radical
由图7可知,当原花色素溶液质量浓度在0.01~0.1mg/mL范围内,圆叶葡萄籽原花色素对DPPH自由基具有清除作用,随着原花色素质量浓度的增加,DPPH自由基的清除能力逐渐增强,并且在原花色素用量很低的情况下,清除率仍可高达90%以上,由此得出,葡萄籽原花色素具备一定的清除DPPH自由基的能力。
2.3.2 圆叶葡萄籽原花色素对·OH的清除作用
H2O2与Fe2+反应生成的羟基自由基能与水杨酸产生有色物质,可由溶液颜色的变化程度,来评价原花色素物质抗氧化活性的高低[20]。
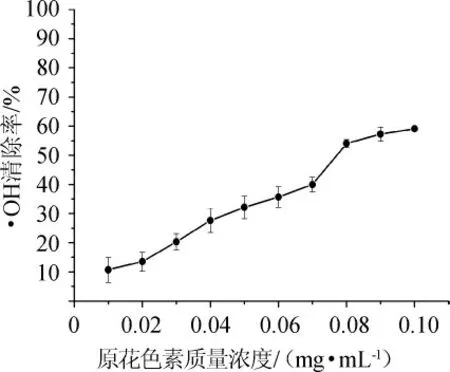
图8 原花色素对·OH的清除作用Fig.8 Scavenging effect of proanthocyandin on hydroxyl radical
由图8可知,在选定的质量浓度范围内,原花色素溶液对羟基自由基有较好的清除作用,其清除效果与原花色素溶液的添加量呈正相关。当原花色素质量浓度为0.1 mg/mL时,其清除率达到59.12%。葡萄籽原花色素具备一定的清除羟基自由基的能力。
2.3.3 圆叶葡萄籽原花色素的铁离子还原能力
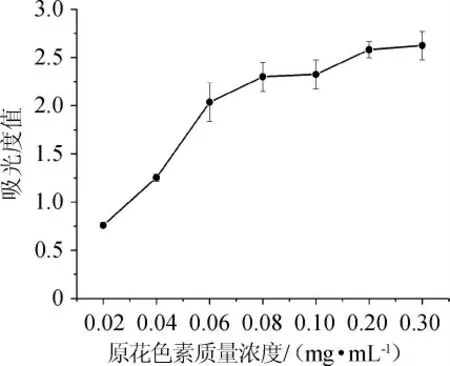
图9 原花色素的铁离子还原能力Fig.9 Iron reducing power of proanthocyandin
由图9可知,圆叶葡萄籽原花色素具有一定的还原能力,当质量浓度<0.08 mg/mL时,随质量浓度增加,吸光度值增加幅度明显,原花色素还原力逐渐增强,还原能力显示出一定的量效关系;当质量浓度>0.08 mg/mL时,随质量浓度增大,吸光度值变化趋缓,原花色素还原能力增加缓慢。
3 结论
通过温度、pH、金属离子、氧化剂还原剂、光照五个因素对圆叶葡萄籽原花色素的稳定性影响进行研究,结果表明,圆叶葡萄籽原花色素在温度低于80 ℃时具有良好的稳定性,pH 4~8范围内该原花色素较稳定;金属离子K+、Na+、Mg2+、Ca2+、Zn2+对原花色素的稳定性影响不明显,而Cu2+、Fe3+有明显的破坏作用;抗坏血酸对原花色素无明显影响,过氧化氢则显著降低其稳定性;较长时间的光照对其稳定性不利。抗氧化试验表明,圆叶葡萄原花色素对DPPH·、·OH有明显的清除效果,并具有一定的还原能力。
综上,圆叶葡萄籽原花色素的加工储藏过程中应在避光、低温、弱酸环境中进行,并应避免与氧化剂及铁、铜器皿的接触。
