过渡金属型锰基低温NH3-SCR脱硝催化剂研究综述
2021-01-08曾贤君张利杰孟广莹孙彦民
冯 晴,曾贤君,张利杰,李 贺,孟广莹,孙彦民
(1.中海油天津化工研究设计院有限公司,天津300131;2.天津市炼化催化技术工程中心)
为了满足工业日益增长的能源需求,不可再生的化石燃料仍然是工业生产、 发电厂和机动车辆的主要能源。然而大量化石燃料的燃烧所排放的尾气中,主要的污染产物为氮氧化物(NO、NO2和N2O 及其衍生物),并因此导致酸雨、光化学烟雾、臭氧消耗和水资源富营养化等一系列问题[1-2],减少氮氧化物的排放对环境保护至关重要。目前高效去除氮氧化合物的方法,是利用催化材料对氮氧化合物进行催化还原转化为氮气。其中,NH3选择性催化还原NOx(NH3-SCR)的反应,以其较高的NOx去除率而得到了广泛的应用[3]。通常情况下,工业烟气的排放温度低于300 ℃,因此要求NH3-SCR 催化剂须在低温下(100~300 ℃)保持良好的催化活性。目前已经商业化的NH3-SCR 催化剂V2O5-WO3(MoO3)/TiO2是 一种典型的中温NH3-SCR 催化剂[4]。但该类催化剂存在着工作温度窗口窄且温度高(350~400 ℃)、氮气选择率低等不足。因此,更多的研究人员将研发方向集中在开发低温高活、性能稳定、成本低、环境友好的NH3-SCR 催化剂。
目前,根据低温脱硝催化剂的活性组分来分主要有贵金属催化剂、过渡金属催化剂两大类。贵金属催化剂主要以Pt、Pd、Rh 等[5]贵金属为活性组分,虽然具有较好的低温脱硝活性,但N2选择性较差,且易SO2中毒,再加之成本较高,该类催化剂未能在燃煤烟气等固定源脱硝领域得到广泛应用。相对而言,过渡金属催化剂因选择性好、转化率高、抗硫抗水性较好[6]、成本低成为目前低温NH3-SCR 脱硝技术中研究及应用最为广泛的催化剂类型。
过渡金属元素的价层电子轨道大多在d 层和ds层,因d 层电子更易于向NH3和O2转移电子,在低温下诱导促进NH3-SCR 反应的进行,因而表现出优良的氧化还原性能。除此以外,与贵金属催化剂相比,过渡金属元素兼具价格低和热稳定性高的优势,因此被研究者广泛地应用到低温NH3-SCR 反应中[7]。在早期的实验中,研究了很多过渡金属元素,如Fe、Cu、Mn、Cr、Co、Ni 等[8-9],由于Mn 元素价态多变,氧化还原性能优良引起研究者广泛关注。研究发现锰系催化剂在低温段表现出良好的脱硝性能,但是极易被烟气中的SO2影响导致失活,脱硝率急剧下降且失活过程大多不可逆,低温下烟气中的水蒸气也会对NH3-SCR 催化剂的活性造成影响。因此,对Mn 基低温脱硝催化剂进行改性,增强其低温活性、 提高抗硫毒和水抑制能力的新型Mn 基催化剂是近些年研究的重点,主要体现在两方面:一是引入一种或多种过渡金属氧化物来修饰锰基催化剂,形成过渡金属复合氧化物,通过元素间诱导协同作用来增强反应的活性位点[10-11];二是合成复合载体材料,分散过渡金属基氧化物,通过金属-载体相互作用提高活性[12-13]。
本文系统地综述了近几年国内外低温NH3-SCR 反应中过渡金属Mn 基催化剂的研究进展,较为全面地总结了该系列催化剂Mn 元素及其他过渡金属元素在不同组合结构中对催化剂性能的影响,分析了过渡金属Mn 基催化剂在低温NH3-SCR 反应中的脱硝活性机理及抗SO2、H2O 的性能机理。
1 二元过渡金属Mn 基氧化物催化剂
由于Mn 的单一金属氧化物的比表面积小、热稳定性差,研究者们更多地将Mn 系低温脱硝催化剂的性能提升放在多金属组合的氧化物上。最常用的方法是通过掺杂其他金属,比如Sn、Cr、Co、Fe、Cu、Ni、Ce 等[14-16]过渡金属,改善Mn 单一金属氧化物,使其具有良好的催化性能而被广泛用于低温NH3-SCR 反应。
Tang 等[17]采用氧化还原共沉淀法制备出的MnOx-SnO2复合氧化物具有较高的脱硝活性,可能是由于其含有高价态Mn4+或高价态Sn4+,实验结果证实Mn 元素不同价态的脱硝活性由大到小顺序为:MnO2、Mn5O8、Mn2O3、Mn3O4。经分析得知,在低温NH3-SCR 反应中,L 酸位是其催化活性高的关键,MnOx-SnO2复合氧化物中Sn4+比Mn4+表现出更强的L 酸位,因而对NH3具有更强的吸附作用。当NH3吸附在Sn4+上,更易与MnOx中的晶格氧反应生成氨氧基中间产物,经过Eley-Rideal 途径最终生成N2和H2O,因而极大提高了催化活性。Chen 等[18]研制出一种CrMn1.5O4尖晶石相的复合氧化物,使其在低温120 ℃脱硝转化率可达98%以上,显著降低了NH3-SCR反应的还原温度。在抗硫性实验中,SO2通入后催化剂活性有所降低,但停止通SO2后脱硝活性迅速恢复,表现出优异的抗硫可逆性,主要是由于CrMn1.5O4尖晶石相形成了Cr-Mn 高氧化还原电位对,促进了Cr与Mn 之间的电子传递,从而加速了催化剂活性的恢复,对SO2导致的催化剂失活能有效再生。
Zhang 等[19]通过金属和有机溶剂合成了立方状空心MnxCo3-xO4纳米颗粒催化剂,见图1。在150~300 ℃的NH3-SCR 反应中,通过对比分析金属比例相同的空心MnxCo3-xO4纳米颗粒和实心纳米颗粒,发现空心纳米颗粒的脱硝活性为100%且呈现出更高的N2选择性。在175 ℃时,同时通入H2O 和SO2,空心纳米颗粒的性能均优于实心纳米颗粒,且在抗硫性测试中,空心纳米颗粒在停止通入SO2后,几乎恢复到原来的脱硝活性。究其原因,空心MnxCo3-xO4纳米颗粒具有较好的低温脱硝活性和抗硫性能,归因于催化剂的空心结构及有层次的多孔结构,为反应气体的吸附和活化提供了更大的比表面积和更多的活性中心,同时,Co 和Mn 离子之间的协同作用能够抑制催化剂表面硫酸盐的形成。

图1 利用Mn3[Co(CN)6]2·nH2O 纳米前驱体合成中空结构的MnxCo3-xO4 纳米颗粒[19]
Li 等[20]在Mn2O3中掺杂Fe2O3制备出尖晶石晶相的均匀六角微片结构催化剂。此种Fe2O3-Mn2O3催化剂表现出很好的脱硝活性,在200 ℃时NO 转化率高达98%,H2O 对其影响为可逆抑制。此外,在抗硫性测试中,脱硝活性仅下降了10%,停止通入SO2气体后NO 转化率最终恢复到90%以上。分析发现,Mn 元素嵌入Fe2O3的六方晶格中,在内部结构中Mn和Fe 两种离子之间形成协同作用,Mn 的掺杂不仅产生了更多的化学吸附氧,见图2a,还能提高整个氧化还原循环中活性金属离子的含量,从而增强脱硝的催化能力。此外,由图2b 可看出,Fe2O3中掺杂微量Mn2O3形成的复合晶体结构,尺寸均匀、表面光滑,不利于硫酸盐附着,也是增强其抗硫性的重要原因。Fang 等[21]利用浸渍法制备出尖晶石相的CuMn2O4催化剂,在180 ℃时脱硝活性接近100%,也是由于尖晶石内部Cu-Mn 离子之间强烈的协同作用,有利于内部电子转移,从而增强脱硝催化活性。

图2 NH3 与NO 在Mn(0.2)-FeOx 六方晶片上的反应机理(a)及Mn(0.2)-FeOx 六方晶片的SEM 图(b)[20]
Han 等[22]采用溶剂热法制备出独特的NiMn2O4三壳空心球,由于其特殊的3 层壳结构,所制备的NiMn2O4催化剂表现出优越的低温脱硝活性,在较宽的脱硝温度100~225 ℃范围内氮氧化合物去除率达到90%以上。分析其原因是由于三层空心壳结构使其具有极高的比表面积,从而提供了更多的Mn4+活性位点。在抗水性和耐硫性检测中,水对NiMn2O4催化剂的活性影响较小且为可逆过程,但通入SO2后催化剂的活性下降较明显,停气后活性虽然会上升,但不能完全恢复至最初状态。
Gao 等[23]采用柠檬酸法制备出微介孔尖晶石相CrMn2O4催化剂,在100~225 ℃脱硝转化率接近100%,200 ℃的抗硫抗水实验中,20 h 脱硝转化率为72%±3%。CrMn2O4催化剂优异的脱硝活性得益于微介孔尖晶石结构产生了更大的比表面积,增加了Mn3+/Mn4+的活性位点,加快Cr5++2Mn3+⇌Cr3++2Mn4+之间的电子传递,进而提高脱硝活性。他们认为微介孔尖晶石相CrMn2O4催化剂具有耐硫性的原因,一方面是Cr3+对Mn 起到一定的保护作用,另一方面催化剂表面生成的-HSO3和SO42-向H…SO42-的转变过程中,产生了新的B 酸性位点,引发NO2与NH4+快速反应生成NH4NO2,分解为N2和H2O,进而增强催化剂在SO2中的脱硝活性。
二元过渡金属氧化物在增强脱硝催化活性方面,一是可以转化为尖晶石结构,诱导加强过渡金属离子与Mn 之间的协同作用,促进电子转移,提高催化剂再生活性; 二是通过改变复合氧化物的结构形貌,增大比表面积,可以增加活性位点,进而提高脱硝转化率。
2 多元过渡金属Mn 基氧化物催化剂
在Mn 基两种金属氧化物的基础上继续改进,可以引入其他过渡金属元素形成多元过渡金属Mn基复合氧化物而加强各项性能。如表1 所示,通过引入多种过渡金属进而产生更多的化学吸附氧,加强活性元素之间的电子传递,来提高脱硝活性和抗硫抗水性引发新的反应机理[24-31]。
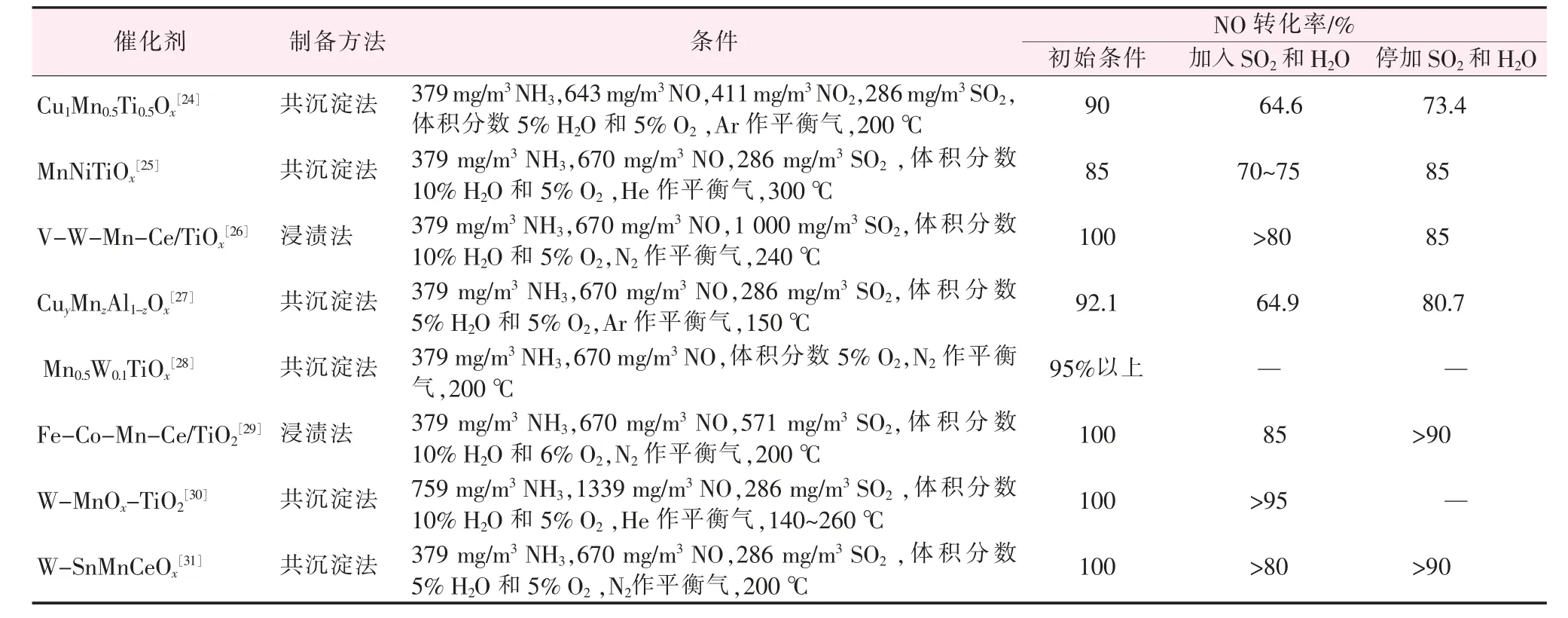
表1 引入多种过渡金属对催化剂脱硝活性和抗硫抗水性的影响
France 等[32]以混合金属盐溶液蒸干制备的Ce-Fe-MnOx复合氧化物,在NH3-SCR 反应中可形成稳定的化学吸附态的氮物种,从而抑制了硫酸盐的形成,提高了抗硫性能。Liu 等[33]利用水热法制备的Mn0.2Ce0.1Ti0.7Ox复 合 氧 化 物,在150 ~350 ℃的NH3-SCR 反应中,脱硝活性超过90%,N2的选择性在此温度范围内达到100%,在通入H2O 和SO2之后,脱硝活性依然在90%以上,停止H2O 和SO2进气后,脱硝活性基本完全恢复。这是由于Mn0.2Ce0.1Ti0.7Ox复合氧化物中含有高比例的Ce3+和Ti3+,在催化剂表面会产生更多的化学吸附氧,促进了气相氧的吸附和活化,同时复合氧化物中的Mn4+有利于在催化剂上形成NH4+从而增强催化剂的脱硝活性。
Gao 等[34]以碳酸铵为沉淀剂,将Cu、Co、Cr、Ni、Fe、Sn、Mg 元 素 与Mn、Ce 元 素 进 行 共 沉 淀 制 备M1Mn4Ce5Ox(M=Cu、Co、Cr、Ni、Fe、Sn、Mg),在进料相同、掺杂不同金属催化剂的脱硝实验中,Co、Ni 掺杂的催化剂活性最高。分析发现,Co、Ni 掺杂的催化剂具有更高的比表面积、更多的化学吸附氧和活性中心而且活性位点中n(Ce4+)/n(Ce3+)更高,因此使其具有更高的脱硝性能;在抗硫性能上,经Co1Mn4Ce5Ox和Ni1Mn4Ce5Ox上吸收NOx,首先形成的是不受SO2影响的双齿硝酸盐,进而转化为单齿硝酸盐,产生新的B 酸位再生成NH4+,因此具有良好的抗硫性。
Fang 等[35]利用共沉淀法制备出Fe0.3Mn0.5Zr0.2Ox复合氧化物,在200~360 ℃时NO 脱除率能达到100%且保持80 h;在200 ℃通入SO2时,催化剂的脱硝活性为98%保持了24 h;当SO2增加一倍时,脱硝活性为95%保持了25 h,由此可见催化剂有非常强的抗SO2能力。据其分析,非晶态的MnO2和Fe2O3均起到表面活性位点的作用,而载体ZrO2和活性组分可通过Fe、Mn 和Zr 之间的协同作用加快电子转移,Fe 与Mn 之间较强的相互作用促使部分电子更倾向于从Fe 向Mn 的转移,产生的高氧化态的Mn更容易被还原。低温时价态较低的Mn 很容易将电子转移到吸收的O2上,这导致表面晶格氧(O)的储存和迁移增加,Fe、Mn 和Zr 之间通过协同作用不仅提高了脱硝活性,而且使SO2不易在催化剂表面转化成硫酸盐沉积[36]。
Yao 等[37]采用一步共沉淀法合成CeO2-MnOx-Al2O3复合氧化物。结果显示,在CeO2-MnOx混合氧化物中加入少量的Al 元素,有助于减小复合氧化物的晶粒尺寸增大其比表面积,继而增加了作为活性中心的Ce3+和Mn4+的总数量。Lee 等[38]采用浸渍法制备出不同n(Ce)/n(Mn)的Ce/Mn-TiO2催化剂,Ce/Mn-TiO2催化剂与Mn-TiO2相比脱硝活性明显提升,这是由于催化剂仅为Mn-TiO2两种组分时,部分MnO2颗粒易进入到TiO2的孔道内,而无法发挥表面催化氧化的作用,不利于NH3-SCR 反应的进行;当掺杂适量CeO2之后,由于CeO2遮挡住了TiO2的孔道,导致MnO2无法进入孔道而均匀分散在TiO2的表面,增强了表面催化氧化活性;但CeO2的添加过量时,金属氧化物之间发生强烈的相互作用,导致MnO2聚集结块不能均匀分布在TiO2的表面,使其催化活性降低。
多元过渡金属掺杂的复合氧化物,在增强脱硝活性方面,主要依据金属离子之间的协同作用,加快不同元素之间电子的转移,从而产生更多的金属活性中心和表面晶格氧,加快NH3-SCR 反应的进行。此外,多金属之间的强协同作用,还能有效抑制SO2在催化剂表面产生沉积硫酸盐,增强其抗硫性能。
3 负载型多元过渡金属Mn 基催化剂
对于依赖表面催化氧化的NH3-SCR 反应,催化剂的比表面积的大小决定了活性位点的多少,研究者为改善过渡金属氧化物本身比表面积小的问题,引入了比表面积大的载体,合成负载型过渡金属催化剂。由于活性组分在载体表面具有良好的分散性,以及活性组分与载体之间的协同作用,使得载体催化剂的性能优于未加载体的过渡金属氧化物。因此,通过将过渡金属氧化物分散在不同的载体材料上以增强脱硝性,获得越来越高的关注度。目前,常见载体有Al2O3、TiO2、SiO2、分子筛和纳米管材料等。
3.1 以Al2O3 为载体
Wang 等[39]配制金属混合盐溶液,通过喷雾干燥法制备MnO2-CeO2-Al2O3,由于喷雾干燥过程中水快速蒸发,球形颗粒分布着大量的塌陷孔隙,比表面积增大,活性元素分散均匀,反应活性增强,在150 ℃下脱硝转化率为97.4%,氮气的选择性为94.5%。Smirniotis 等[40]研究了包含Al2O3在内的不同载体负载过渡金属催化剂,在低温NH3-SCR 反应中Mn/锐钛 矿TiO2活 性>Mn/金 红 石TiO2活 性>Mn/γ-Al2O3活性>Mn/SiO2活性,经过表征分析,载体对催化剂表面的Lewis 酸性位及其Mn4+的表面浓度的影响,对提升低温脱硝反应性能有重要意义。Schill 等[41]采用浸渍法和共沉淀法分别制备Mn0.75-Fe0.25/Al2O3和Mn0.75-Fe0.25/TiO2两种催化剂,并进行性能的对比。研究发现,共沉淀法制备的两种催化剂脱硝活性均高于浸渍法,共沉淀法所制备催化剂的活性在180 ℃时与工业催化剂在220 ℃的活性基本一致。此外,陈焕章等[42]采用共沉淀法制备的Mn-Fe/γ-Al2O3催化剂,γ-Al2O3载体介孔结构丰富,比表面积大,活性组分MnOx、FeOx以无定形结构高度分散于载体的内外表面,所形成的催化剂具有良好的低温活性。孟刘邦等[43]以分步共混法制备Mn-Ce/TiO2、Mn-Ce/SiO2及Mn-Ce/Al2O33 种均质整体式催化剂,3 种催化剂比表面积从大到小依次为Mn-Ce/TiO2、Mn-Ce/SiO2、Mn-Ce/Al2O3,表面上酸量从大到小依次为Mn-Ce/TiO2、Mn-Ce/SiO2、Mn-Ce/Al2O3,在低温80~100 ℃时Mn-Ce/TiO2和Mn-Ce/SiO2的脱硝活性均大于Mn-Ce/Al2O3,但N2选择性Mn-Ce/TiO2大于Mn-Ce/SiO2,可见,载体的比表面积和表面酸量大小是影响脱硝活性的关键因素。
3.2 以TiO2 为载体
Pena 等[44]尝试利用多种过渡金属元素(V、Cr、Mn、Fe、Co、Ni 和Cu) 分别负载在TiO2上用于低温脱硝反应,其中Mn/TiO2催化剂脱硝活性最高、抗水性最强。刘纳等[45]以氧化沉淀-浸渍法制备Fe-Mn/TiO2催化剂,Fe 元素的掺入能有效改善Mn-TiO2的微观结构,降低团聚,增大比表面积,更利于气体的吸脱附。Liu 等[46]采用溶胶凝胶法制备的Mn/TiO2和Mn-Eu/TiO2催化剂具有高脱硝活性。在对Mn/TiO2和Mn-Eu/TiO2催化剂的硫化实验中发现,在SO2存在下Mn-Eu/TiO2催化剂上的NH3-SCR 过程是通过Langmuir-Hinshelwood 途 径 进 行,Mn-Eu/TiO2催 化剂能有效抑制表面硫酸盐的生成。Xu 等[47]采用浸渍法制备的Ce-Mn/TiO2催化剂以不同负载量的Ce 元素为考察对象。180 ℃下Ce(20)-Mn/TiO2脱硝率为99.7%,通入SO2的5 h 后,Ce(20)-Mn/TiO2的脱硝率仍维持在94%,在停止通入SO2后,催化剂能快速恢复到之前的活性。催化剂表面广泛分布的Mn 和Ce元素使硫酸盐无法沉积在催化剂表面,是其具有良好抗硫性的重要因素。此外,Xu 等[48]还将Fe 元素以浸渍法负载在Ce-Mn/TiO2催化剂上,100 ℃时其脱硝率为96%,120~160 ℃脱硝率达到100%,Fe 元素的加入极大地降低了NH3-SCR 的反应温度。Xu 等[49]以含TiO2高炉渣为载体采用浸渍法制备了一系列MnOx-CeO2/TiO2催化剂,结果显示,元素Mn、Ce 和含TiO2的高炉渣之间存在强烈的相互作用,使活性组分以非晶态形式分散在表面,使其比表面积增大,孔容孔径适中。同时,Ce 元素掺入使还原峰向低温偏移,降低脱硝温度,Mn 元素增加了强酸位点的数量,增强了氧化还原能力,由于高炉渣本身的结构特性,能有效阻断H2O 对活性的影响,增强了抗水性。
3.3 以分子筛为载体
分子筛的种类繁多,是目前催化剂中常用的一种多孔材料。Li 等[50]以粉煤灰衍生的SBA-15 分子筛为载体,采用水热-浸渍两步法制备了Fe/Mn-SBA-15 催化剂。结果显示,两种金属复合负载的催化剂脱硝活性明显高于单一金属负载的催化剂。200~250 ℃时Fe/Mn-SBA-15 催化剂脱硝转化率超过90%,其高活性的原因是Fe 和Mn 离子之间形成协同作用加快电子转移形成新的金属活性中心,且在催化剂表面形成的硝酸双齿配合物可以转化成新的酸性中心,从而提高氮氧化合物的脱除率。黄增斌等[51]采用浸渍法以β、ZSM-5 和USY 分子筛为载体制备了Mn-Ce 负载型催化剂。低温下3 种负载型催化剂中Mn-Ce/USY 的脱硝活性最为优异。一方面原因是催化剂表面弱酸对低温NH3-SCR 反应起主要作用,弱酸量从大到小顺序为Mn-Ce/USY、Mn-Ce/β、Mn-Ce/ZSM-5;另一方面由于Mn-Ce/USY 催化剂表面n(Mn4+)/n(Mn3+)最大,且吸附氧表面浓度也最高,因而该催化剂具有最高的低温脱硝活性。Zhou 等[52]通 过 溶 液 浸 渍 法 制 备Fe-Ce-Mn/ZSM-5脱硝催化剂,在200 ℃时脱硝活性达到96%以上,增加浸渍液中锰元素的含量,催化剂的低温脱硝活性有明显提升。从红外实验中可知Mn 元素的引入增加了催化剂表面的B 酸位,有利于反应中NH3的吸附,添加Fe、Ce 元素可提高表面晶格氧,促进Mn2O3向MnO2转化,两者协同促进低温下NH3的氧化。通过红外实验结果提出来两种可能的反应途径: 一种是NO2在B 酸位上与NH4+反应形成NO2[NH4+]2再与NO 反应生成N2和H2O; 另一种是吸附的NH3与NO/HNO2反应生成不稳定中间体NH4NO2和NH2NO,分解为N2和H2O。
3.4 以其他材质纳米管为载体
Boningari 等[53]采用水热法和浸渍法合成了一系列过渡金属氧化物负载的二氧化钛纳米管M/TNT(M=Mn、Cu、Ce、Fe、V、Cr 和Co)催化剂。Mn/TNT催化剂对NO 有着非常好的低温脱硝活性,在100~250 ℃脱硝率均能达到100%。与传统TiO2负载Mn相比,Mn/TNT 催化剂具有更高的脱硝活性,主要是由于其表面分布着丰富的Mn4+有利于低温脱硝反应的发生。Zhang 等[54]采用改性浸渍法在碳纳米管(CNT)负载的MnOx和CeOx纳米颗粒(NPS)上涂覆介孔TiO2层,获得了具有高催化活性的核-壳结构催化剂。一方面多孔结构的特性为吸附反应提供了更大的比表面积,增加了活性位点,提高脱硝活性,同时具有介孔结构的TiO2膜作为一个天然的屏障,能有效抑制金属氧化物的聚集,增强其热稳定性;另一方面MnOx、CeOx、氧化钛涂层和CNT 之间的相互作用不仅避免了硫酸铵盐在表面的沉积,而且抑制催化剂活性位点产生硫酸锰,从而增强了抗硫性。Lee 等[55]采用共沉淀法将Mn 和Fe 元素分别负载在TNT 和TiO2粉末上,对比两者的性能发现Fe-Mn/TNT 的抗硫性明显优于Fe-Mn/TiO2的主要原因是n(Mn4+)/n(Mn3+)高及比表面积大,此外,TiO2的晶相和金属颗粒在TNT 上的良好分散增加了催化剂表面B 酸位的数量,有利于NH3的吸附及后续氧化反应的发生。
4 结束语
目前,以NH3为还原剂的NH3-SCR 低温脱硝技术中,锰基催化剂因其低温高效的特点,适用于低尘低硫的环境。但由于反应温度窗口的降低,烟气中SO2转化的硫酸盐不易分解,且与Mn 活性位点结合后失活不可逆,是当前锰基低温脱硝催化剂技术的一个瓶颈。本文通过对过渡金属锰基催化剂进行综述,分析不同过渡金属元素助剂对锰基低温脱硝催化剂的结构、脱硝活性及抗硫性能的影响,得出未来低温脱硝催化剂的研究方向主要为: 对于过渡金属复合氧化物可转化成规则的晶型结构,诱导加强过渡金属离子与Mn 之间的协同作用促进电子转移增加表面晶格氧,抑制硫酸盐沉积,提高低温下催化剂抗硫再生活性;另一方面可以通过调整制备工艺,改变催化剂结构形貌和酸位,增大比表面积,增加活性位点数且使其呈高度分散,进而增强低温脱硝活性;再者可以通过掺杂更多新的助剂引发新的脱硝机理。尽管催化剂在抗硫抗水方面取得了显著进展,但在低温环境、SO2和H2O 同时存在下,大多数过渡金属基催化剂的抗硫抗水性较低,耐久性仍有待提高,SO2和H2O 的抑制机理尚不清楚。因此,研究人员应不断探索过渡金属基混合氧化物和活性过渡金属/金属复合载体的不同组合,以待开发出更好的低温NH3-SCR 抗硫抗水的催化剂。
