改良的qPCR检测水痘-带状疱疹病毒的临床应用*
2021-01-04钟婷婷任虎席瑞阑许飏
钟婷婷,任虎,席瑞阑,许飏
[1.绵阳市第三人民医院(四川省精神卫生中心) 皮肤科,四川 绵阳 621000;2.西南医科大学附属医院 皮肤科,四川 泸州 646000]
水痘-带状疱疹病毒(varicella-zoster virus, VZV)可导致水痘和带状疱疹[1],监测VZV 有助于评价其传染性[2]。VZV 是医院感染的常见病毒之一,而血液病毒检测有助于早期诊断[3-4]。早期持续性监测外周和中枢VZV DNA 水平变化,对判断病毒性脑膜炎和病毒性脑炎病情进展十分重要[5]。目前qPCR 试剂盒成本高昂,难以得到普遍应用[6],急需一种快捷、经济、有效的VZV 检测方法。有研究利用巢式PCR 从病毒感染宿主血液中得到DNA,经纯化后作为标准品用于病毒核酸的qPCR 检测[7]。本研究据此设计一种改良的qPCR,与VZV DNA 试剂盒进行对比,并进一步分析其临床应用。
1 资料与方法
1.1 一般资料
选取2017年5月—2017年7月在西南医科大学附属医院就诊的带状疱疹患者31例。诊断标准参考《中国临床皮肤病学》[8]。患者均无认知障碍,同意参与本研究,并接受标准伐昔洛韦抗病毒治疗方案。伐昔洛韦(西班牙Glaxo Wellcome, S.A.公司,批号H20150209)1 000 mg/次,3 次/d,连续7 d)[9]。
1.2 主要试剂及仪器
血液/细胞/组织基因组DNA 提取试剂盒(离心柱型)及引物购自北京天根生化科技公司,PCR Master Mix(2X)试剂购自北京博迈德生物公司,琼脂糖凝胶试剂购自北京沃比森科技有限公司,VZV 的qPCR 试剂盒(Taqman 探针法)购自上海之江生物科技股份有限公司。实时荧光定量PCR 仪购自美国ABI 公司,设计引物的Primer Premier 6.0 软件购自美国Premier 公司。
1.3 标本采集和处理
采集带状疱疹患者的疱液标本,利用离心柱法提取其DNA。采集临床VZV 感染患者的外周血标本,分离出外周血单个核细胞(peripheral blood mononuclear cell, PBMC)和血浆,用离心柱法提取PBMC 和血浆中的DNA。
1.4 巢式PCR 和凝胶电泳制备标准品
标准品引物1 正向引物:5'-GATCTCGGGT TCGCCTTTA-3',反向引物:5'-CCAGAGCATTCGC GTTGTA-3',长度489 bp;标准品引物2 正向引物:5'-ATCTCGGGTTCGCCTTTAC-3',反向引物:5'-TGGC ATAACACCACCGTCT-3',长度404 bp;标准品引物3正向引物:5'-CTCGGGTTCGCCTTTA-3',反向引物:5'-ACACCACCGTCTAGTCTTAA-3',长度395 bp。巢式PCR 反应体系:疱液DNA 样品5μl,正反向引物各1μl,2×MasterMix 12.5μl,ddH2O 5.5μl;反 应条件:94℃预变性3 min,94℃变性30 s,55℃退火30 s,72℃延伸5 min,共30 个循环。DNA 产物在4℃下保存。琼脂糖凝胶电泳步骤:配置1.5%琼脂糖,装入锥形瓶放入微波炉中加热溶解,待冷却后倒入模具,常温下放置30 min,拔除模具卡槽并将琼脂糖凝胶放入1×TAE,加入Marker Ⅰ和DNA 产物在120 V下电泳约20 min,取出琼脂糖胶块并在紫外灯下显影,胶块上300 ~400 bp 为所需标准品的区间,切下该区间的琼脂糖,通过胶回收得到标准品。采用紫外分光光度计检测标准品浓度,标准品定量为6.02×1023(拷贝/mol)×质量浓度(g/ml)/(DNA 长度×660)。
1.5 改良的qPCR
根据VZV DNA 保守序列ORF59 设计出正向引物:5'-CGGTTGGGTTGTCTTCTGTG-3',反向引物:5'-GCGACGAACCGTAAGCGTGG-3',长度1 955 bp。改良的qPCR 反应体系:VZV DNA 样品1μl(梯度稀释的标准品及PBMC、血浆中提取的DNA)、正反向引物各0.3μl、MasterMix(SYBR Green 法)10μl 和ddH2O 8.4μl;反应条件:95℃预变性2 min,95℃变性1 min,60℃退火30 s,72℃延伸2 min,共40 个循环。qPCR 检测下限为15.5 拷贝/μl。熔解曲线:95℃变性1 min,55℃冷却1 min,使DNA 双链充分结合,最后从55℃逐步加热至98℃,每一步增加0.5℃并保持10 s,同时采集荧光信号。
1.6 VZV DNA 试剂盒
采用Taqman 探针法qPCR,反应体系:混合液35.0μl、酶(Taq+UNG)0.4μl 和样品4.0μl(梯度稀释的标准品及PBMC、血浆中提取的DNA)。反应条件:94℃预变性2 min,93℃变性15 s,60℃退火60 s,共40 个循环。
1.7 统计学方法
数据分析采用SPSS 20.0 统计软件。计数资料以率(%)表示,比较用Fisher 确切概率法,P<0.05 为差异有统计学意义。
2 结果
2.1 标准品分析
在3 次巢式PCR 反应中,分别加入标准品引物1、标准品引物2 和标准品引物3。在第1 次PCR 反应中利用疱液中的VZV DNA 作为模板,得到大小为489 bp 的产物1 ;在第2 次PCR 反应中以产物1作为模板,得到大小为404 bp 的产物2;在第3 次PCR 反应中以产物2 为模板,得到大小为395 bp的产物3,即标准品。以上产物在凝胶电泳实验中均无杂带出现(见图1)。标准品经测序,并与VZV DNA 进行比对,发现两者匹配程度高,且匹配片段相似性良好,标准品被匹配的碱基数占比为99%(见图2)。故利用巢式PCR 制备的产物3 纯度、特异性和稳定性均良好,可以用作qPCR 实验的标准品。

图1 3 次巢式PCR 扩增产物凝胶电泳结果

图2 Blast 检测标准品碱基与VZV DNA 碱基的配对
2.2 改良的qPCR 反应的标准曲线、扩增曲线及熔解曲线
以巢式PCR 制备的产物3 作为标准品,并梯度稀释(1×100、1×101/2、1×101、1×102、1×103),然后采用改良的qPCR 进行检测。其中标准曲线决定系数R2=0.9999,回归方程Y=-3.9367X+45.07。见图3~5。
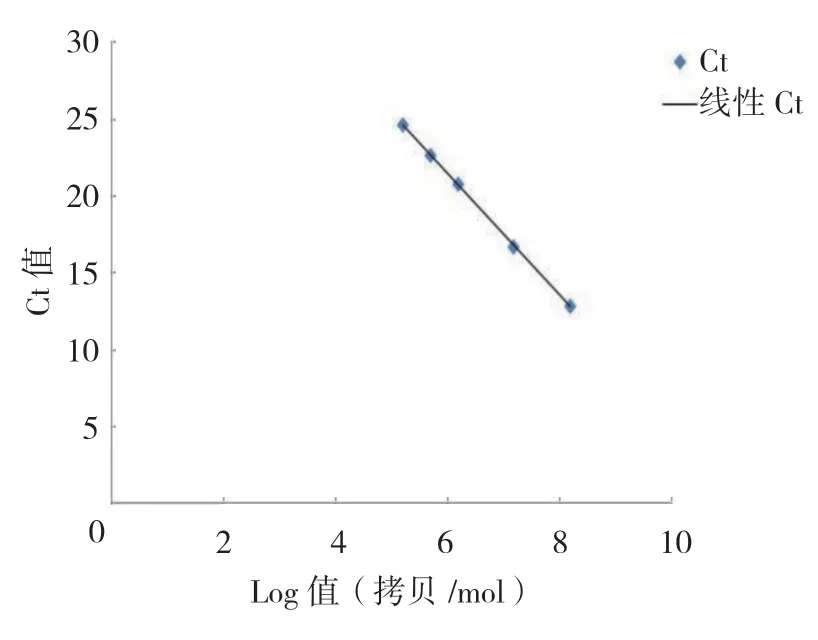
图3 改良的qPCR 反应的标准曲线
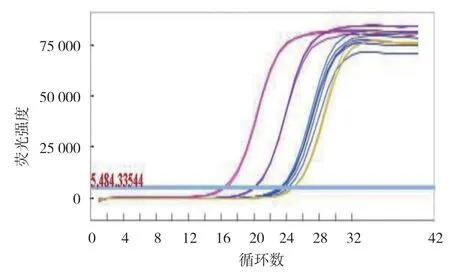
图4 改良的qPCR 反应的扩增曲线
2.3 两种VZV DNA 检测方法比较
随机抽取15例带状疱疹患者,分离出PBMC 标本,分别采用改良的qPCR 与VZV DNA 试剂盒检测PBMC 中VZV DNA 阳性率。2 种方法的阳性率均为73.3%(11/15),经Fisher 确切概率法检验,差异无统计学意义(P=1.000)。2 种检测方法效果相近。
2.4 2 种标本治疗前后的VZV DNA 阳性率变化
随机抽取22例带状疱疹患者,分离出PBMC 和血浆标本,采用改良的qPCR 检测伐昔洛韦抗病毒治疗前后VZV DNA 的阳性率。在治疗前、治疗后,PBMC 与血浆的VZV DNA 阳性率比较,经Fisher 确切概率法检验,差异均无统计学意义(P>0.05),表明血浆可替代PBMC 进行VZV DNA 的检测。PBMC、血浆标本治疗前与治疗后VZV DNA 阳性率比较,差异均无统计学意义(P>0.05),表明伐昔洛韦抗病毒治疗方案未降低VZV DNA 水平。见表1。
3 讨论
VZV 属于人类疱疹病毒3 型,其DNA 相对分子质量大小约为12 000 bp。目前普遍使用qPCR 进行VZV DNA 的定量检测,qPCR 操作简便,敏感性和特异性高,其标准品可为质粒和纯化的DNA[10]。DWORKIN 等[11]在 进 行VZV DNA 的qPCR 检 测 时,使用SYBR Green Ⅰ作为染料,选用VZV DNA 的保守区域ORF59 设计特异性引物,并采用纯化的病原体作为标准品。本实验中qPCR 所用的染料和引物均与之相同,但独创之处在于笔者使用巢式PCR制备标准品,并通过凝胶电泳及基因序列比对,验证了所得DNA片段的纯度和特异性。而质粒作为标准品,制作工艺复杂且成本较高,所以本研究选取上述DNA 片段作为标准品[12]。另外,带状疱疹患者VZV DNA 检测结果表明,PBMC 与血浆标本的阳性检出率无差异,鉴于血浆的获取更加便捷,所以临床或许可以采用血浆代替PBMC。国外的研究表明,血液中大约39% VZV DNA 存在于血液细胞外成份中,这也是血浆能够用于检测VZV DNA 的理论依据之一[13]。
国外有研究表明,带状疱疹患者留取皮肤病变、PBMC 和血浆标本进行VZV 检测,所有患者检测阳性[14]。本研究从带状疱疹患者皮肤病变中获得标准品进行qPCR,从PBMC 和血浆中检测VZV DNA 效果良好,且抗病毒治疗前后PBMC 和血浆标本中VZV DNZ的阳性检出率未显著下降,通过Taqman 探针法也得出了相同结果,这或许与抗病毒治疗时间和随访时间较短有关[9]。笔者下一步研究将扩大样本量、延长抗病毒治疗时间和随访时间,以观察VZV DNZ 的阳性检出率变化。
目前临床对于带状疱疹的抗病毒治疗往往需要等到疱疹出现并确诊带状疱疹后才开始进行,而疱疹的出现标志着带状疱疹病程已进入中后期,故难以实现抗病毒疗效的最大化。最近研究表明,若带状疱疹患者出现发热、疲劳不适等全身症状,则提示病毒血症,结合血液病毒检测阳性结果,即具备抗病毒治疗指征[15]。带状疱疹合并病毒血症,容易导致带状疱疹患者预后不良,且外周血VZV 病毒载量与带状疱疹后遗神经痛发生率呈正相关[16]。带状疱疹患者合并病毒血症的早期抗病毒治疗有助于缩短病变愈合时间;带状疱疹患者发病72 h 内实施抗病毒治疗,能够实现疗效的最大化,显著降低外周血VZV DNA 水平,并有助于缓解带状疱疹相关性疼痛[14]。
值得注意的是,带状疱疹患者唾液中VZV DNA的拷贝数和带状疱疹相关性疼痛亦存在关联[13,17]。通过接触带状疱疹患者的唾液及呼吸道分泌物,非免疫人群可感染VZV 并发生带状疱疹[18],故带状疱疹患者咽拭子或唾液中VZV DNA 的分布情况和诊断价值,以及带状疱疹发病72 h 内抗病毒治疗降低唾液等分泌物中VZV DNA 的效果等尚需要进一步研究。另外,对于患有水痘且合并病毒血症的孕妇,VZV 可透过胎盘屏障并对胎儿的生长发育造成不良影响[19]。下一步笔者将研究带状疱疹孕妇患者合并病毒血症对胎儿的影响,并探索咽拭子和唾液标本对带状疱疹的诊断价值等,以深入了解带状疱疹的致病性和传染性。
