电刺激对失重导致的废用性骨骼肌萎缩的影响
2021-01-04石海旺刘承宜
石海旺,段 锐,刘承宜
(华南师范大学体育科学学院,广州 510006)
骨骼肌萎缩是由于去神经支配、损伤、关节固定、长期卧床休息、衰老以及癌症恶病质等相关因素引起的骨骼肌质量的下降[1]. 骨骼肌质量变化取决于骨骼肌相关蛋白质的合成与降解之间的动态平衡关系,一旦平衡关系被打破,骨骼肌合成与降解之间出现失衡,将导致骨骼肌萎缩或骨骼肌的非正常肥大[2]. 在一般人群中,骨骼肌萎缩常见于废用性,这种状态会使骨骼肌由于外界刺激减少导致骨骼肌蛋白质合成速率下降,使骨骼肌纤维横截面积下降及纤维类型转变[2]. 骨骼肌的生长和萎缩主要取决于磷酸肌醇3-激酶(Phosphatidylinositol 3-Kinase, PI3K)的活性,它是哺乳动物雷帕霉素蛋白(Mammalian Target of Rapamycin, mTOR)信号通路的作用靶点[3-4],通过一系列的级联反应激活基因转录,通过IGF1-PI3K-Akt/PKB-mTOR 信号通路促进骨骼肌蛋白质合成,增加骨骼肌质量[5]. 骨骼肌蛋白质降解途径主要由泛素-蛋白酶体(Ubiquitin-Proteasome System,UPS)和自噬-溶酶体(Autophagy-Lysosome Pathway, ALP)2种途径介导[6]. 其中Muscle RING Finger 1(MURF1)和 Muscle Atrophy F-Box(MAFbx) 是骨骼肌和心肌特异性的2种E3泛素蛋白连接酶[7],在骨骼肌萎缩过程中发挥重要作用. 叉头转录因子(Forkhead Box O, FOXO)是已知的细胞应激反应因子,FOXO3活化足以引起肌肉质量的剧烈减少[8-9],另一个促进骨骼肌蛋白质降解的关键因子是肌肉生长抑制素,肌肉生长抑制素是转化生长因子-β(Transforming Growth Factor-β,TGF-β)家族成员,是骨骼肌生长发育的负调控因子,敲除肌肉生长抑制素会促进骨骼肌肥大,增加骨骼肌质量[10].
从20世纪60年代开始,电刺激进入医疗保健相关领域,包括各种物理医学与康复等. 其中,骨骼肌电刺激(Muscle Electrical Stimulation,MES)被广泛用于增加骨骼肌质量和纤维横截面积,防治由于长期卧床或者处于失重状态下的废用性肌萎缩[11],然后逐渐发展成为预防骨骼肌萎缩的有效干预方式[12]. MES主要分为高频电刺激(High Frequency Electrical Stimulation,HFES )和低频电刺激(Low Frequency Electrical Stimulation,LFES ),其中LFES可以预防并减少废用性骨骼肌质量丢失;HFES可以维持骨骼肌张力、增加肌肉质量以及骨骼肌纤维横截面积[2,13-15].
本研究在常重力和微重力2种环境中进行习惯性电刺激,模拟运动训练处理大鼠后肢腓肠肌、比目鱼肌以及胫骨前肌,然后使用改进尾悬吊法(Tail Suspension,TS)[16]模拟微重力环境,观察各组肌肉的萎缩情况;在此基础之上,引入联合训练机制,即在常重力和微重力环境中分别通过高频电刺激(HFES)和低频电刺激(LFES)及相互结合的方式对大鼠进行联合运动干预,筛选最佳延缓骨骼肌萎缩的方法.
1 材料与方法
1.1 实验动物
选用56只雄性SPF级8周龄的斯泼累格·多雷(Sprague-Dawley, SD)大鼠,购自南方医科大学实验动物中心,实验动物许可证号SCXK(粤)2016-0041,饲养在华南师范大学体育科学学院实验动物饲养房,室内温度22±2 ℃,相对湿度保持在40%~60%之间,12 h/12 h昼夜交换,按照实验动物的作息规律,将实验动物作息时间明暗交替,饲养房通风条件良好,于普通饲养笼饲养2周之后开始干预.
1.2 实验分组
根据实验设计,本实验共分为3个阶段. 第1阶段,在常重力环境下探讨HFES和LFES干预6周对正常SD大鼠骨骼肌的影响;第2阶段,用TS模拟微重力,根据第1阶段的实验结果,采取干预效果较好的高频电刺激进行微重力干预(Control and then TS Plus HFES intervention, Group C)和常重力干预(HFES for 6 weeks and then TS intervention, Group HT),探讨不同干预阶段对延缓骨骼肌萎缩的效果;第3阶段:引入联合训炼机制,在常重力和微重力环境中使用持续HFES与LFES或联合干预的锻炼模式,探讨最佳抵抗/延缓骨骼肌萎缩的方法. 详细实验分组见表1.

表1 实验分组Table 1 The experimental group
1.3 实验方法
1.3.1 实验模型构建方法 尾悬吊(Tail Suspension,TS)是一种模拟失重使大鼠后肢骨骼肌萎缩的实验方法[16],将实验大鼠用固定器固定,限制其活动,使尾部外露,先用肥皂水清洗其尾部表面,再喷涂碘酒并吹干,以防止压敏胶布对大鼠尾部产生过度刺激,同时,肥皂水和碘酒可以使大鼠尾部皮肤表面变涩,使胶布粘贴更加牢固. 使用压敏胶布从大鼠一侧尾根部起,按纵向走形,将一长约17~20 cm的医用压敏胶布,粘贴于尾部表面至距尾尖部3~5 cm处,使用医用纱布缠绕大鼠尾部,然后在此段尾部的表面,依次间断地缠绕3~4圈横向胶条,以对纵向的粘贴位置进行加固. 利用悬吊梁上的细铁链与挂钩调整大鼠头低位,使其躯体与鼠笼底部呈30°,最后将大鼠悬吊至鼠笼内的悬吊梁上,大鼠在悬吊期间可以利用前肢自由活动,饮食和饮水均不受限制(图1). 悬吊8周后,体质量与对照组没有显著性差异.

图1 SD大鼠尾部悬吊示意图
1.3.2 骨骼肌电刺激 使用购自美国Artisan Technology Group S48 Stimulator电刺激仪(图2)和220 V稳压电源,通过导线连接Hwato(华佗)牌0.3×25 mm的非一次性针灸针. 实验开始前,为了避免大鼠在电刺激过程中抵抗由于刺激引发的非自愿收缩以及由于挣扎导致的骨骼肌其他损伤和应激,使用3.5%的水合氯醛,按照7 μL/g的麻醉剂量麻醉大鼠,在大鼠进行刺激当日,防止大鼠由于麻醉原因,肠道蠕动频率下降进而导致肠梗阻,所以在刺激前晚对大鼠进行禁食不禁水处理. 待大鼠麻醉后,使用脱毛膏清理大鼠腿部毛发,使用酒精棉擦拭大鼠腿部和针灸针,使大鼠侧卧于平面,将电针扎入将要刺激的后肢骨骼肌(图3). 骨骼肌电刺激参数见表2.

表2 骨骼肌电刺激参数Table 2 The muscle electrical stimulation parameters

图2 S48电刺激仪
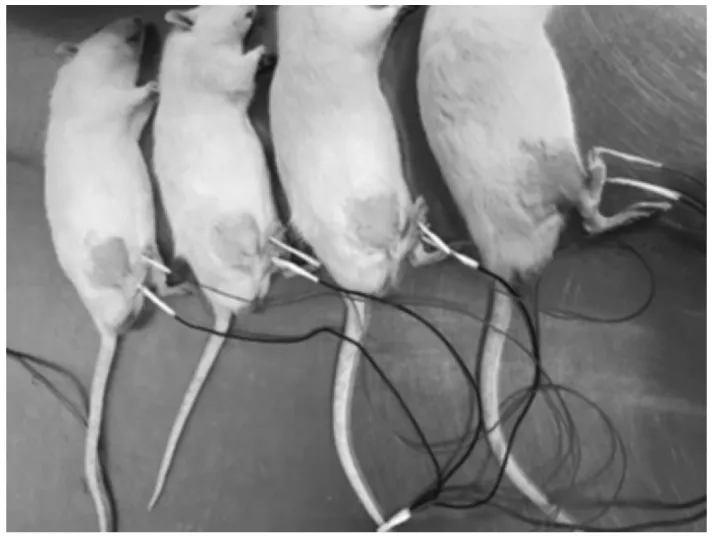
图3 骨骼肌电刺激示意图
1.3.3 实验取材 电刺激结束次日,以7.5%的水合氯醛麻醉大鼠,然后取大鼠左侧后肢腓肠肌(Left Gastrocnemius,LG)、左侧胫骨前肌(Left Tibialis,LT)、左侧比目鱼肌(Left Soleus,LS),称取完整各骨骼肌质量并记录,将两侧骨骼肌肌腹部分剪下,用做冰冻切片样品. 其余部分进行分装,以备蛋白表达情况检测.
1.3.4 冰冻切片及苏木素-伊红染色 首先,使用黄芪胶适量,放在纸板上面做固定底托,肌肉使用吸水纸除去表面水份,将骨骼肌肌腹部分垂直立入黄芪胶底托,使黄芪胶可以充分地固定样本. 将盛放异戊烷的小烧杯放入盛有液氮的保温桶中,液氮的液面维持在异戊烷液面的1/3处,预冷之后,将骨骼肌样本迅速投入异戊烷中30~60 s,然后取出放入液氮中备用. 使用德国徕卡冰冻切片机将骨骼肌样本切成6~10 μm的切片,制片,进行苏木素伊红(Hematoxylin-Eosin Staining ,HE)染色,观察骨骼肌形态以及骨骼肌横截面积的变化.
1.3.5 蛋白免疫印迹实验-Western Blot 使用100~200 mg腓肠肌样品剪碎放入离心管,加入裂解液和钢珠,使用上海净信科技公司的全自动样品快速研磨仪60 Hz匀浆60~120 s,然后使用高速冷冻离心机(4 ℃)、12 000 r/min离心10 min,取上清液;使用10 μL 用于测定蛋白浓度,其余样品按照4∶1的比例加入5×Loading Buffer,然后在100 ℃水温中煮10 min,待冷却至室温后储存在-80 ℃冰箱备用. 使用Cell Signaling Technology(CST)的p70s6k、P-p70s6k、Akt以及P-Akt蛋白抗体,GAPDH作为内参,分别检测不同蛋白的表达量.
1.4 数据统计
1.4.1 Sigma算法 本研究在传统统计方法的基础上引入Sigma算法[17-18]对实验结果进行统计. Sigma算法建立在自然界普遍存在的幂函数分布[19]或对数函数分布[20]的基础上,其主要包括定量差异统计[21]与自相似算法[18,22]. 定量差异阈值用(α,β,γ)表示,其中α为Weber阈值,定量差异小于α定义为完全没有差异,β和γ为显著性阈值. 不同水平的差异阈值不同,整体水平、组织器官水平以及细胞分子水平功能的差异性阈值分别为(0.100 6,0.268 3,0.472 2)、(0.161 0,0.472 2,0.804 8)和(0.268 3,0.804 8,1.221 0)[21,23]. 自相似算法包括一阶自相似算法和高阶自相似算法. 通过计算2组数据的定量差异或者空间比值的定量差异,与显著性阈值β比较,判断2组数据的自相似水平.
1.4.2 传统统计方法 实验结果均采用GraphPad Prism7.0统计分析软件进行处理,数据均以均数(Mean,M)±标准差(Standard Error, SD)表示为M±SD. SD大鼠骨骼肌质量以及组间差异均采用单因素方差分析,以P<0.05表示差异具有统计学意义.
2 实验结果
2.1 Sigma算法统计结果
实验共有10组,每组参数指标为5个,其中,组织器官水平参数包括腓肠肌质量(mLG)、胫骨前肌质量(mLT)以及比目鱼肌质量(mLS),分子水平使用磷酸化蛋白与非磷酸化蛋白的比值表征蛋白质的激活程度,a-Akt表示P-Akt与Akt的比值,a-p70s6k表示P-p70s6k与p70s6k的比值. 经过Sigma算法计算10个组两两满足自相似. 表3列出了各干预组与Z组参数指标之间的比值均值和整体定量差异. 由于参数组包括组织器官水平参数和分子水平参数,所以其最大显著性阈值β为0.804 8. 表3结果显示:H组的整体定量差异为0.848,大于显著性阈值β,所以H组与Z组属于升级自相似,其他各干预组的整体定量差异均小于0.804 8,表示与Z组属于同级自相似.
不同频率电刺激对骨骼肌蛋白质合成相关因子表达的影响不同,其中长期HFES可以增加抗阻训练正则通路“Akt-mTOR-p70s6k”的激活程度,进而促进骨骼肌蛋白质合成增加,使骨骼肌肥大以延缓由于失重而导致的废用性骨骼肌萎缩[18,24]. 本研究选择其中的Akt以及p70s6k的蛋白激活程度作为分子水平参数,其自相似计算结果如表4所示. 骨骼肌蛋白质合成相关因子的激活程度为分子水平,其显著性阈值β为0.804 8,经过干预之后,仅T组的整体定量差异小于0.804 8,其他各干预组的整体定量差异均大于0.804 8,表明骨骼肌电刺激可以激活并逐渐形成抗阻训练的正则通路,以延缓骨骼肌萎缩. 表4还表明:正常饲养环境中,HFES干预对骨骼肌蛋白质合成相关因子的激活程度好于LFES干预;微重力环境中高频电刺激对骨骼肌蛋白质合成相关因子的激活程度好于常重力环境高频电刺激;联合组中LLT组对骨骼肌蛋白质合成相关因子的激活程度好于其他各组.

表3 各干预组与健康对照组参数指标的比值均值和整体定量差异Table 3 The mean ratio and overall quantitative difference of the parameter of each intervention group and the healthy control group
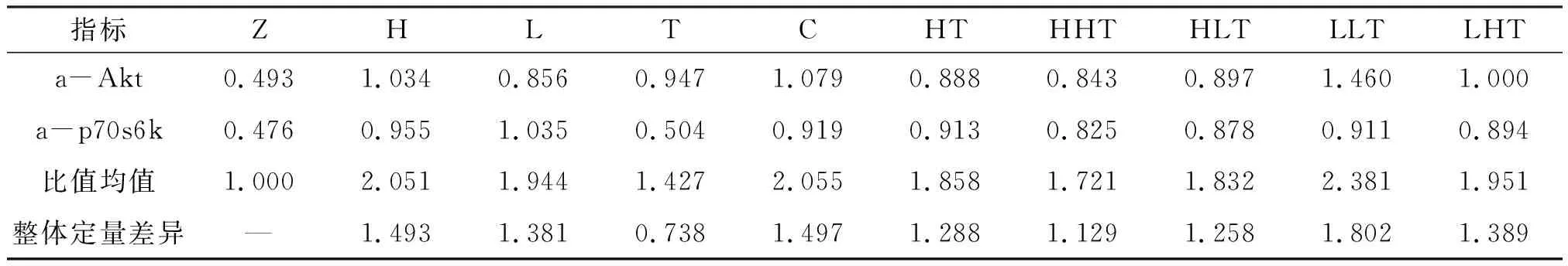
表4 各干预组与健康对照组的分子水平比值均值和整体定量差异
2.2 传统统计方法统计结果
2.2.1 不同频率干预对骨骼肌的影响
(1)骨骼肌质量 经过HFES和LFES干预6周之后,骨骼肌质量都出现了不同程度的上升(表5),H组与Z组相比,HFES干预6周后,大鼠比目鱼肌质量(mLS)提高21%(P<0.05),胫骨前肌质量(mLT)提高27%(P<0.01),腓肠肌质量(mLG)提高18%. LFES干预6周,大鼠后肢骨骼肌质量虽有升高趋势,但无显著性差异.
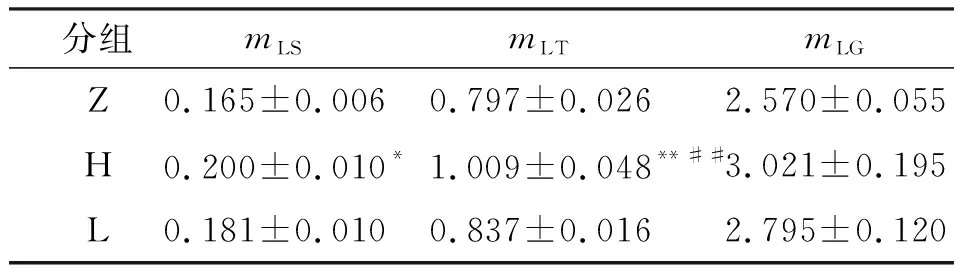
表5 不同频率干预对骨骼肌质量的影响
(2)HE染色结果 通过6周的电刺激,Z组的骨骼肌纤维形态比较饱满圆润,肌纤维之间有少量基质存在(图4). 相比较而言,H组和L组的骨骼肌纤维形态存在向多边形改变的变化趋势,且骨骼肌纤维横截面积显著增加.
(3)蛋白免疫印迹结果 使用蛋白免疫印迹方法(Western Blot,WB)测定大鼠胫骨前肌中Akt和P-Akt以及p70s6k和P-p70s6k的蛋白表达量. 根据骨骼肌蛋白质合成因子的激活程度判断HFES和LFES对促进骨骼肌肥大的效果(图5).
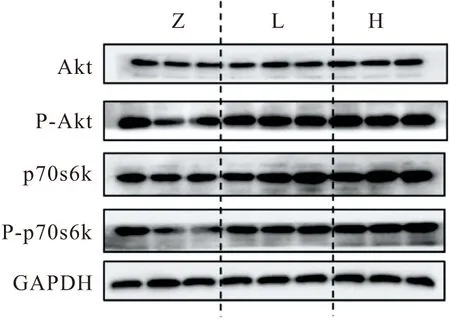
图5 不同频率干预的蛋白免疫印迹实验结果
经过6周不同频率的骨骼肌电刺激干预,骨骼肌蛋白质合成相关因子Akt和p70s6k的表达量明显增加(表6),与Z组相比,H组Akt蛋白激活程度提升110%(P<0.01),p70s6k蛋白激活程度提升98%(P<0.01);L组Akt蛋白激活程度提升74%(P<0.01),p70s6k蛋白激活程度提升114%(P<0.01). 说明不同频率MES可能是通过促进骨骼肌蛋白质合成使骨骼肌肥大,HFES干预效果与LFES干预无显著性差异.
2.2.2 常重力和微重力干预对抵抗骨骼肌萎缩效果的比较 根据第一阶段实验结果,HFES干预6周可以显著增加骨骼肌质量,促进相关蛋白Akt及p70s6k的表达与激活,因此选用HFES的干预形式,探讨在常重力环境和微重力环境中进行干预,延缓骨骼肌萎缩的效果.
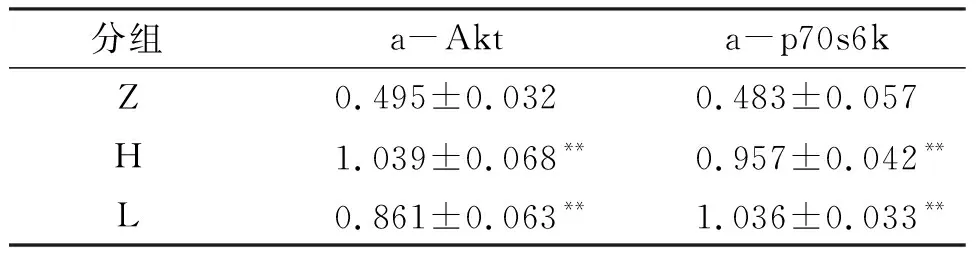
表6 不同频率干预骨骼肌蛋白质合成相关因子的激活程度
(1)骨骼肌质量 尾悬吊模拟失重干预4周后,大鼠后肢骨骼肌出现萎缩,主要是以慢肌纤维为主的比目鱼肌萎缩最为严重(表7),与Z组相比,T组比目鱼肌质量(mLS)下降45%(P<0.01). 经过常/微重力干预后,比目鱼肌质量下降得到明显的缓解,C组与T组相比,比目鱼肌质量增加23%;HT组比目鱼肌质量增加48%(P<0.01),表示常重力干预效果好于微重力干预. 以快肌纤维为主的胫骨前肌(mLT)和腓肠肌(mLG)无显著差异.
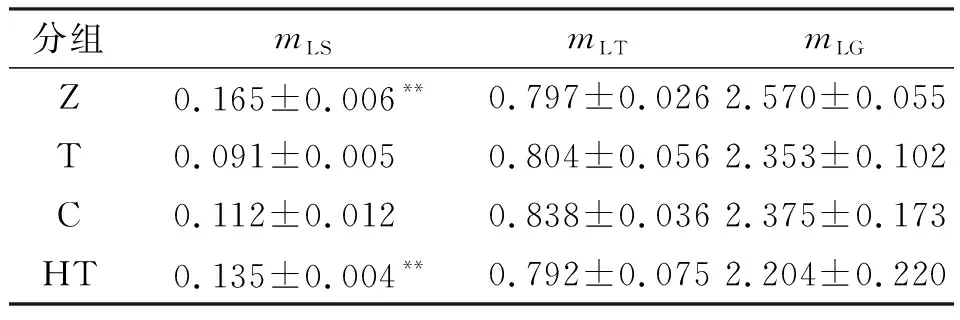
表7 常/微重力干预对骨骼肌质量的影响
(2) HE染色结果 经过4周的尾悬吊干预(图6),可以发现T组骨骼肌纤维形态发生改变,骨骼肌纤维横截面积显著缩小,经过常/微重力高频电刺激干预后,可以减缓这种缩小的趋势,并且C组的干预效果比HT组稍好.

图6 常/微重力干预的腓肠肌HE染色结果
(3)蛋白免疫印迹结果 经过4周尾悬吊处理之后,大鼠骨骼肌蛋白质合成相关因子Akt和p70s6k的表达明显下降(图7),蛋白质合成速率降低,导致骨骼肌质量下降. 常/微重力高频电刺激干预后,相关蛋白表达降低的趋势有所缓解,其中,经过C组和HT组干预之后p70s6k的蛋白表达明显高于T组,具有显著性差异.

图7 常/微重力干预的蛋白免疫印迹实验结果
不同时期的骨骼肌电刺激都可以通过上调相关蛋白质合成因子的表达促进骨骼肌质量的增加(表8). 与T组相比,C组Akt蛋白激活程度增加51%,p70s6k蛋白激活程度增加80%(P<0.01);HT组Akt蛋白激活程度增加24%,p70s6k蛋白激活程度增加79%(P<0.01). C组与HT组无显著差异.
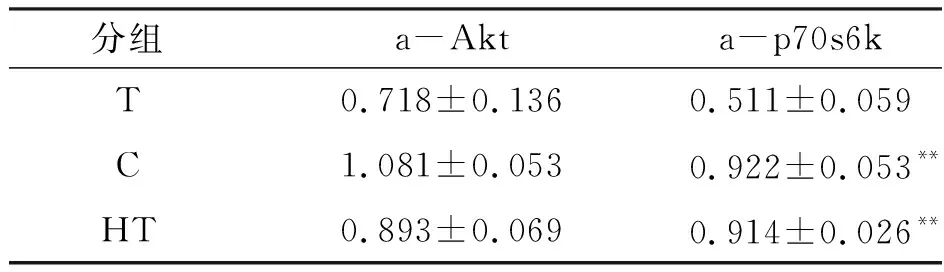
表8 常/微重力干预对骨骼肌蛋白质合成相关因子的激活程度
2.2.3 联合干预对抵抗骨骼肌萎缩的效果 前人的研究主要集中在骨骼肌萎缩发生之前或者恢复期间,以探讨不同时期干预对抵抗骨骼肌萎缩或加速骨骼肌萎缩恢复的效果,但缺乏对骨骼肌萎缩发生前与发展过程中采取相同或不同的干预模式进行联合训练的研究. 本实验借鉴高原训练理论引入联合训练模式,采用HFES与LFES相结合的干预方法,旨在探讨更加有效的干预模式与干预次序,为抵抗由于废用性导致的骨骼肌萎缩提供更好的方法,同时,验证维持习惯性运动形式是否具有更好的延缓骨骼肌萎缩的效果.
(1)骨骼肌质量 经过联合训练模式,联合组各干预模式对延缓骨骼肌萎缩都有明显效果(表9). HHT组与T组相比,比目鱼肌质量(mLS)提高55%(P<0.01),胫骨前肌质量(mLT)提升37%(P<0.01),腓肠肌质量(mLG)提升25%(P<0.01);HLT组与T组相比,比目鱼肌质量提升62%(P<0.01),胫骨前肌质量提升3.6%,腓肠肌质量提升11%;LLT组与T组相比,比目鱼肌质量提升59%(P<0.01),胫骨前肌质量下降9%,腓肠肌质量下降6%;LHT组与T组相比,比目鱼肌质量提升58%,胫骨前肌质量提升26%(P<0.05). 综上所述,HHT组的综合干预效果好于其他各干预模式,可以明显抵抗由于尾悬吊导致的废用性骨骼肌萎缩.
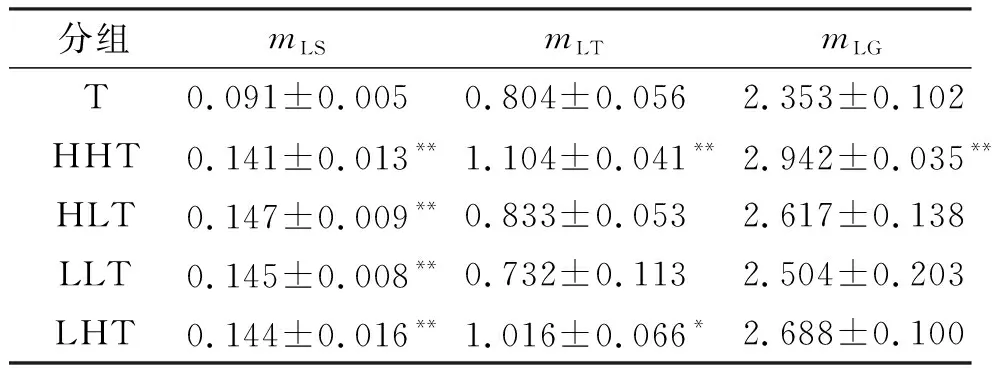
表9 联合干预对骨骼肌质量影响的统计结果
(2) HE染色结果 联合训练模式大鼠腓肠肌HE染色结果如图8所示,经过10周的长期骨骼肌电刺激干预之后,改善了由于尾悬吊导致的骨骼肌萎缩,并且与T组相比,联合组干预后骨骼肌间基质明显减少,相同视野下肌纤维数量下降,表明各骨骼肌纤维面积增加,且持续使用HFES的干预效果要好于其他各组.

图8 联合干预组的腓肠肌HE染色结果
(3)蛋白免疫印迹结果 通过联合训练模式干预,发现不同的干预模式对骨骼肌蛋白质合成相关信号因子的影响不同(图9). 联合训练模式各干预组与T组相比,均可以激活Akt以及p70s6k的蛋白表达,促进骨骼肌蛋白质合成,抵抗由于尾悬吊而导致的废用性骨骼肌萎缩.
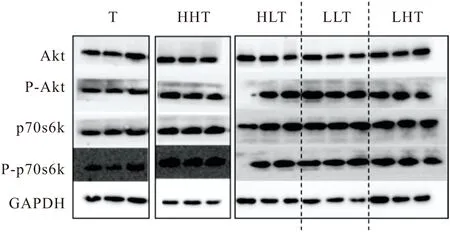
图9 联合干预组的蛋白免疫印迹实验结果
在联合训练模式干预过程中,LLT组与T组相比(表10),Akt的蛋白激活程度提升79%(P<0.05),p70s6k的蛋白激活程度提升79%(P<0.01). LLT组对Akt及p70s6k的蛋白激活程度好于其他各种干预形式,同时验证维持习惯性运动对骨骼肌蛋白质合成相关通路的激活程度好于非习惯性运动.
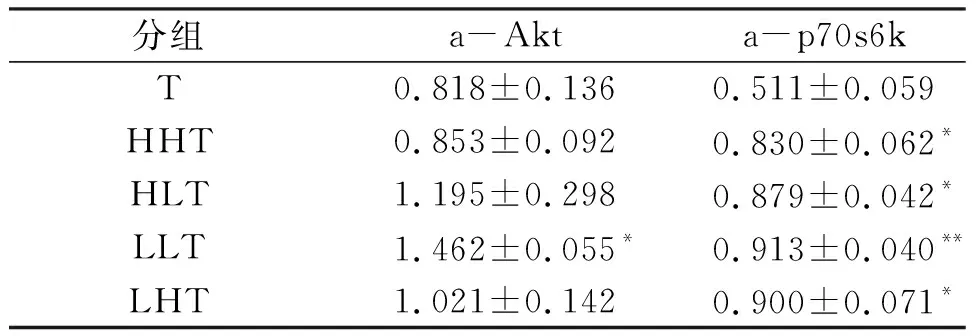
表10 联合干预组对骨骼肌蛋白质合成相关因子的激活程度
3 讨论
骨骼肌萎缩主要表现为肌纤维横截面积减小、蛋白质合成速率下降、肌肉力量减小、肌纤维类型根据不同的萎缩类型发生不同的转化[25]. 前人研究发现:使用50 Hz电针对后肢石膏固定C57BL/6小鼠进行为期2周的干预,可以显著增加小鼠骨骼肌纤维横截面积[26]. EKEN等[11]发现维持骨骼肌质量的有效刺激方案为:每周3次,每天2组,每组30 min,强度为0.4~30 mA的刺激方案效果最佳. 使用质量浓度为25 mg/ml的红景天苷[27]以及银杏叶提取物FGB761[28]灌胃治疗的研究结果发现:FOXO3的磷酸化水平升高,骨骼肌萎缩程度得到明显抑制. 所以,目前针对骨骼肌萎缩的主要治疗方法包括药物以及营养补给、物理康复治疗以及运动干预,且研究重点主要集中在骨骼肌萎缩发生的恢复期,鲜有研究探讨前期习惯性运动对抵抗骨骼肌萎缩的效果及其机制. 本研究在TS干预前对大鼠进行长期骨骼肌电刺激,不但发现了有效的骨骼肌电刺激模式,而且发现了维持习惯性运动比非习惯性运动具有更好的抵抗骨骼肌萎缩的效果,对于开发太空长期滞留的应用技术具有一定的学术价值.
4 结论
本研究探讨了不同条件下骨骼肌电刺激对尾悬吊导致大鼠骨骼肌萎缩的抵抗效果. 通过对骨骼肌质量、骨骼肌纤维形态变化特征以及相关蛋白表达与激活程度,探讨有效的骨骼肌电刺激干预频率、干预阶段与干预形式,为抵抗骨骼肌萎缩提供一定的理论基础及指导. 结合Sigma算法与传统统计学方法进行数据处理得出结论:
(1)尾悬吊干预4周,大鼠比目鱼肌质量下降45%,骨骼肌纤维直径显著缩小,Akt、p70s6k蛋白激活程度显著降低. 而不同频率骨骼肌电刺激可以促进正常饲养大鼠Akt、p70s6k的蛋白表达以促进骨骼肌质量及骨骼肌纤维直径的增加.
(2)常/微重力环境中,高频电刺激干预使骨骼肌萎缩得到不同程度的改善. 悬吊前干预,比目鱼肌质量与T组相比提升49%,已基本恢复至正常水平.
(3)联合训练模式中,习惯性高频电刺激干预模式的综合干预效果好于其他干预模式,HHT组骨骼肌质量与T组相比均提高20%以上,其中比目鱼肌质量提高55%,显著高于其他各干预组. 而习惯性低频电刺激组Akt与p70s6k的激活程度与T组相比均提高79%,表明习惯性运动可以促进骨骼肌相关蛋白的表达,以维持骨骼肌质量.
