益气活血脑泰方干预脑缺血后铁代谢相关机制研究
2021-01-03廖君王建君余清平曾劲松胡立娟罗宁葛金文
廖君 王建君 余清平 曾劲松 胡立娟 罗宁 葛金文


摘要 目的:探討炎症通路IL-6/stat3/Hepcidin调节铁代谢相关机制,研究益气活血脑泰方通过抑制炎症反应,调节铁代谢,减少细胞内铁聚集,为脑泰方防治脑缺血的临床应用提供重要实验依据。方法:细胞实验中,SH-SY5Y及CHME5细胞株模型干预24 h后,检测Fe2+表达、Western Blotting检测白细胞介素-6(IL-6)、Stat3及Hepcidin表达。动物实验中,随机将SD大鼠分为对照组、模型组、脑泰方低、中、高剂量组(3、9、27 g/kg)、去铁酮组。各组大鼠预处理灌胃给药连续3 d,大脑中动脉栓塞(MCAO)模型制备术后灌胃给药1 d。术后1 d取材,Western Blotting检测IL-6、Stat3及Hepcidin、Fpn的表达。结果:细胞实验结果显示:SH-SY5Y及CHME5细胞株模型组较正常组,细胞质内Fe2+表达明显增加(P<0.01),IL-6、Stat3蛋白表达水平增高(P<0.05),Hepcidin表达明显增高(P<0.05)。动物实验结果显示:与模型组比较,大鼠局灶性脑缺血后脑泰方高剂量组及去铁酮组,大脑皮质及髓质IL-6和皮质stat3、Hepcidin的表达明显减少(P<0.01),脑泰方高剂量组髓质Hepcidin的表达明显减少(P<0.01),去铁酮组髓质Hepcidin的表达降低(P<0.05);脑泰方高、去铁酮组大脑皮质及髓质Fpn的表达较模型组明显增加(P<0.01)。结论:脑泰方通过抑制IL-6/stat3信号通路,抑制脑缺血后炎症反应,减少Hepcidin分泌进而促进Fpn的表达,促进铁离子外排,对脑缺血导致的铁超载损伤有一定保护作用。
关键词 脑泰方;脑缺血;炎症;铁代谢;白细胞介素-6;信号转导与转录激活因子3;铁调素;膜铁转运蛋白
Abstract Objective:To explore the mechanism of IL-6/stat3/Hepcidin in the inflammatory pathway to regulate iron metabolism,and to study the effect of Yiqi Huoxue Naotai Formula on inhibiting inflammation,regulating iron metabolism,and reducing intracellular iron accumulation,providing important experimental basis of Naotai Formula in preventing and treating cerebral ischemia.Methods:In vitro experiment:SH-SY5Y and CHME5 cell lines culture for 24 h under OGD environment.The Fe2+ of the 2 cell lines were detected by kit of Metallofluor ferhonox-1 iron (Ⅱ) living cell imaging probe,and the expression of inflammatory and iron metabolism related proteins were detected by western-blot.In animal experiments,The rats were randomly divided into 5 groups:a normal group,a Sham surgery group,a model group,a low dose of NTF group(3 g/kg),a middle dose of NTF group(9 g/kg),a high dose of NTF group(27 g/kg),a Defriprone group.The expression of inflammatory and iron metabolism related proteins,IL-6/STAT3,hepcidin and Fpn1,were detected by wstern-blot.Results:Cell experiment results showed that compared with the normal group,the expression of Fe2+ in the cytoplasm of the SH-SY5Y and CHME5 cell lines in the OGD group was significantly increased (P<0.01),the expression of IL-6 and Stat3 protein was increased (P<0.05),and the expression of Hepcidin was significantly increased ( P<0.05).The results of animal experiments showed that compared with the model group,the expression of IL-6 in the cerebral cortex and medulla,and the expression of stat3 and Hepcidin in the cerebral cortex and medulla in the high-dose Naotaifang group and the deferiprone group were significantly reduced after focal cerebral ischemia in rats (P<0.01),the expression of Hepcidin in the medulla of the Naotaifang high-dose group was significantly reduced (P<0.01),and the expression of Hepcidin in the medulla of the deferiprone group was decreased (P<0.05); The expression of medullary Fpn was significantly higher than that of the model group (P<0.01).Conclusion:Naotai Formula can inhibits the IL-6/stat3 signaling pathway,the inflammatory response after cerebral ischemia,reduce the secretion of Hepcidin and promote the expression of Fpn,promote the efflux of iron ions,and has a certain protective effect on iron overload damage caused by cerebral ischemia.
Keywords Naotaifang (NTF); Cerebral ischemia; Inflammation; Iron metabolism; IL-6; Signal transduction and transcriptional activator 3(stat3); Hepcidin;Fpn
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.22.012
缺血性中风(Ischemic Stroke,IS)又称脑缺血,是由各种原因导致的脑组织血液供应障碍,并由此产生缺血缺氧性坏死,进而出现神经功能障碍的一组临床综合征。脑缺血后的炎症反应与脑缺血急性期脑损害密切相关[1]。大脑中神经胶质细胞占到脑内总细胞的90%。最初胶质细胞被简单地认为是大脑的填充物,仅起着支持、营养、保护等作用。近年来,研究发现神经胶质细胞发挥着与神经元同等重要的功能,甚至神经元的很多重要功能都是由神经胶质细胞调控[2]。小胶质细胞(Microglia)是中枢神经系统(CNS)最主要的免疫细胞。正常情况下,小胶质细胞处于静息状态,维持中枢神经系统稳态。应激反应中神经肽可调节小胶质细胞活性,激活的小胶质细胞产生炎症介质,引起神经毒性[3]。研究者新近提出神经的反馈调节在炎症反应中起重要作用,受损的神经元通过释放各种趋化因子激活胶质细胞[4-5]。
铁是人体内必需的微量元素之一,参与氧输送、线粒体呼吸功能以及DNA的合成,是神经递质及髓鞘蛋白合成重要酶的辅基[6];铁离子作为一种催化剂,在缺氧和炎症反应状况下,能导致脂质过氧化和氧化应激,最终引发线粒体功能紊乱、神经元损伤[7-9]。铁调素(Hepcidin)是由肝脏合成并分泌的铁调节肽类激素,有研究表明炎症反应可诱导Hepcidin的表达[10]。因此,开展脑缺血后神经元及小胶质细胞铁代谢与炎症反应相关性研究,可为中医药防治及作用机制研究提供重要实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞 细胞株包括:SH-SY5Y细胞株(人神经细胞系,中科院细胞库,目录号:SCSP-5014);CHME5细胞株(小胶质细胞,丰晖生物,货号:CL0359)。
1.1.2 动物 50只Sprague-Dawley雄性大鼠,体质量250~280 g,清洁级,8周龄,饲养于湖南中医药大学实验动物中心,给药前适应性喂养5~7 d(普通饲料,常规饮水,室温控制在22 ℃左右,相对湿度约60%)。由湖南斯莱克景达实验动物有限公司提供,合格证号:SCXK(湘)2019-0004。动物伦理审批号:LL2019092009,符合清洁级实验动物标准。
1.1.3 试剂与仪器 MetalloFluor FeRhonox-1铁离子(Ⅱ)活细胞成像探针(Goryo公司,日本,货号:GC901);DMEM/F12(货号:SH30023.01B)、FBS(货号:SH30070.03)、青链霉素(货号:SV30010)、胰酶(货号:SH30042.01)以上购自美国Hyclone公司;PBS(南京生兴公司,货号:SN331);Fpn多克隆抗体(货号:Anti-SLC40A1 antibody ab58695)、Hepcidin多克隆抗体(货号:Anti-Hepcidin-25 antibody【EPR18074】ab187778)、白细胞介素-6(IL-6)多克隆抗体(货号:Anti-IL-6 antibody ab9324)、STAT3多克隆抗体(货号:Anti-STAT3 antibody[EPR787Y]ab68153)以上购自美国Abcam公司;HRP-羊抗小鼠(货号:BA1050)、HRP-羊抗兔(货号:BA1054)、转膜液(货号:AR1151)、NC膜(货号:AR0135)以上购自博士德Boster公司;水合氯醛(天津市大茂化学试剂厂,CAS号:302-17-0)。CO2培养箱(Thermo fisher公司,美国,型号:3131);Confocal荧光显微镜(Zeiss公司,德国,型号:LSM710);电泳仪(北京六一公司,型号:DYY-12);灌胶﹑垂直电泳﹑转印装置(上海天能公司,型号:VE-180);全自动化学发光成像分析系统(上海天能公司,型号:Tanon5200);高速离心机(上海安亭公司,型号:TGL-20000CR);匀浆器(宁波新芝,型号:SCIENTZ-48);超声破碎仪(宁波新芝,型号:JY88-IIN);移液器(Thermo fisher公司,美国,货号:4652000);A4栓线(西浓科技,型号:2634)。
1.2 方法
1.2.1 分組与模型制备 1)细胞实验分组:分正常组及OGD模型组。2)动物实验分组:SD大鼠60只,随机分6组,每组10只,分别为正常组、模型组(灌胃生理盐水)、脑泰方(NTF)低剂量组(3 g/kg)、NTF中剂量组(9 g/kg)、NTF高剂量组(27 g/kg)和去铁酮组。3)大鼠局部性脑缺血模型的建立:大脑中动脉栓塞法(Middle Cerebral Artery Occlusion,MCAO)大鼠模型参照Garcia TH建立的方法[11]改进。动物麻醉用10%水合氯醛(35 mg/kg)腹腔注射。仰卧位固定,颈正中线切口。沿胸锁乳突肌内侧缘分离右侧肌肉和筋膜,分离右侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA)。于CCA的远心端和近心端及ECA处挂线备用。微动脉夹暂时夹闭ICA,近心端结扎CCA及ECA。在距CCA分叉4 mm处斜剪一小口,将拴线沿CCA插入ICA,用眼科镊轻推拴线,当插入深度距血管分叉处18 mm时,系紧CCA远心端的细线。修剪血管外的栓线,不需缝在皮外,以防大鼠醒来后自行拔出。缝合伤口,单笼饲养观察。
1.2.2 给药方法 脑泰方提取物为黄芪、川芎、地龙、僵蚕4味药,按照比例8∶2∶3∶3组成,经水煎,浓缩为含生药2 g/mL,以60 kg成年人剂量80 g生药/d为依据,大鼠剂量按体表面积换算,2倍剂量。药物剂量按人鼠体表面积折算等效比率计量表,计算出大鼠等效剂量。每次灌胃的容量为1 mL/100 g大鼠,1次/d,术前灌胃3 d,术后灌胃1 d。
1.2.3 检测指标
1.2.3.1 Fe2+检测 1)CHME5、SH-SY5Y细胞培养在含10%胎牛血清的DMEM/F12完全培养基中培养,37 ℃含5% CO2的细胞培养箱中培养,细胞增殖至80%~90%时,用胰酶将细胞消化下来,按照1∶3比例传代。2)将1×106个细胞种在3.5 cm玻璃底培养皿中,将细胞放入培养箱中培养贴壁后,其中CHME5-模型、SH-SY5Y-模型更换为无血清DMEM/F12培养基,放入1%O2三气培养箱中培养4 h。实验结束后,更换为完全培养基放入正常培养箱中培养24 h。3)将所有细胞从培养箱中取出,去除培养基,加入预冷的PBS轻轻将细胞洗2次。4)加入5 μmol/L Fe2+检测试剂混匀后,放入正常培养箱中培养60 min。将培养基去除,加入预冷的PBS洗3次。用激光共聚焦荧光显微镜拍照。
1.2.3.2 细胞实验Western Blotting检测 1)蛋白的提取及测定:将接种于六孔板中的2种细胞在模型中4 h后培养24 h,去除培养基,加入预冷的PBS,加入100 μL RIPA裂解液,冰上裂解30 min。裂解完成后,4 ℃下12 000 r/min,离心半径6 cm,离心5 min。离心后的上清液转移到1.5 mL离心管中,-20 ℃保存。蛋白的含量测定(根据碧云天BCA测定试剂盒说明书操作)。2)SDS-PAGE电泳浓缩胶层电压80 V,30 min,样品进入分离胶后,改用120 V电压电泳90 min。电泳至溴酚蓝刚出现即可终止电泳,进行转膜。3)转膜及检测:将膜移至含有封闭液(5%脱脂奶粉TBST溶液)的平皿中,室温下脱色摇床上摇动封闭1 h。一抗用含5% BSA的TBST溶液按照1∶1 000稀释于4 ℃孵育过夜。用TBST在室温下脱色摇床上洗3次,10 min/次。将二抗用TBST按照1∶5 000稀释,室温下孵育2 h后,用TBST在室温下脱色摇床上洗3次,10 min/次。4)采用Tanon ECL进行化学发光,按照试剂盒说明书操作。于Tanon5200化学发光成像仪下拍照,获取图片。
1.2.3.3 动物实验Western Blotting检测 1)蛋白样品制备:组织总蛋白提取,BCA蛋白定量,加上样缓冲液煮沸变性处理。取一定量的组织加入相应体积的RIPA裂解液(提前加入蛋白酶抑制剂)进行匀浆;超声处理,处理完后置冰上裂解0.5 h。10 000×g离心10 min,取上清液至一新离心管即为所提取总蛋白溶液;取少量蛋白溶液BCA定量后,剩余蛋白溶液加入蛋白上样缓冲液,置100 ℃水浴箱中沸水浴变性5 min。样品制备完成,置-20 ℃保存。2)电泳:样本每孔30 μg,浓缩胶5%,电泳电压70 V,分离胶12%,电泳电压90 V,时间约2 h。3)转膜(湿转)与封闭:0.2 μm NC膜,转膜液(含20%甲醇)电流值150 mA,转膜时间50~70 min;封闭液为5%脱脂奶粉溶于TBS-T;封闭时间为置室温20 ℃,摇床摇动 1.5 h。4)孵育:一抗,按一定比例稀释于Western专用一抗二抗稀释液(AR1017);IL-6(1∶200稀释),24 kD;STAT3(1∶1 000稀释),92 kD;Hepcidin(1∶500稀释),15 kD;Fpn(1∶500稀释),55 kD;孵育时间及温度:置4 ℃冰箱,摇床摇动过夜(约15 h);TBS-T洗膜3次,10 min/次。二抗浓度:HRP-羊抗小鼠(1∶5 000),HRP-羊抗兔(1∶5 000)稀释于博士德Western专用一抗二抗稀释液(AR1017);孵育时间及温度:置4 ℃冰箱,摇床摇动2 h。TBS-T洗膜3~5次,15 min/次。5)ECL发光显色:ECL化学发光试剂A液和B液等体积混合配成工作液。加ECL工作液于印迹膜上30~60 s,吸干后印迹膜通过成像分析仪自动成像,软件ImageJ分析蛋白条带灰度值。
1.3 统计学方法 采用SPSS 21.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞实验结果 1)SH-SY5Y及CHME5细胞株正常组及模型组比较,模型组细胞形态明显改变,细胞皱缩,有些细胞脱落,悬浮于细胞培养液。见图1。2)SH-SY5Y及CHME5细胞株检测Fe2+检测:模型组较正常组,细胞质内Fe2+表达均明显增加(P<0.01)。见图2。3)SH-SY5Y及CHME5细胞株WB检测炎症介质及铁转运相关蛋白的表达。见图3。SH-SY5Y细胞株,模型组与正常组比较,炎症介质及相关通路蛋白IL-6,STAT3表达增加(P<0.05),铁调节蛋白hepcidin表达明显增加(P<0.01)。CHME5细胞在正常培养及模型培养比较,模型组炎症介质IL-6表达明显增加(P<0.01),炎症相关通路蛋白STAT3及hepcidin表达增加(P<0.05)。
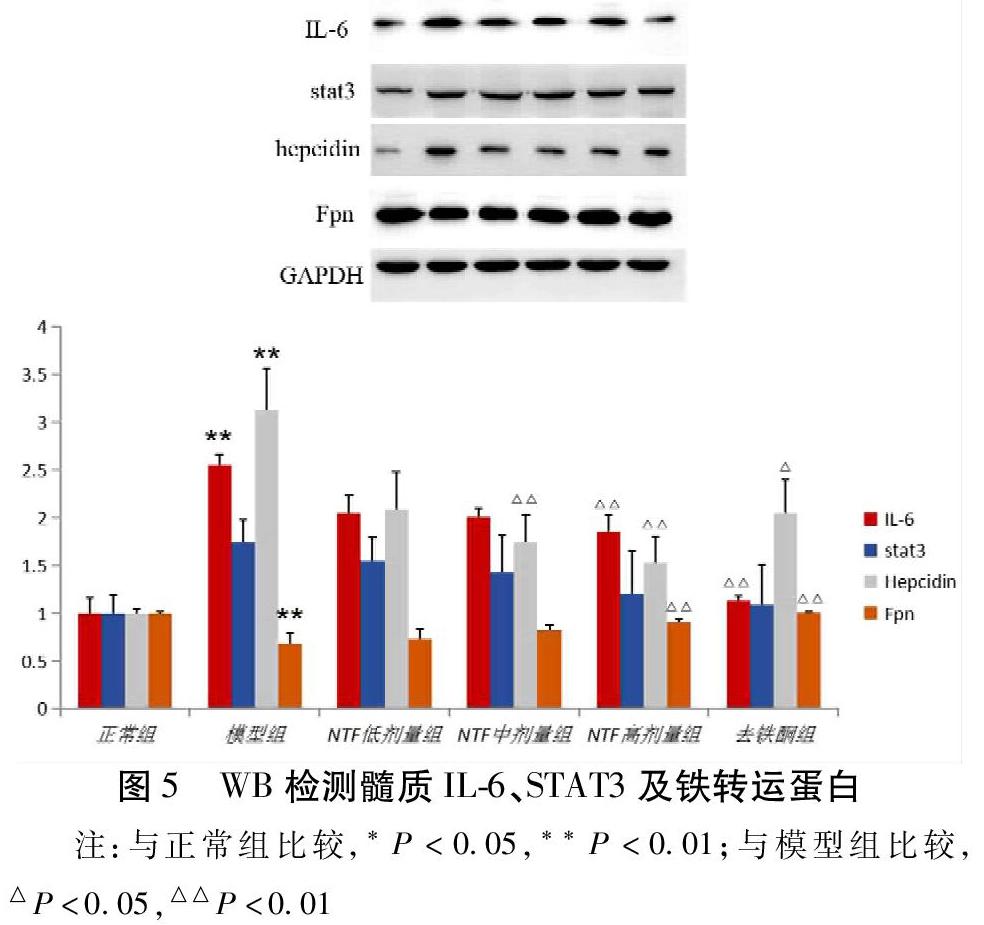
2.2 动物实验结果 1)WB检测大鼠局灶性腦缺血模型后各观察组大脑皮质炎症及铁代谢相关蛋白表达。与正常组比较,模型组大鼠大脑皮质IL-6、STAT3的表达明显增加(P<0.01);与模型组比较,脑泰方高剂量组及去铁酮干预可明显降低大脑皮质IL-6、STAT3的表达(P<0.01)。与正常组比较,模型组大鼠大脑皮质hepcidin的表达明显增加(P<0.05),脑泰方高剂量组及去铁酮干预可明显降低hepcidin的表达(P<0.01);膜铁转运蛋白Fpn的表达模型组较正常组明显降低(P<0.01),而脑泰方高剂量组及去铁酮组较模型组明显升高(P<0.01)。见图4。2)WB检测大鼠局灶性脑缺血模型后各观察组大脑髓质炎症及铁代谢相关蛋白表达。与正常组比较,模型组大鼠大脑髓质IL-6的表达明显增加(P<0.01);与模型组比较,脑泰方高剂量组及去铁酮干预可明显降低大脑髓质IL-6的表达(P<0.01)。模型组STAT3与正常组比较有升高,药物干预组较模型组表达降低,但差异无统计学意义。模型组hepcidin较正常组的表达明显增加(P<0.01),与模型组比较,脑泰方中、高剂量组及去铁酮组明显降低hepcidin的表达(P<0.01,P<0.05);膜铁转运蛋白Fpn模型组较正常组明显降低(P<0.01),而脑泰方高剂量组及去铁酮组较模型组明显升高(P<0.01)。见图5。
3 讨论
脑缺血早期的炎症反应,表现为细胞间黏附分子(ICAM)与循环中的白细胞(WBC)结合,促使后者移入中枢神经系统(CNS)[12],以及小胶质细胞活化分泌细胞因子,如白细胞介素-1(IL-1),白细胞介素-6(IL-6),肿瘤坏死因子-α(TNF-α)与γ干扰素(INF-γ)等,调控免疫应答[13]。小胶质细胞激活后产生的炎症介质、过氧化物及兴奋性氨基酸毒导致神经元损伤[14]。炎症反应是脑缺血后继发性损伤的重要因素[15]。
Hepcidin是肝内分泌的铁调节蛋白,对体内铁跨膜转运蛋白的调节具有重要作用。Hepcidin通过作用于Fpn调节十二指肠对铁的吸收及巨噬细胞铁释放,在铁代谢中起着关键的作用[16]。Hepcidin肝脏内调节的途径包括:即骨形态发生蛋白(Bone Morphogenetic Protein,BMP)信号途径和IL-6信号途径[17]。有研究提出,脉络丛上IL-6可通过STAT3信号通路调节Hepcidin表达[18]。颅内注射脂多糖(LPS)导致皮质和黑质Hepcidin表达增加,Fpn表达减少,其中小胶质细胞分泌IL-6及STAT3信号通路的调节起重要作用[19]。
研究者们在探讨神经系统炎症与铁代谢相关性研究时发现,炎症介质可致星形胶质细胞的Fpn表达减少,细胞内铁转出降低,髓鞘再生减少;而抗炎细胞因子可使星形胶质细胞Fpn表达增强,细胞内铁输出增加,减轻铁超载,发挥细胞保护作用[20];IL-1和IL-6能促进星形胶质细胞分泌铜蓝蛋白,作用于微血管内皮细胞的Fpn,提高基膜侧的铁向脑内输入[21];通过检测TNF-α、IL-6、LPS刺激神经元、星形胶质细胞、小胶质细胞内铁转运蛋白的表达等实验证明,神经退行性疾病中炎症发生和铁聚集机制与炎症诱导Hepcidin的产生,增加DMT1表达,降低Fpn表达有关[22]。因此,脑缺血后神经元及胶质细胞炎症及铁代谢相关性机制研究为脑缺血防治提供新的靶点。
脑泰方由黄芪、地龙、僵蚕、川芎4味中药组成,黄芪为君药,借其力专、性走,周行全身,大补脾胃元气,令气旺则血活,血活则瘀除,以治其本;地龙性寒、味咸,具有息风通络之功效;僵蚕味辛、咸,性平,具有祛风化痰作用,二者何用共奏通经活络、祛风化痰之功效,均为臣药;川芎活血行气,气行则血行,且具引药上行之功效,是为佐药;4味药配合,共奏益气活血,化痰通络之效。前期研究表明,脑泰方干预促进脑缺血及缺血再灌注神经元Fpn的表达,增加非血红素铁排泄,减少铁聚集引起的氧化损伤[23-24]。
本课题进行脑缺血后炎症与铁代谢相关性研究,SH-SY5Y及CHME5細胞株缺糖缺氧培养,炎症介质IL-6及通路蛋白Stat3表达明显增加,Hepcidin生成增加,铁离子输出蛋白Fpn减少,神经元及小胶质细胞内铁离子聚集。动物实验使用铁离子螯合剂去铁酮作为阳性对照药。局灶性脑缺血后脑泰方干预治疗,大鼠大脑皮质炎症介质IL-6及通路蛋白Stat3表达明显降低,Hepcidin表达减少,铁离子输出蛋白Fpn增加;髓质IL-6表达增加,Hepcidin表达减少,Fpn增加。
因此我们推测,脑缺血后神经元及小胶质细胞炎症介质IL-6生成增加,通过IL-6/STAT3信号通路刺激铁调素Hepcidin生成,进而抑制Fpn表达,铁离子聚集。益气活血脑泰方可以通过抑制IL-6的表达,抑制Hepcidin分泌,促进Fpn表达,增加铁离子外排,减少细胞内铁聚集。
参考文献
[1]Banjara M,Ghosh C.Sterile Neuroinflammation and Strategies for Therapeutic Intervention[J].Int J Inflam,2017,2017:8385961.
[2]Carniglia L,Ramírez D,Durand D,et al.Neuropeptides and Microglial Activation in Inflammation,Pain,and Neurodegenerati ve Diseases[J].Mediators Inflamm,2017,2017:5048616.
[3]Fang Y,Huang X,Wan Y,et al.Deficiency of TREK-1 potassium channel exacerbates secondary injury following spinal cord injury in mice[J].J Neurochem,2017,141(2):236-246.
[4]Tracey KJ.Neurons Are the Inflammatory Problem[J].Cell,2018,173(5):1066-1068.
[5]Suzumura A.Neuron-microglia interaction in neuroinflammation[J].Curr Protein Pept Sci,2013,14(1):16-20.
[6]BOGDan AR,Miyazawa M,Hashimoto K,et al.Regulators of Iron Homeostasis:New Players in Metabolism,Cell Death,and Disease[J].Trends Biochem Sci,2016,41(3):274-286.
[7]Reyt G,Boudouf S,Boucherez J,et al.Iron-and ferritin-dependent reactive oxygen species distribution:impact on Arabidopsis root system architecture[J].Mol Plant,2015,8(3):439-453.
[8]Akbar M,Essa MM,Daradkeh G,et al.Mitochondrial dysfunction and cell death in neurodegenerative diseases through nitroxidative stress[J].Brain Res,2016,1637:34-55.
[9]Liu CB,Wang R,Dong MW,et al.Expression of hepcidin at the choroid plexus in normal aging rats is associated with IL-6/Stat3 signaling pathway[J].Acta physiol Sin,2014,66(6):639-646.
[10]Meynard D,Babitt JL,Lin HY.The liver:conductor of systemic iron balance[J].Blood,2014,123(2):168-176.
[11]Garcia JH.A reliable method to occlude a middle cerebral artery in Wistar rats[J].Stroke,1993,24(9):1423.
[12]Johnson MB,Young AD,Marriott I.The Therapeutic Potential of Targeting Substance P/NK-1R Interactions in Inflammatory CNS Disorders[J].Front Cell Neurosci,2016,10:296.
[13]周瑞,高金环,郭非非,等.基于转录组学和蛋白质组学的黄连素抗脑缺血关键转录因子分析[J/OL].中国实验方剂学杂志:1-11[2021-12-04].
[14]王富江,李芮琳,贾壮壮,等.注射用丹参多酚酸和血栓通注射液联合应用对局灶性脑缺血再灌注大鼠脑组织星形胶质细胞和小胶质细胞的影响及作用机制研究[J].中草药,2017,48(19):4029-4036.
[15]Mukandala G,Tynan R,Lanigan S,et al.The Effects of Hypoxia and Inflammation on Synaptic Signaling in the CNS[J].Brain Sci,2016,6(1):6.
[16]Almutairi MMA,Xu G,Shi H.Iron Pathophysiology in Stroke[J].Adv Exp Med Biol,2019,1173:105-123.
[17]Bagu ET,Layoun A,Calvé A,et al.Friend of GATA and GATA-6 modulate the transcriptional up-regulation of hepcidin in hepatocytes during inflammation[J].Biometals,2013,26(6):1051-1065.
[18]龐会婷,罗朵生,郭姣.三七化学成分分析及其抗炎机制的网络药理学探讨[J].中草药,2020,51(21):5538-5547.
[19]Qian ZM,He X,Liang T,et al.Lipopolysaccharides upregulate hepcidin in neuron via microglia and the IL-6/STAT3 signaling pathway[J].Mol Neurobiol,2014,50(3):811-820.
[20]Rathore KI,Redensek A,David S.Iron homeostasis in astrocytes and microglia is differentially regulated by TNF-α and TGF-β1[J].Glia,2012,60(5):738-750.
[21]McCarthy RC,Kosman DJ.Activation of C6 glioblastoma cell ceruloplasmin expression by neighboring human brain endothelia-derived interleukins in an in vitro blood-brain barrier model system[J].Cell Commun Signal,2014,12:65.
[22]Urrutia P,Aguirre P,Esparza A,et al.Inflammation alters the expression of DMT1,FPN1 and hepcidin,and it causes iron accum ulation in central nervous system cells[J].J Neurochem,2013,126(4):541-549.
[23]廖君,杨梅,石咏梅,等.益气活血中药脑泰方对脑缺血后海马CA2区铁跨膜转运蛋白表达的调节作用[J].世界中医药,2016,11(4):592-596.
[24]Liao J,Xia X,Wang GZ,et al.Naotaifang extract treatment results in increased ferroportin expression in the hippocampus of rats subjected to cerebral ischemia[J].Mol Med Rep,2015,11(6):4047-4052.
(2020-07-27收稿 责任编辑:王明)
