α-黑素细胞刺激素对乌骨鸡黑色素合成影响研究进展
2020-12-30熊江燕郑娟霞王琤韡
熊江燕,郑娟霞,王琤韡*
(江西科技师范大学生命科学学院,南昌 330013)
乌骨鸡别称泰和鸡、乌鸡等,具有毛脚、乌皮、乌骨和乌肉等众多特点,是传统中医药认为的我国特有的药食两用鸡种。临床试验证明,乌骨鸡能提高机体肾上腺皮质、垂体组织的机能,提高血细胞的含量并增强血红素的相关性能,其主要原因在于其存在的黑色素,黑色素分为脱黑色素、真黑色素以及异黑色素三类,是一种在主体吲哚环四周连接着芳香化合物及烯烃化合物或基团的化合物,乌骨鸡体内色素为真黑色素。乌骨鸡黑色素具备众多生理功效,如可以清除自由基达到抗氧化效果,并可以减缓机体衰老以及防紫外线、防诱变等[1-3]。且黑色素沉积越深,药用价值越佳。黑色素以络氨酸作底物通过一系列复杂的化学反应合成,α-黑素细胞刺激素(α-MSH)是一类可与黑素细胞表面受体结合作用,促进络氨酸的合成分泌,并促进黑素细胞产生树突的神经内分泌激素。此外,α-MSH还能促进黑素细胞增殖,在黑色素合成过程中具有重要作用[4]。本文综述了α-MSH 对黑色素合成的影响,以期为乌骨鸡黑色素相关研究提供一定理论依据。
1 α-MSH概况
1.1 α-MSH的产生及结构
阿黑皮素原(POMC)激素是α-MSH 的前体,垂体是初次检测出含POMC 的部位,近年来研究者在免疫细胞、皮肤、脑等组织器官也检测到存在POMC。POMC 主要在脑垂体分泌,促肾上腺皮质素(ACTH)通过释放因子诱导POMC mRNA在细胞和组织中表达,而后ACTH 在促肾上腺皮细胞中表达并发生水解作用,促肾上腺皮细胞位于垂体前叶,其反应一条途径水解为ACTH,另一条途径水解产物先是β-促脂解素(LPH)而后经转化为β-内啡肽最终生成β-MSH[5]。酶继续催化ACTH,直至其降解为α-MSH(见图1)。目前已知三类不同构型的MSH神经内分泌激素,其表达与功能均不尽相同,包括α、β以及γMSH。其中由丝-酪-丝-蛋-谷-谷-苯丙-精-色-甘-赖-脯-缬等13 个氨基酸构成的α-MSH 含量最高,这13 个氨基酸又来源于POMC分子中39个氨基酸的第1至13 位氨基酸,且研究发现,在促黑色素细胞中α-MSH 具备黑素活性的最小单位是其中的第4至10 位氨基酸[7]。当α-MSH 的某几位氨基酸被替换后,会产生多种与α-MSH 有着相同作用,而对受体亲和性不同的α-MSH类似物。
1.2 α-MSH受体
在近年来α-MSH的研究中,发现并克隆出了5种α-MSH的受体(MCR家族),α-MSH在不同组织中通过其特异性以Ca2+依赖方式发挥作用。MCR家族均为G蛋白偶联受体,该受体共同特点为其立体结构中都有七个跨膜α 螺旋,包括MC1R-MC5R[8]。其中MC2R 是ACTH 的受体,分布于肾上腺皮质,只对ACTH有亲和力,能结合大部分的粗黑激素肽[9],而其余受体均对MSH 表现出不同程度的亲和力,且在脑内均有表达。MC1R 主要分布在中性粒细胞、单核巨噬细胞及外周的黑素细胞,具有与α-MSH和ACTH同等的亲和力;MC3R、MC4R的表达主要于脑组织进行,且MC4R 对MSH 具 有 特 异 性;MC5R 则 结 合ACTH、α-MSH 主要分布在肾上腺、胃及脾脏等。研究发现,黑皮素类受体MC1R 对皮肤黑色素沉着有调控作用,其含有317 个氨基酸和7 个跨膜蛋白,且MC1R 的遗传突变因子决定了MC1R 的功能,MC1R 在不同细胞上的表达存在差异。MC1R 可在黑素细胞中进行表达,当MC1R 作为相关受体与α-MSH 进行连接,MC1R 即可受到一定刺激而被活化,且和G 蛋白偶联能提升环磷酸腺苷(cAMP)含量[10]。
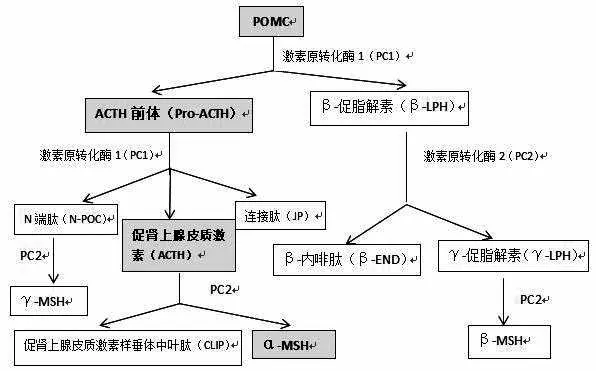
图1 α-MSH合成具体过程[6]
2 α-MSH与黑色素合成
黑色素的结构与蛋白质一致,Raper 等最先提出其合成具体生化反应过程,而后科学家们进一步将简单理论系统地完善[11]。第一步反应是络氨酸被决定该反应速度的关键酶络氨酸酶(TYR)催化,作用后产物氧化为多巴(Dopa),TYR 继而使Dopa氧化为多巴醌(DQ),DQ通过多聚化反应产生活性极高的无色多巴色素,多聚化反应物包括DQ、无机离子、氨基化合物及还原剂等。而余下的DQ易将活性高的无色多巴色素催化氧化为多巴色素(DC),这一过程非常快速[12]。而后与多巴色素异构酶反应,反应有羟化和脱羧两条途径,羟化产生5,6-二羟基吲哚羧酸(DHICA)可与自身或与醌、醇结合产生真黑素,而脱羧不会直接合成真黑色素,而是合成一个前体,反应先产生5,6-二羟基吲哚(DHI),经过TYR的作用即合成IQ,IQ 也称5,6-吲哚醌。在黑色素合成过程中,体内的细胞因子、各类激素及外界环境均会对其生物合成产生影响。研究证明,α-MSH可调控黑素细胞增生与合成,通过激活MC1R 后参与cAMP/PKA信号转导途径。首先在α-黑素细胞刺激素作用下黑素细胞特异性连接MC1R,再通过G 蛋白耦联环磷酸腺苷信号通路,一方面可激活腺苷酸增加cAMP含量并提高络氨酸酶的分泌水平促进合成黑色素的反应效率。Busca等[13]表明,cAMP在促进黑素生成的途径中涉及到了磷酸化转录因子和蛋白激酶A,反应过程可上调TYR 的表达水平,提高MITF含量,且反应时优先推进真黑素的产生。而与此同时α-MSH 会使蛋白脂酶的C 细胞信号途径激活,从而在黑素合成时调控信号通路与信号蛋白的多酶级联作用。
3 α-MSH对黑色素合成的调控
3.1 介导紫外线的诱导作用
大量实验表明,紫外线(UV)在诱导黑色素沉积方面非常关键,主要通过cAMP 通道的关键调节物MC1R介导发挥作用。一方面α-MSH可以作为UV 诱导黑色素合成的旁分泌介导物,同时对UV对于黑素细胞树突的影响有调节作用;另一方面UV 能促进黑素细胞及角朊细胞上MC1R 的功能表达,从而增加α-MSH 与MC1R 的协同性[14]。此外,UV会介导黑素细胞停滞于G1期,而α-MSH可促使其克服,并引起G2期变长细胞数目变多,而G2时期的黑素细胞可分泌MC1R,促进α-MSH的作用,并介导UV合成黑色素。黑素细胞、角质形成细胞在UV 诱导下均能刺激分泌α-MSH 和ACTH 等,从而促进MC1RmRNA 的表达,上调细胞对POMC 相关肽的反应性;同时MC1R 被α-MSH 及ACTH 激活后可扩增UV 的生物信号。亦有学者分析,UV 照射可促进α-MSH 与细胞表面的受体结合,提高络氨酸酶的活性,此外UV照射能使α-MSH 细胞内在结合位点下降而外在结合位点上升。其机制存在两种可能,其一,UV加强细胞内MC1R 再分布于细胞外,阻止细胞表面受体内在化;其二,紫外线能促进α-MSH 及其它蛋白结合自身靶细胞的作用,且细胞经UV 照射由于其内在MC1R 闭合使得其与α-MSH、相关蛋白的结合受到阻碍,或者UV对细胞内MC1R具有无特异性蛋白水解作用[15]。以上表明,α-MSH与MC1R 及UV 在参与调节合成黑色素时具有协同作用,且在角质形成细胞及表皮细胞中不仅具备自分泌网络,还具有旁分泌网络,其调节机制同时拥有正反馈和负反馈。
3.2 促进黑色素细胞增殖
合成黑色素的反应在黑色素细胞黑素体中进行,神经嵴是黑素细胞生长发育的场所,成黑素细胞需先经过神经嵴再迁移至特定靶位点。就皮肤色素而言,成黑素细胞在表皮和发囊分化成熟,后黑色素细胞延伸形成树突,合成黑色素所需的黑素体由树突顶供给,黑素体进入表皮细胞后产生黑色素[16]。近来研究表明,α-MSH能调控黑素细胞树突增生,在黑素细胞和角质形成细胞之间树突作为转运黑素小体的桥梁并刺激其加速,此外树突伸长的黑素细胞具有更高的存活率,而接着经反馈调节亦可促进黑色素的分泌[17]。其机制普遍接受的是,α-MSH 可上调细胞内能与GTP-结合蛋白Rho及Rac发生反应的cAMP的含量,从而使黑素细胞肌动蛋白纤维重新组合改善其无序性,促进黑素细胞树突形成,且与此同时,cAMP 还发挥了阻碍PI3K 信号通路传导的作用[18]。亦有学者分析,对形成树突及合成黑素细胞有促进作用的因子活化下游信号,是首先结合有关糖蛋白到达细胞中再介导相关结合位点,进而促进黑素细胞的生长发育[19]。Hiramoto 等[20]研究发现,经α-MSH 处理后TYR 活性有显著提高,并提高了TPR1和TPR2蛋白表达水平,且α-MSH的剂量与黑色素细胞的增值率呈线性相关,随α-MSH 浓度增加黑色素细胞的增值率先升高后下降。然而,Halaban[21]表明,当含有促分裂剂,α-MSH 仅是在短时间内促进正常黑色素细胞基因的表达,而对增加黑素细胞的数量并无效果。
3.3 保护黑素细胞
α-MSH在促进黑素合成的同时,也是一种具有抗炎性细胞因子效应的内源性神经免疫调节肽,能缓解细胞受到毒性的损伤,此外还可促使黑素细胞分泌NO以阻碍有害因子对细胞个体之间粘连的促进作用。已知α-MSH 除与外周炎性细胞及神经胶质细胞表面的MCR 受体直接结合调节外周炎症和控制中枢神经系统炎症外,α-MSH还可在中枢神经系统对炎症的调节下,进一步对外周神经发挥抗炎效果。除通过调控炎症保护黑素细胞外,α-MSH还能保护黑素细胞免受超氧化物的损害。由于络氨酸酶合成黑色素底物需利用超氧化物,然表皮黑素细胞抗氧化酶水平较低,且产生的超氧化物较多,易受到氧化损害。实验发现,在羊驼黑色素细胞培养基中添加含量有差异的α-MSH,结果显示其与MC4R 作用后可下调NOS2 的水平,下调程度和α-MSH 含量呈线性关系[22]。α-MSH和NO均对黑色素产生有诱导作用,NO是一类活性分子,由黑素细胞经α-MSH诱导产生,但NO同时与超氧化物反应,产生的羟基基团及过氧亚硝酸盐会对细胞造成损害,可诱导细胞凋亡[23]。而当α-MSH分泌水平提高,可下调NOS2的产生,从而使NO含量减少,抑制细胞发生病变及死亡。
3.4 与刺鼠信号蛋白相互拮抗
刺鼠信号蛋白(ASIP)由乳头状细胞所分泌的信号蛋白,而乳头状细胞与黑色素细胞相邻近,其编码通过刺鼠基因位点完成,基因表达后可合成具有131个氨基酸的ASIP,而ASIP的表达可合成暗黑素[24]。因MC1R同时是α-MSH和刺鼠信号蛋白的受体,故对其亲和力类似。Swope等[25]向培养液添加利用重组DNA 技术并除去其余杂质与其它蛋白的ASIP 刺激黑素细胞,发现ASIP可直接作用于受体MC1R,使培养液中cAMP含量降低,进一步导致TYR 活性下调,其下调程度与ASIP 剂量呈明显相关;此外,络氨酸酶相关蛋白1、2活性受到抑制,且暗黑色素合成显著增多,而真黑色素显著降低,暗黑素约占总黑素的91%。由此可知,α-MSH对ASIP有拮抗作用,ASIP可与α-MSH竞争结合MC1R,降低cAMP的含量,进而通过级联反应抑制真黑色素的合成,最终影响真黑素与褐黑素水平的比例,影响动物皮肤的颜色和毛色。同时,刺鼠信号蛋白会阻碍α-MSH 和MC1R 的联结反应,同理α-MSH 对刺鼠信号蛋白和MC1R 之间的连接也有抑止作用,即刺鼠信号蛋白、α-黑素细胞刺激素及MC1R之间的联结是相互排斥的。有学者推测其可能是受体结合某一配基后,该受体的立体异构将会产生差异,从而阻碍了另一配基结合受体,这种排斥作用导致其生物学作用的发挥无法正常进行。然而,即使ASIP刺激黑素细胞后弱化了TYR的表达,但TYR的合成分泌能力并没有完全丧失,因为暗黑素的合成也离不开TYR的催化作用,故从另一个角度看,ASIP结合受体MC1R后具有减弱α-MSH过度促进黑色素合成的效果,使生成黑色素的类型发生变化,以减弱黑色素的沉积。
3.5 提高MC1R、MITF和TYR基因表达量
MC1R 受体可被α-MSH 激活,TYR 是产生黑色素的反应限速酶,而小眼畸形相关转录因子(MITF)基因定位于3号染色体上,其表达过程有多个启动子共同调控,DNA可转录形成众多蛋白异聚体复合物,其中MITF-M 对黑色素细胞质的表达具有特异性[26]。于志慧等[27]研究发现,体外培养的TYR、MC1R 及MITF 基因表达水平随α-MSH浓度增高而上升,且黑素细胞形成树突与α-黑素细胞刺激素和MC1R的连接、参与TYR途径及调控小眼畸形相关转录因子等均密切相关。小眼畸形相关转录因子和酪氨酸酶mRNA在皮肤中的表达量最高,而在肌肉组织中表达含量最低,其中肾脏表达含量又高于肌胃,肌胃高于肝脏,此结果大致与乌骨鸡各组织黑色素沉积含量的规律相符合。在黑色素细胞生长过程中涉及转录因子MITF 的参与并发挥关键作用,α-MSH 刺激MC1R、MITF 的表达有上调cAMP 信号通路及MAPK 级联反应两种方式,后者可推进相关转录因子磷酸化后经MITF转录因子作为媒介与转导,最后作用于TYR基因家族的启动子特定区域,参与调控黑色素的合成。郑嫩珠等[28]也指出促进黑素生成的cAMP 途径,这一连串反应有磷酸化的转录因子和蛋白激酶A 的参与,促进了MITF 及TYR 的合成与分泌。由此可知,α-MSH 在黑色素合成过程中刺激MC1R 与G 蛋白耦联经cAMP信号途径,可上调MITF基因和蛋白表达水平,而MITF 在调节TYR 的合成与分泌过程中具有重要作用,进而通过调控TYR在黑色素细胞的表达介导黑色素合成。
4 抑制α-MSH作用的因素
4.1 姜黄酮
芳香(ar)姜黄酮是一种天然的姜黄油,最初是从姜黄龙眼中分离出来的,几个世纪以来在东南亚一直被用作药物和食物。研究证明,芳香(ar)-姜黄酮对B16F10 黑色素瘤细胞中α-MSH和3-异丁基-1-甲氧基-氨酸(IBMX)诱导的黑色素生成和信号通路有抑制作用[29]。其结果显示α-MSH 和(IBMX)可刺激B16F10 细胞中络氨酸酶及其多种相关蛋白如TRP-1 的表达,而芳香(ar)-姜黄酮对其表达水平有抑制作用。且ar-姜黄酮可通过抑制α-MSH刺激的B16F10细胞中环腺苷酸反应元件结合蛋白的活性,强烈抑制了α-MSH 和IBMX 诱导的微邻苯二甲酸盐相关的转录因子。Bonhee 等[30]指出,四氢姜黄素也可减弱α-MSH在B16F10细胞中对黑素合成的促进作用,下调络氨酸蛋白和MITF表达水平,并使络氨酸酶活性降低。此外,与姜黄素相比,ar-姜黄酮具有更佳的抑制作用。
4.2 乙醇提取物
近年来,海洋自然资源因其成分多样化和绿色安全特性,已经被广泛应用开发到药物、食品及畜牧等行业。褐藻是已知的具有丰富化合物的藻类,从褐藻中提取的乙醇提取物(ESS)可显著减少黑色素合成α-MSH 刺激B16F10 细胞。Mohammed等[31]分析,ESS可通过环磷腺苷小分子在细胞内传递相关信息,下调CREB蛋白的表达,CREB 可参与介导的小邻苯二甲酸基因的转录,调节其表达水平,从而减弱促黑素酶、TYR、TRP-1 的表达,同时抑制cAMP 的积累、抑制CREB 磷酸化。并且,EPK 是细胞外表达的调节信号传导的相关酶,ESS 可使ERK 活化,而不能使Akt 和其它蛋白激酶得以活化,后者负责翻译后降低MITF 表达水平。因此,ESS 减弱α-MSH刺激B16F10 细胞色素沉着过的是通过调制分子ERK信号通路[32]。
4.3 lpa-miR-nov-66
MicroRNAs(miRNAs)为一种参与调控生物体合成的内部因素合成的非编码核糖核酸,普遍分布于真核生物中,其中最新研究发现的miRNAs对机体分泌黑色素非常关键,在黑色素的产生及沉积为颗粒过程中亦发挥重要功能。姬凯元等[33]研究发现,培养基中单独添加α-MSH可降低内源性lpa-miR-nov-66的表达水平。可溶性鸟氨酸环化酶(sGC)对GTP 转化为cGMP 有催化作用,是lpa-miR-nov-66 的靶基因之一,并提供了一个重要的第二信使cAMP 参与调解蛋白激酶、磷酸二脂酶和离子通道[34]。研究表明,lpa-miR-nov-66导入外源DNA 转化后结合α-MSH 较于只用α-MSH 处理,TYRP2 的转录和翻译水平升高,而TYR、MITF 在编码合成过程中的表达都较弱,使得cAMP的产量及黑色素合成含量下降。并得出结论,miRNAs 抑制α-MSH 在推进合成黑色素的表达是通过调节黑色素细胞中重要的cAMP路径实现的。
5 结语与展望
在乌骨鸡体内,α-MSH 可与MC1R 结合、介导黑色素合成相关信号传导过程,通过与紫外线协同作用、促进黑色素细胞增殖、保护黑素细胞、与刺鼠信号蛋白相互拮抗等多种途径参与调控乌骨鸡黑色素的合成,姜黄酮、乙醇提取物及lpa-miR-nov-66 等可抑制α-MSH 的促进作用。而乌骨鸡黑色素是滋补、防衰老及强身健体的物质,研究α-MSH对乌骨鸡黑色素合成机制的影响有利于促进黑色素沉积,但目前乌骨鸡黑色素的合成与作用机制尚未完全明确,对乌骨鸡黑色素的加工水平还停留在酶解技术。若未来从其分子量、结构及功能等分子理论水平着手对乌骨鸡黑色素合成过程、沉积机制及提取技术开展更深入地研究,相信会更有利于发掘利用其入药功效及食用价值。乌骨鸡黑色素不仅可以用于别的黑色食品中为其提高色泽效果,而且还能加工成新兴的具有保健功效的食品与饮料,推动黑色食品的发展。
