实时PCR检测食品中荧光假单胞菌方法的建立
2020-12-29周雨蕾侯温甫王宏勋
闵 可,张 政,周雨蕾,侯温甫,王宏勋,周 敏
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
荧光假单胞菌(Pseudomonas fluorescens)是一种嗜冷菌,革兰氏阴性菌,一种典型的条件致病菌[1]。可分泌黄绿色荧光色素,产生耐热的蛋白酶和脂肪酶[2]。 荧光假单胞菌能在冷藏的高蛋白、高脂肪食品中快速大量繁殖,造成严重的腐败问题[3];污染血液制品会导致输血病人休克[4];污染奶制品会影响奶制品的物理品质与感官品质[5]。在高温处理后这些酶依旧有活性,影响乳制品品质、保质期[6]。
目前,关于荧光假单胞菌的检测国内以培养法为标准,传统检测方法耗时长、成本高、重复性低。满足当下高通量快速检测食品、科研和生产等要求需要更先进的技术。基于分子生物学的发展,微生物检测技术也都得到很大提升。Scarpellini等[7]针对16S rRNA基因设计引物用于聚合酶链式反应(polymerase chain reaction,PCR)检测荧光假单胞菌,常被应用于检测和鉴定荧光假单胞菌。黄迅辰[8]建立以免疫磁珠为基础的ELISA方法。Liang Xin等[9]基于脂肪酶基因用环介导等温扩增技术检测牛奶中的荧光假单胞菌。杨一林等[10]针对gyrB基因建立了常规PCR检测荧光假单胞菌方法并进行评价。食品因其成分复杂、结构多样、各种微生物动态变化含量未知、提取出的模板DNA可能有PCR抑制成分等造成食品微生物检测难度增加[11-12]。引物特异性强可鉴别目的菌,降低假阳性结果;引物灵敏度高可在目的菌含量低的情况下也能检出目的菌;较好的抗干扰能力是食品微生物检测实际应用中的要求之一。
TaqMan探针real-time PCR因其耗时短、特异性强、灵敏度高被用于食源性致病菌的检测[13-15]。本实验针对gyrB基因设计3 对引物和探针,并通过初步特异性验证,筛选1 对特异性最佳引物和TaqMan探针,建立荧光假单胞菌real-time PCR检测体系,并对其进行系统评价,考察其特异性、灵敏度、抗干扰能力等指标。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
本研究所用菌株:荧光假单胞菌11 株,假单胞菌属其他种类细菌10 株,非假单胞菌的常见食源性致病菌17 株。标准菌株购于中国科学院微生物研究所菌种保藏中心、中国医学微生物菌种保藏中心、中国工业微生物菌种库、中国检科院食品安全微生物菌种保藏管理中心,本实验室分离保存的荧光假单胞菌编号为AS1。
1.1.2 试剂
营养肉汤(nutrient broth,NB)培养基 北京陆桥技术股份有限公司;缓冲蛋白胨水 青岛海博生物技术有限公司;基因组DNA提取试剂盒、DNA凝胶回收试剂盒 天根生化科技有限公司;Premix ExTaqTM、pMD19-T载体、gyrBF/R、TaqMan探针 大连宝生物工程有限公司。
1.2 仪器与设备
DRP-9082恒温菌种培养箱 上海森信实验仪器有限公司;SW-CJ-2FD超净工作台 苏州净化有限公司;SIGMA 3K15高速离心机、CFX CONNECT BIO-RAD MS-2 real-time PCR仪、ChemiDoc MP BIO-RAD化学发光凝胶成像系统、One ND-2000微量核酸蛋白质浓度测定仪 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 菌株培养
28 ℃、150 r/min摇床培养荧光假单胞菌;同时37 ℃、150 r/min摇床培养非荧光假单胞菌的所有菌株。
1.3.2 基因组DNA提取
按照基因组DNA提取试剂盒说明书提取。
菌体收集:收集1.0 mL菌体,离心后弃上清液。
革兰氏阳性菌裂解方法:加入500 μL缓冲液BS、50 μL溶菌酶充分吸打混匀,37 ℃水浴温育60 min,12 000 r/min离心5 min,弃去上清液。加入180 μL缓冲液GL、20 μL的蛋白酶K和10 μL核糖核酸内切酶充分吸打混匀,56 ℃水浴温育10 min。加入200 μL缓冲液GB和200 μL纯乙醇并混匀。革兰氏阴性菌裂解方法:加入180 μL缓冲液GL、20 μL蛋白酶K和10 μL核糖核酸内切酶充分振荡混匀。56 ℃水浴消化裂解10 min,分别加入200 μL的缓冲液GB、纯乙醇,再充分混匀。
将Spin Column安装在Collection Tube上,溶液移至Spin Column柱中,12 000 r/min离心2 min,弃滤液。将500 μL的缓冲液WA加到柱内,12 000 r/min离心2 min后弃滤液,重复1 次。加入80 μL重蒸水,静止5 min后离心得基因组DNA,于4 ℃保存。
1.3.3 引物与TaqMan探针的设计
使用软件Primer express 3.0,以荧光假单胞菌AS1.823的gyrB基因为模板设计检测引物和探针,结果如表1所示。

表1 引物和探针序列信息Table 1 Sequences of the primers and probes used in this study
1.3.4 real-time PCR体系组成与反应条件

表2 PCR体系组成Table 2 Composition of the PCR reaction system
PCR体系组成如表2所示。real-time PCR程序参数:94 ℃预变性2 min;94 ℃变性5 s,60 ℃退火45 s,72 ℃延伸1 min,循环36 次。
1.3.5 标准曲线绘制
以10 倍梯度稀释上述标准质粒,并取每个梯度5 μL作为real-time PCR扩增的模板,重复3 次。标准曲线横坐标为标准质粒扩增得到的扩增循环数(Ct值),DNA模板量的对数(lgC)为纵坐标绘制标准曲线。
1.3.6 real-time PCR检测体系评价
1.3.6.1 特异性评价
提取所有菌株基因组DNA,以双蒸水为空白对照,采用本实验方法对所有菌株检测进行real-time PCR扩增。如果Ct值小于35,判断检出结果为阳性。
1.3.6.2 灵敏度评价
基因组DNA灵敏度评价:使用试剂盒提取荧光假单胞菌(AS1.823)基因组DNA。将基因组DNA进行10 倍梯度稀释后测定核酸浓度,对每个稀释度分别进行PCR扩增,每个梯度重复3 次,能得到明显扩增曲线的最低浓度梯度即为real-time PCR检测体系灵敏度。
如在强化学生关于侧面描写和正面描写两种写作技巧时,笔者选取了《口技》一文作为讲解范例,笔者让学生在已经理解文意的基础上再次阅读,并根据“梦中惊醒”“渐入梦乡”和“火起群乱”三方面梳理文章的写作顺序,剖析该文章描写技巧的使用,而在学生对侧面描写与正面描写有所认知后,笔者又布置了与之相关的“音乐”描写,并让学生在写作过程中采用侧面描写与正面描写两种写作技巧,使得学生所掌握的理论知识能够快速有效地与实践经验结合,真正提升其写作水平。
纯培养物水平灵敏度检测:荧光假单胞菌培养至稳定期,进行10 倍梯度稀释,选择10-6、10-7和10-8这3 个稀释倍数的菌液进行平板计数。提取基因组DNA,以ddH2O为空白对照,分别进行real-time PCR,重复3 次。
1.3.6.3 抗干扰能力评价
选取类产碱假单胞菌(P. pseudoalcaligenesIQCC12603)、门多萨假单胞菌(P. mendocinaCICC21629)、恶臭假单胞菌(P. putidaCICC21884)、铜绿假单胞菌(P. aeruginosaIQCC12625)4 株干扰菌,与荧光假单胞菌分别培养至稳定期,1 0 倍梯度稀释后,选择平板计数法得到菌量。将4 种干扰菌混合,设置1 04、1 06、1 083 个干扰浓度,与荧光假单胞菌不同梯度稀释液(1 0-4~ 10-10)分别混合,以不加入荧光假单胞菌的干扰菌混合液为空白对照,在28 ℃、150 r/min条件下培养,于第0小时和第15小时分别取样1 次,使用试剂盒提取基因组DNA,分别进行real-time PCR。
1.3.6.4 样品接菌检测验证
选取荧光假单胞菌菌液接入NB培养基中,放置于摇床28 ℃、150 r/min培养至稳定期,10 倍梯度稀释,进行平板计数。向225 mL选择性增菌液中接入25 mL全脂灭菌纯牛奶,分别接入0.1~1、1~10、10~100 CFU/mL 3 个梯度的菌液1 mL平行3 次,于0~24 h内每隔3 h取样一次,试剂盒提取基因组DNA,分别进行real-time PCR扩增,以无菌水为空白对照。
2 结果与分析
2.1 引物和探针的筛选与特异性评价

表3 菌种编号及特异性检测结果Table 3 Strains used in specificity evaluation of PCR
使用常规PCR初步筛选引物,得出引物gyrB8-1特异性最好。再通过real-time PCR特异性筛选,得出探针gyrB TaqMan1效果最好。利用引物gyrB8-1、探针gyrB TaqMan1对所有实验菌株分别进行检测,结果如表3所示。以荧光假单胞菌的基因组DNA为模板时,扩增Ct值均小于35,而以非荧光假单胞菌基因组DNA为模板则未出现PCR扩增。与常规PCR比较,基于TaqMan探针的real-time PCR方法采用了特异探针可识别目的片断,与扩增引物的特异性相叠加,且回避了分析扩增产物大小来判断扩增结果,可有效增强体系的特异性;不需在扩增结束后分析熔解曲线,更缩短了检测时长[17]。
2.2 标准曲线绘制
按照本实验制得的标准质粒D N A 质量浓度为 3.55 ng/μL,换算为9.58×109copies/μL,根据1.3.5节方法单独绘制标准曲线(图1),得到y=-0.235 9x+11.053,相关系数R2为0.99,表明该曲线呈现良好的线性关系,本体系扩增效率很好。
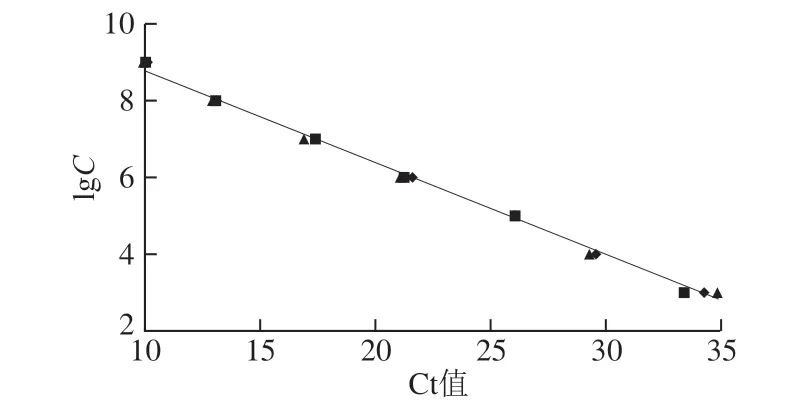
图1 荧光假单胞菌定量检测标准曲线Fig. 1 Standard curve of real-time PCR
2.3 灵敏度评价
提取出的DNA初始质量浓度为1.43×104fg/μL,以10 倍梯度稀释,最小质量浓度为1.43×10-2fg/μL。如表4所示,在基因组DNA模板的终质量浓度为14.3 fg/μL(2~3 copies/μL)时,3 个平行都能读出Ct值。而当模板终质量浓度为1.43 fg/μL时,3 个平行中只有1 个能读出Ct值,说明该real-time PCR检测体系的扩增灵敏度为14.3 fg/μL。
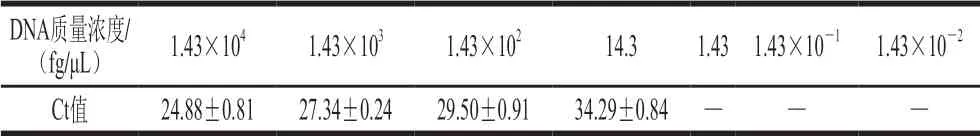
表4 DNA质量浓度与值关系(AS1.823)Table 4 Relationship between DNA concentration and Ct (AS1.823)
将培养12 h的荧光假单胞菌AS1.823进行平板计数,算得起始菌液浓度为3.0×109CFU/mL。如表5所示,在稀释度为10-7时3 个平行都能读出Ct值,而在稀释度为10-8时3 个平行都不能读出Ct值,则该real-time PCR检测体系的纯培养物水平灵敏度为3.0×102CFU/mL。
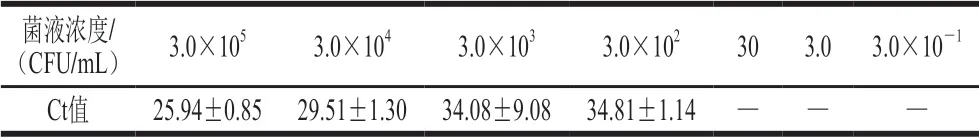
表5 纯培养物浓度与Ct值关系(AS1.823)Table 5 Relationship between pure culture of AS1.823 and Ct
2.4 抗干扰能力评价
荧光假单胞菌和类产碱假单胞菌(IQCC12603)、门多萨假单胞菌(CICC21629)、恶臭假单胞菌(CICC21884)、铜绿假单胞菌(IQCC12625)4 株干扰菌活化后分别培养至稳定期,进行平板计数,计算得到起始菌液浓度分别为1.4×109、5.7×108、3.4×109、4.5×109、6.0×108CFU/mL。如表6所示,添加低浓度约1.4×104CFU/mL的干扰菌纯培养物时,不影响本实验real-time PCR检测体系的灵敏度,而添加高浓度约5.6×108CFU/mL的干扰菌纯培养物时,本实验中real-time PCR检测体系的检测限下降到3.0×103CFU/mL。杨一林等[10]建立的常规PCR检测方法灵敏度为3.0×104CFU/mL。 说明本实验设计的引物gyrB8-1探针gyrB TaqMan1 real-time PCR方法与常规PCR系统相比较具有更强的抗干扰能力。在实际的食品微生物检测中,样品自带的各种微生物会形成干扰,检测体系的抗干扰能力强有助于检测方法的实际推广。从这一角度看,TaqMan探针法荧光定量体系更适合实际检测[18-19]。

表6 添加干扰菌情况下对检测灵敏度的影响Table 6 Effect of adding interfering bacteria on the sensitivity of PCR
2.5 样品接菌检测验证
将浓度为22、2.2、0.22 CFU/mL的菌液按照1.3.6.4节的操作方法加入全脂灭菌纯牛奶,每个浓度3 组平行,0~24 h每隔3 h取样1 次进行real-time PCR检测。如表7所示,当接入22 CFU/mL的荧光假单胞菌,增菌12 h可检测到荧光假单胞菌;当接入2.2 CFU/mL的荧光假单胞菌,增菌15 h检测呈阳性;接菌量为0.22 CFU/mL、增菌24 h后仅有1 组被检出。实验表明适当的增菌可帮助检出荧光假单胞菌。
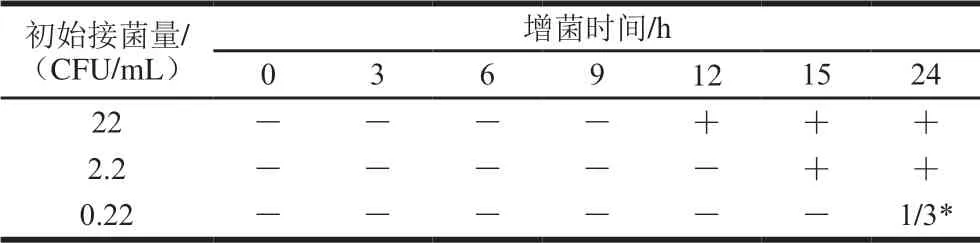
表7 人工污染样品的PCR检测结果Table 7 Results of PCR detection of artificial contamination
3 讨 论
荧光假单胞菌的快速检测对食品工业和公众健康至关重要。虽然荧光假单胞菌对健康人不具有致病性,日常烹饪加热即可杀死,但随着冰箱的普及,人们对奶、肉制品的需求增多,食用凉拌食品,荧光假单胞菌比以往更能威胁公众健康[20]。
分子生物学的发展为食品检测提供了新的检测方法,相比传统检测方法,分子生物学方法拥有传统检测方法达不到的优势[21]。聚合酶链反应衍生出一系列的新技术,例如real-time PCR、变性梯度凝胶电泳、多重PCR、巢式PCR、免疫PCR、热启动PCR、环介导等温核酸扩增等,这些先进的方法已被用于病原体、致病微生物、寄生虫、比病理检测等[22-24]。
通过监视插入染料、荧光标记引物或序列特异性探针产生的荧光,real-time PCR可在整个热循环过程中的计算机屏幕上观察每个DNA扩增周期。特异性探针有助于提高特异性、提高灵敏度,real-time PCR检测的好处超过传统的端点检测方法包括动态范围大,交叉污染的风险降低,可扩展以用于高通量应用,并有可能精确目标量化[25]。 而real-time PCR另一个主要优点是不需要琼脂糖凝胶电泳可视化扩增的目标DNA,这大大缩短了分析时间[26]。
本研究基于前人基础,选择荧光假单胞菌特异靶位点gyrB基因[27],建立的标准曲线DNA浓度与Ct值呈良好线性关系,R2=0.99,设计的引物与探针对除荧光假单胞菌以外的假单胞菌、常见食源性致病菌均无扩增、没有假阳性、特异性好,与高琳等[28]建立基于gyrB基因以及apr基因的食品中荧光假单胞菌双重PCR检测方法比较,得出灵敏度为16.9 fg/μL,本实验在基因组DNA方面评价灵敏度为14.3 fg/μL,且本实验做了不同浓度纯培养物提取DNA检测灵敏度,结果为3.0× 102CFU/mL。考虑到实际检测中样品含未知的不同病原菌,本实验设计了添加4 种假单胞菌属的其他菌作为干扰菌评价本检测方法的抗干扰能力,结果表明低干扰菌存在下对检测结果无影响,高浓度干扰菌添加组经过15 h增菌检测限依旧可达到3.0×103CFU/mL,依然比常规培养检测方法快速。
检验检测技术已取得长足发展,各种先进方法都在为食品安全、人民健康保驾护航。在荧光假单胞菌检测以及其他病原微生物检测中仍有许多目标没有达到,比如满足现场检测、进一步提高检测速度、实验仪器微型化降低成本、提高实验可重复性、减少假阳性等[29-30]。2 种及以上的分子检测手段联合使用可提高检测速度同时保证分析的准确性[31],将是未来检测荧光假单胞菌的研究方向。
4 结 论
本研究基于引物gyrB8-1、探针gyrB TaqMan1建立real-time PCR法,可特异性检测荧光假单胞菌;基因水平扩增灵敏度为14.3 fg/μL;添加低浓度非荧光假单胞菌,干扰浓度添加高浓度约5.6×108CFU/mL时,检测限下降到3.0×103CFU/mL;荧光假单胞菌22 CFU/mL污染样品,增菌12 h,对荧光假单胞菌的检测结果无影响。本检测方法特异性强、灵敏度高、抗干扰性好、检测限低,可缩短检测周期、节约试剂与人力成本、符合大批量检测要求,可用于快速检测荧光假单胞菌。
