呋喃它酮代谢物单链抗体制备和酶联免疫分析方法
2020-12-29杨武英洪艳平徐振林沈玉栋柯法钧陈薪竹孙远明
杨武英,王 弘,洪艳平,王 丹,徐振林,沈玉栋,柯法钧,陈薪竹,孙远明,
(1.南昌市农产品加工与质量控制重点实验室,江西农业大学食品科学与工程学院,江西 南昌 330045;2.广东省食品质量安全重点实验室,华南农业大学食品学院,广东 广州 510642)
兽药残留严重影响动物性食品的安全,威胁消费者的身体健康,制约我国动物性食品的出口。养殖户在动物饲养过程中不遵守休药期的规定、非法使用违禁药物、滥用抗菌药物和饲料添加剂是造成动物性食品兽药残留超标的主要原因。呋喃它酮是人工合成的硝基呋喃类广谱抗生素,有很好的消炎抑菌及促进动物生长的作用,曾被广泛应用于畜禽和水产养殖业。有关研究证明呋喃它酮原药及其代谢物具有相当大的毒性和致癌致畸致突变作用[1-2]。鉴于呋喃它酮及其代谢物的危害性,1995年起欧美多国禁止其在动物生产中使用,我国2002年也规定动物性食品中不得检出[3-4]。由于呋喃它酮药效好、合成比较容易、价格便宜,受经济利益驱使,目前包括中国在内的很多国家非法使用仍然比较严重,所以加强对动物性食品中呋喃它酮及其代谢物的检测监控显得十分紧迫和必要[5-6]。
呋喃它酮原药摄入到动物体内后迅速被分解代谢,难以直接检测,其代谢物却能迅速结合动物组织中的蛋白质,可以稳定存在6~8 个星期,常用的食物制作方法如烹饪、烘焙、微波等均无法使其降解。动物性食品中的呋喃它酮代谢物残留在人类胃的酸性环境中可以通过水解释放出来,被吸收进入体内对人类健康造成危害[7]。因此测定动物组织中代谢物残留比检测呋喃它酮原药更具有现实意义。呋喃它酮的代谢物是5-吗啉甲基-3-氨基-2-恶唑烷基酮(5-morpholinemethyl-3-amino-2-oxazolidinone,AMOZ),兽药残留监测部门通常将AMOZ作为监测呋喃它酮残留的标示物。
AMOZ的检测方法主要有仪器分析法[8-14]和免疫分析法[15-23]。仪器分析法具有准确、灵敏、特异性好和假阳性率低的优点,但存在检测速度慢、需要昂贵仪器和专业操作人员等不足,难以满足目前高通量、快速、现场检测的需要,不易普及推广。免疫分析法具有操作简便、灵敏度高、特异性强、高通量、低成本等优势,容易实现现场快速检测,适合大量样品的快速筛查,弥补了AMOZ残留仪器分析法的不足。
抗体制备是免疫分析法的关键技术之一,抗体的制备技术经历了多克隆抗体制备、单克隆抗体制备、基因工程抗体制备3 个发展阶段。单链抗体(singlechain variable fragment,scFv)是由一段柔性的小肽链(linker)将抗体重链可变区(heavy chain variable fragment,VH)基因、轻链可变区(light chain variable fragment,VL)基因首尾相接表达得到的一种重要的小分子基因工程抗体,具有和母本抗体相近的特异性和亲和力,通过微生物发酵可以快速大量制备,制备技术较简单,生产周期短、成本低,近年来在农兽药残留免疫检测方面展示了广阔的应用前景。目前文献报道的AMOZ残留免疫检测方法都是利用传统的多抗或单抗建立的,利用基因工程scFv建立的酶联免疫吸附分析法鲜见报道。本实验从前期获得的抗AMOZ衍生物单克隆抗体阳性杂交瘤细胞出发,采用基因工程抗体技术,开展抗AMOZ衍生物重组scFv制备及基于scFv的AMOZ残留间接竞争酶联免疫吸附分析方法(indirect competitive enzyme-linked immunosorbent assay,icELISA)研究,并用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)) 法对建立的icELISA方法进行验证。
1 材料与方法
1.1 材料与试剂
基围虾购于当地超市,经验证为阴性样品。
5-甲基吗啉-3-(乙醛氨基)-2-恶唑烷基酮-卵白蛋白(5-morpholinomethyl-3-(glyoxalamino)-2-oxazolidinoneovalbumin,AMOZA-OVA)包被原、抗AMOZ衍生物单克隆抗体阳性杂交瘤细胞6E2由本研究室制备保存;抑制药物5-甲基吗啉-3-(2-硝基苄基氨基)-2-唑烷基酮(5-morpholinomethyl-3-(2-nitrobenzylidenamino)-2-oxazolidinone,NPAMOZ)、硝基呋喃类抗生素及其代谢物标准品 德国Merck公司;聚合酶链式反应(polymerase chain reaction,PCR)引物 上海英骏生物技术有限公司(表1);质粒提取试剂盒 北京天根生物技术有限公司;各种工具酶 美国Fermetas 公司;鼠抗His标签单克隆抗体、羊抗鼠IgG-HRP 北京 全式金生物技术有限公司;大肠杆菌BL21(DE3)、 pET-22b(+)载体由本研究室保存;Ni亲和柱 美国GE Healthcare公司;其他试剂均为进口或国产分析纯及色谱纯。

表1 VH和VL基因的扩增引物 Table 1 Primer sequences used for PCR amplification of VH and VL genes
1.2 仪器与设备
PCR扩增仪、DNA电泳设备、GDS7500型凝胶成像系统、半干转印仪 美国Bio-Rad公司;DM 530核酸蛋白分析仪 美国Beckman公司; Ni-NAT亲和柱 德国Novagen公司;Multiskan MK3多功能酶标仪 美国Thermo公司;1200-6410A型HPLCMS/MS联用仪 美国Agilent公司。
1.3 方法
1.3.1 抗AMOZ衍生物scFv基因构建和鉴定
复苏抗AMOZ衍生物单克隆抗体阳性杂交瘤细胞,用Trizol试剂提取总RNA,逆转录PCR扩增抗体VH和VL基因,通过(G1y4Ser)3连接肽采用重叠延伸聚合酶链式反应(splicing overlap extension-polymerase chain reaction,SOE-PCR)技术构建抗AMOZ衍生物scFv基因,再把该基因克隆到表达载体pET-22b(+)上并转化到大肠杆菌BL21(DE3)中,提取重组转化子质粒进行双酶切及PCR扩增鉴定,将鉴定正确的阳性重组子质粒送基因公司进行测序[24]。
1.3.2 抗AMOZ衍生物scFv表达、纯化和活性鉴定
摇瓶培养抗AMOZ衍生物scFv阳性克隆菌,采用异丙基β-D-硫代半乳糖苷(isopropylβ-Dthiogalactopyranoside,IPTG)进行诱导表达,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和Western blotting鉴定抗体的表达,Ni亲和柱纯化scFv蛋白,最后得到的scFv分装,于-20 ℃贮存备用。采用Bradford法测定scFv质量浓度,通过12% SDS-PAGE采用Quantity one凝胶分析软件测定scFv纯度,采用间接ELISA测定scFv的效价,采用间接竞争ELISA测定scFv的活性[25-27]。
1.3.3 icELISA检测方法的建立和方法特异性评价
用一定浓度的AMOZA-OVA包被原包被酶标板,每孔100 μL,37 ℃温育过夜,甩干孔内液体,用洗液洗涤3 次后每孔加入120 μL封闭液,37 ℃封闭3 h,洗涤3 次后将酶标板于37 ℃烘干备用;取出需要数量的微孔板,每孔加入50 μL抗AMOZ衍生物scFv稀释液和50 μL抑制药物NPAMOZ稀释液,轻轻振荡混匀,37 ℃孵育45 min后取出洗板5 次,拍干;每孔加100 μL稀释一定倍数的抗His标签抗体,轻轻振荡混匀,37 ℃孵育45 min后取出洗板5 次,拍干;每孔加入100 μL HRP-羊抗鼠IgG,轻轻振荡混匀,37 ℃孵育45 min后取出洗板5 次,拍干;每孔加入显色液100 μL,37 ℃显色10 min;每孔加入50 μL的终止液(10% H2SO4)终止反应,用酶标仪测定450 nm波长处的光密度(optical density,OD)值。采用棋盘滴定实验优化AMOZA-OVA包被原包被浓度和scFv稀释度。在优化的实验条件下,以NPAMOZ质量浓度的对数为横坐标,B/B0为纵坐标(B为添加NPAMOZ时的OD值,B0为不添加NPAMOZ时的OD值),采用OriginPro 8.5软件按照四参数对数拟合绘制NPAMOZ标准曲线。选择与NPAMOZ结构相似的其他硝基呋喃类抗生素及其代谢物对建立的icELISA方法进行特异性评价。
1.3.4 样品前处理方法的初步确定
参考文献[28]并做一定的改进。步骤如下:新鲜虾肉剁碎成肉末,再用组织捣碎机捣碎样品成为均质, -20 ℃保存备用。称取1 g均质好的虾肉样品于离心管中,加入4 mL的蒸馏水,0.5 mL 1 mol/L的HCl溶液和100 μL样本衍生试剂,充分振荡,37 ℃恒温水浴条件下孵育过夜;取出后加入0.4 mL 1 mol/L NaOH溶液,5 mL 0.1 mol/L K2HPO4溶液和5 mL的乙酸乙酯,剧烈振荡30 s,5 000 r/min离心10 min,乙酸乙酯再重复提取一次;2 次乙酸乙酯层取出合并于另一离心管中,氮气吹干,用1 mL的正己烷溶解干燥物,再加0.5 mL含吐温-20的磷酸盐缓冲溶液,轻轻振荡混匀,5 000 r/min离心10 min,下层液体用于icELISA分析。
1.3.5 AMOZ衍生条件的优化
实际动物性食品样品中残留的是代谢物AMOZ,添加回收实验中添加物也是代谢物AMOZ,需要用衍生试剂硝基苯甲醛(nitrobenzaldehyde,NBA)把AMOZ衍生成NPAMOZ才能进行免疫检测。因为前处理时样品中的AMOZ不可能100%衍生为NPAMOZ,所以衍生率的高低对实验结果影响很大。本实验以AMOZ标准品作为研究对象进行衍生条件的优化研究,在衍生率测定时只添加AMOZ标准品,不添加实际样品,按照1.3.4节方法进行前处理,采用icELISA检测NPAMOZ的量,再换算为AMOZ标准品的量,测定所得AMOZ标准品的量除以实际添加AMOZ标准品的量得AMOZ的衍生率。对衍生试剂种类、衍生试剂用量、衍生温度、衍生时间等影响衍生率的关键因素进行优化,选取最优衍生条件进行1.3.6节中实际样品添加回收率的测定。
1.3.6 添加回收率的测定
称取1 g均质好的阴性虾肉样品于离心管中,分别按100、50、10、3 ng/g的比例添加AMOZ标准品溶液,每个添加水平做3 个平行,按照1.3.5节优化后的衍生条件进行AMOZ衍生操作,再对衍生得到的NPAMOZ进行提取和净化处理,最后用icELISA测定NPAMOZ实际检出量,再换算成AMOZ回收检出量,计算回收率。用不添加AMOZ标样的虾肉样品做阴性对照,前处理方法同加标样品。将NPAMOZ实际检出量(mNPAMOZ)代入下式计算AMOZ回收检出量(mAMOZ):

式中:mNPAMOZ为NPAMOZ实际检出量/ng;MNPAMOZ为NPAMOZ的相对分子质量;MAMOZ为AMOZ的相对分子质量;N为AMOZ衍生为NPAMOZ的衍生率/%。
1.3.7 HPLC-MS/MS方法验证
虾肉样品前处理同1.3.6节,采用外标法进行HPLCMS/MS方法验证[29-30],HPLC-MS/MS测定结果和icELISA测定结果进行相关性分析。
色谱条件:色谱柱为ZORBAX SB-C18(2.1 mm× 150 mm,3.5 μm);流动相由0.1%甲酸(A)和乙腈(B)组成,梯度洗脱程序为:0 min,22% B、78% A;0~6 min,22%~99% B、78%~1% A;6~9 min,99% B、1% A;9~9.1 min,99%~22% B、1%~78% A;9.1~15 min,22% B、78% A;流速:0.3 mL/min;进样量:5 μL;柱温:40 ℃。
质谱条件:电喷雾离子源(electrospray ionization,ESI),正离子扫描,多反应监测模式;毛细管电压:4.0 kV;干燥气温度:350 ℃;干燥气流速:10 L/min;雾化器压力:35 psi;定性、定量离子对:m/z 335.1>262.4、335.1>291.4*(*为定量离子);驻留时间:60 ms;碎裂电压:70 V;碰撞能:19、15 eV。
1.4 数据处理
采用Excel 2010软件进行平均值及标准差计算;采用Microsoft Office Word 2010软件绘制表格;采用OriginPro 8.5软件作图并进行数据统计分析;电泳图采用Quantity One分析软件进行图象采集、定量和分析。
2 结果与分析
2.1 抗AMOZ衍生物scFv基因构建和鉴定

图1 重叠延伸扩增电泳鉴定(A)、阳性转化子质粒PCR扩增 鉴定(B)和双酶切鉴定(C) Fig. 1 Identification of SOE-PCR amplification of scFv (A), recombinant plasmid pET22b(+)-scFv by PCR (B) and double restriction enzyme digestion (C)
SOE-PCR扩增电泳鉴定结果和阳性转化子质粒的双酶切鉴定和PCR扩增鉴定结果如图1所示。从图1A可知,SOE-PCR扩增后得到碱基长度约为750 bp的scFv基因,与预期片段大小一致。从图1B、C可知,阳性转化子质粒经双酶切和PCR扩增后,都得到了约750 bp大小的条带,表明scFv基因已经成功克隆到pET22b(+)表达载体上并转化到大肠杆菌BL21(DE3)中。将PCR和双酶切鉴定正确的阳性重组子质粒进行测序鉴定,得到的scFv基因序列如图2所示。可以看出,抗AMOZ衍生物单克隆抗体的VH和VL基因大小分别为348 bp和321 bp,抗体VH和VL基因已由45 bp的linker连接在了一起,形成了正确的抗AMOZ衍生物scFv基因结构,没有发生移码现象。

图2 抗AMOZ衍生物scFv基因全序列Fig. 2 Full length sequence of scFv against AMOZ derivative
2.2 抗AMOZ衍生物scFv表达、纯化和活性鉴定
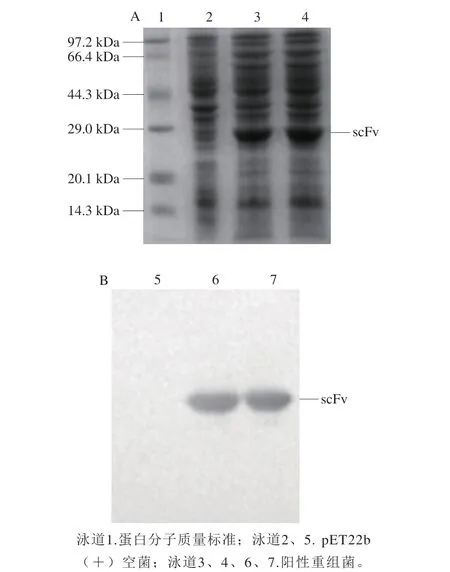
图3 重组scFv蛋 白SDS-PAGE鉴定(A)和Western blotting分析(B)Fig. 3 Identifciation of the recombinant antibody by SDS-PAGE (A) and Western blotting (B)
从抗性平板上挑取抗AMOZ衍生物scFv阳性克隆菌的单菌落进行摇瓶培养,以pET22b(+)载体的空菌作为对照,经0.6 mol/L IPTG 24 ℃诱导表达7 h后收集菌体,进行SDS-PAGE和Western blotting分析,结果见图3。SDS-PAGE结果可知,阳性克隆菌在相对分子质量约为27 kDa时条带明显增粗,Western blotting分析结果可知,该蛋白能够与抗His标签单克隆抗体发生特异性结合,表明表达的蛋白就是目的scFv。本实验发现抗AMOZ衍生物scFv蛋白在pET22b(+)载体中是以包涵体形式表达的,诱导表达结束后采用溶菌酶和超声波结合的方式裂解菌体制备抗AMOZ衍生物scFv包涵体,对包涵体进行洗涤、变性、Ni柱亲和纯化、复性与超滤浓缩处理,制备得到的抗体质量浓度为 1.2 mg/mL,纯度约为97%。从图4可知,该抗体能够特异性识别AMOZA-OVA包被抗原,效价大约1∶640,NPAMOZ药物对抗体有抑制作用,说明得到的重组scFv具有活性,可以用于下一步AMOZ残留icELISA分析方法的建立。

图4 AMOZ衍生物scFv效价测定和抑制作用分析Fig. 4 Titer and inhibition of scFv antibody against AMOZ derivative
2.3 基于scFv的AMOZ残留icELISA检测方法的建立
采用棋盘滴定实验优化AMOZA-OVA包被原包被质量浓度和scFv稀释度,竞争抑制药物NPAMOZ质量浓度为1 μg/mL,结果如表2所示。由表2可知,随着包被质量浓度的降低,B0呈现逐渐降低的趋势,随着抗AMOZ衍生物scFv稀释倍数的增大,B0下降较快。在竞争ELISA法中,B/B0越小,灵敏度越高,但是B0太大或太小也会增加误差,从而降低方法的灵敏度。综合考虑不同条件下的B0和B/B0值,选择的包被抗原质量浓度和scFv稀释倍数分别为0.062 5 μg/mL和20 倍。
在上述优化的实验条件下,建立基于scFv测定NPAMOZ的icELISA分析方法,标准曲线如图5所示,采用OriginPro 8.5软件进行四参数对数拟合计算,得到NPAMOZ icELISA检测方法的半抑制浓度(IC50)为11.35 μg/L(相当于AMOZ 8.65 μg/L),检测限(IC10)为1.94 μg/L(相当于AMOZ 1.48 μg/L), 线性检测范围(IC20~IC80)为3.81~69.93 μg/L(相当于AMOZ 2.90~53.28 μg/L),线性回归方程为 y=-0.574 7x+1.135 6(R2=0.998 3)。

表2 棋盘滴定实验Table 2 Results of chessboard titration

图5 NPAMOZ的icELISA标准曲线(n=3)Fig. 5 Standard curve of icELISA for NPAMOZ (n = 3)
2.4 icELISA方法特异性分析
用交叉反应率评价icELISA方法的特异性,交叉反应率越低,特异性越好。交叉反应率计算公式如下:

选择与NPAMOZ结构相似的其他硝基呋喃类抗生素及其代谢物对本实验建立的icELISA方法进行特异性评价,由表3可知,本研究制备得到的抗AMOZ衍生物scFv特异性很好,除与原药呋喃它酮有交叉反应(交叉反应率为63.98%)外,与其他硝基呋喃类抗生素及其代谢物交叉反应率均小于0.1%。

表3 NPAMOZ及其类似物与scFv的交叉反应Table 3 Cross-reactivity of NPAMOZ and its analogs with scFv antibody

续表3
2.5 AMOZ衍生条件的优化
选择2-NBA、3-NBA和4-NBA 3 种作为衍生剂,由图6A可知,3 种硝基苯甲醛衍生剂的衍生效果相差不大,因为绘制标准曲线时用的竞争药物为2-NPAMOZ,所以选择2-NBA作为后续衍生条件优化的衍生剂;加入2-NBA衍生剂25、50、100、200、250 μL,考察衍生试剂用量对衍生率的影响,由图6B可知,随着2-NBA用量的增加,衍生率逐渐增大,衍生剂用量超过100 μL时,衍生率相对稳定,故衍生剂用量选择100 μL;衍生温度选择30、40、50、60、70 ℃,考察衍生温度对衍生率的影响,由图6C可知,随着衍生温度的升高,衍生率逐渐提高,当衍生温度达到60 ℃时,衍生产物生成量相对稳定,所以选择衍生温度为60 ℃;衍生时间选择1、2、4、6、8 h、过夜(传统衍生过夜,约16 h),考察衍生时间对衍生率的影响,由图6D可知,随着衍生时间的延长,衍生率逐渐变大,衍生时间超过4 h后衍生率相对稳定,从快速检测方法的需求出发,衍生时间选择4 h,和传统的衍生过夜(约16 h)相比,可以大大缩短实验时间,提高工作效率。综上所述,优化的AMOZ衍生条件为衍生剂2-NBA、用量100 μL、衍生温度60 ℃、衍生时间4 h,在此优化条件下测得的衍生率为88%,比优化前有一定的提高(优化前衍生率为79%左右)。

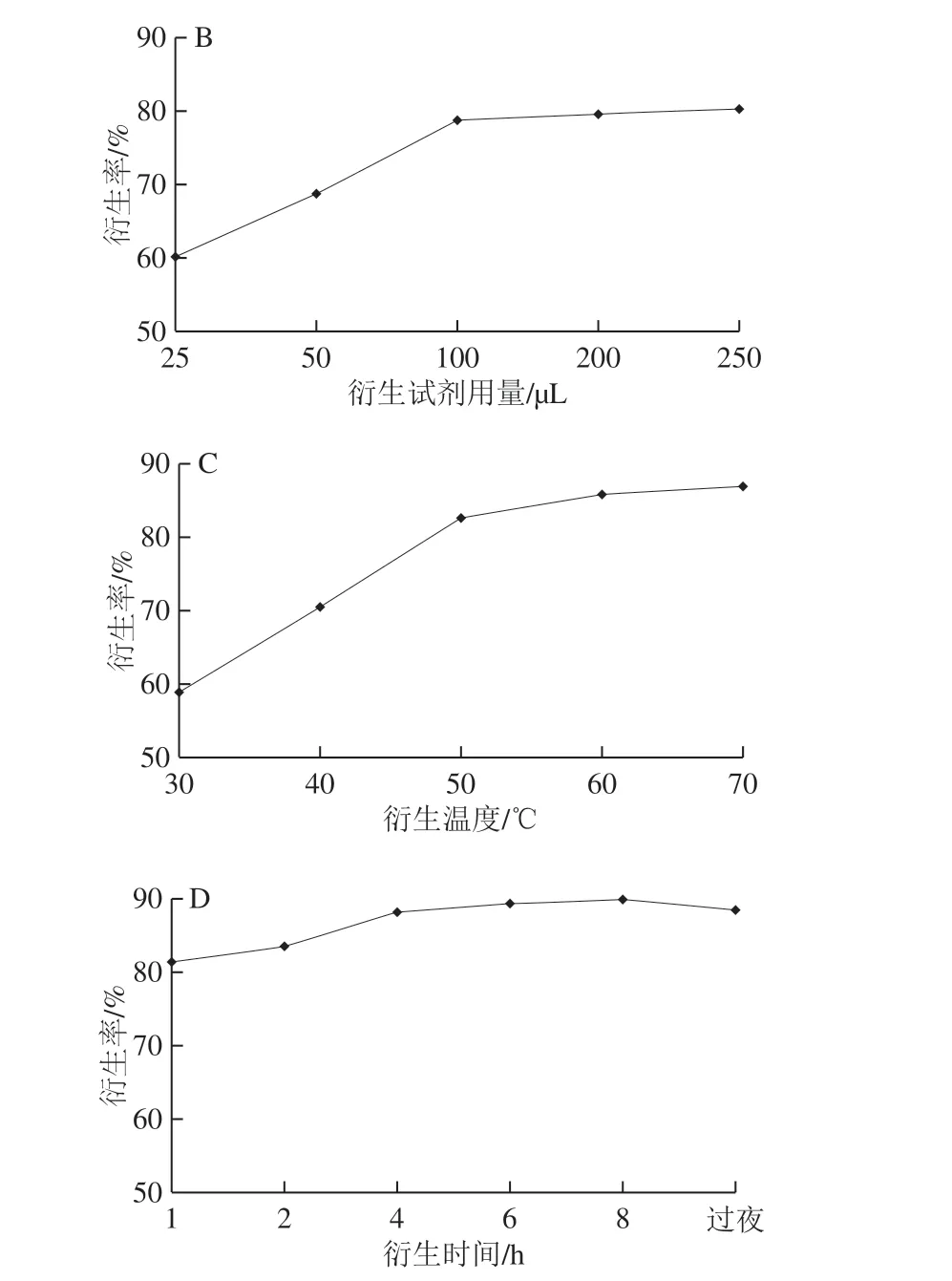
图6 衍生试剂种类(A)、衍生试剂用量(B)、衍生温度(C)和 衍生时间(D)对AMOZ衍生率的影响Fig. 6 Effects of the type of derivative reagent (A), the amount of derivatization reagent (B), temperature (C), and derivatization time (D) on the derivatization efficiency of AMOZ
2.6 添加回收实验
icELISA方法的添加回收实验测定结果采用HPLCMS/MS进行确证,2 种方法的添加回收率对比结果见表4。icELISA方法的平均回收率为74.3%~86.6%,相对标准偏差(relative standard deviation,RSD)为7.0%~12.6%。对2 种方法的检测结果进行相关性分析,发现2 种方法相关性良好(R2=0.999 2),说明本研究建立的icELISA方法能够准确筛选出阳性样品,可用于虾类等水产样品中AMOZ残留的高通量免疫快速检测。
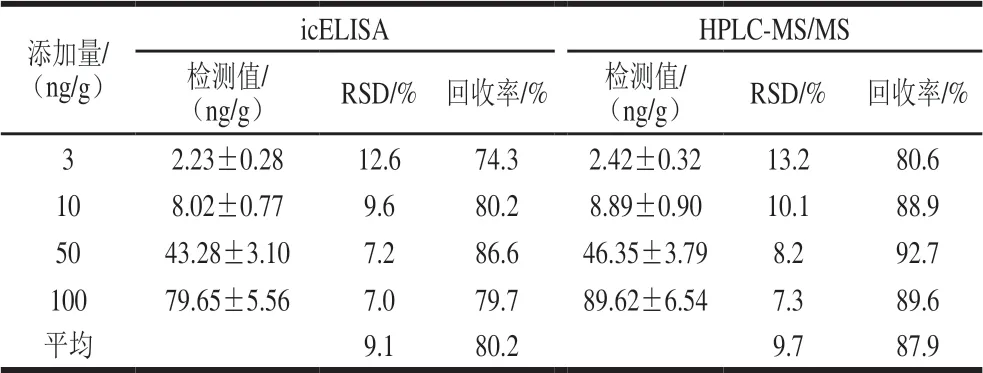
表4 icELISA法和HPLC-MS/MS法阴性虾肉样品添加回收率的 比较(n =3)Table 4 Comparison of recoveries for spiked negative shrimp samples determined by icELISA and HPLC-MS/MS (n= 3)
3 结 论
本研究从分泌产生抗AMOZ衍生物单克隆抗体杂交瘤细胞中成功克隆获得了抗体VH和VL基因,通过(G4S)3连接肽采用重叠延伸PCR技术成功构建scFv基因,以pET-22b(+)为表达载体,大肠杆菌BL21(DE3)为表达系统,经IPTG诱导表达和Ni亲和柱纯化,得到的重组scFv,能够特异性识别AMOZA-OVA包被抗原,NPAMOZ药物对抗体有抑制作用,说明制备得到的重组scFv是特异性的抗AMOZ衍生物scFv。在此基础上采用棋盘滴定实验对AMOZA-OVA包被原包被浓度和scFv稀释度进行优化,建立了基于此scFv的AMOZ残留icELISA方法并进行了评价,发现建立icELISA方法的检测灵敏度、定量线性范围、交叉反应率和添加回收率均达到相关检测限量要求,方法准确可靠,可用于虾类等实际样品中AMOZ残留免疫检测。本研究不仅为AMOZ残留免疫检测提供了一种新的高特异性低成本的基因工程抗体,也为今后利用基因工程抗体开发AMOZ残留免疫检测商品化试剂盒提供参考依据,具有很好的应用前景。
