不同原料茯砖茶活性成分及微生物多样性分析
2020-12-29吕生华邓铜玲
曾 桥,吕生华*,李 祥*,胡 歆,梁 艳,樊 成,段 洁,邓铜玲
(1.陕西科技大学轻工科学与工程学院,陕西 西安 710021;2.陕西科技大学食品与生物工程学院,陕西 西安 710021;
3.陕西科技大学化学与化工学院,陕西 西安 710021;4.咸阳泾渭茯茶有限公司,陕西 咸阳 712044;
5.陕西省产品质量监督检验研究院,陕西 西安 710048)
茯砖茶为黑茶类紧压茶,属于后发酵茶,加工工艺复杂,产品形式独特,具有内质金花普茂,开汤后汤色红浓、菌香浓郁、香气纯正、滋味醇厚的品质[1]。茯砖茶营养成分丰富,含有类黄酮、多糖、多酚、咖啡因、儿茶素、氨基酸、三萜类等多种活性成分,具有抗氧化、减肥、降脂、降压、降血糖等保健功效[2-7],近年来备受消费者的亲睐。研究发现原料是影响茯砖茶品质的主要因素之一,不同原料活性成分的差异对茯砖茶感官品质和功能均有较大影响[8]。“发花”是茯砖茶加工过程中的关键步骤[9],其实质是在一定的温度和湿度环境下,基于开放环境的原料、水和空气的自然接种进行的以冠突散囊菌为主的多菌群协同作用的固态发酵过程[10],通过“发花”不仅形成了茯砖茶特有的黑茶花色,还促进了茯砖茶内部成分的转化,具有比其他黑茶更好的风味和功能特性[11]。“发花”质量与茯砖茶的原料、加工环境和工艺密切相关,这主要由于这些因素调控微生物菌群结构及丰度,影响茯砖茶的微生物多样性,从而影响茯砖茶的品质。
鉴于大多数微生物难以实现纯培养,传统平板分离鉴定微生物的方法具有较大局限性。近年来,高通量测序技术被广泛应用于微生物多样性分析,该技术可检测到样本中传统纯培养不能发现的低丰度微生物菌群,有助于更加全面准确地了解微生物组成[12],在食品领域得到了广泛的应用。已有相关学者采用高通量测序技术分别研究了茯砖茶发花过程中真菌群落多样性的变化[13],以及不同加工地域对茯砖茶微生物多样性的影响[10],使得人们对于茯砖茶中的微生物菌群有更深的了解,但是对以不同原料加工而成的茯砖茶微生物多样性的研究尚鲜见报道。因此,开展对不同原料加工的茯砖茶产品中活性成分及微生物多样性研究,为后续茯砖茶新产品的开发提供理论依据具有一定的指导意义。本研究以分别由滇红、安化黑茶、杜仲叶、蒲公英为原料加工而成的茯砖茶产品为对象,在研究其活性成分的基础上,进一步采用高通量测序技术对产品中的微生物群落结构进行解析,并对不同原料加工的茯砖茶产品活性成分与微生物群落相关性进行分析,以期为不同原料茯砖茶品质形成机制和新产品的开发提供依据。
1 材料与方法
1.1 材料与试剂
茯砖茶:分别以安化黑茶(湖南安化)、滇红(云南凤庆)、蒲公英(山西乡宁)、杜仲叶(陕西略阳)为原料,在同一加工条件下加工制成的茯砖茶。
葡萄糖、芦丁、咖啡因、茶氨酸、没食子酸(gallic acid,GA)、绿原酸标准品 上海源叶生物科技有限公 司; 儿 茶 素( catechin , +C ) 、 表 儿 茶素(epicatechin,E C)、表没食子儿茶素(epigallocatechin,EGC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、表儿茶素没食子酸酯(epicatechin gallate,ECG)标准品 中国药品生物制品检定所;乙腈、乙酸(均为色谱纯) 德国Fisher公司;浓硫酸、浓盐酸、亚硝酸钠、硝酸铝、乙二胺四乙酸二钠、茚三酮(均为分析纯) 国药集团化学试剂有限公司;氢氧化钠、碱式乙酸铅、碳酸钠、福林酚、磷酸氢二钠、磷酸二氢钾(均为分析纯) 天津市科密欧 化学试剂有限公司;苯酚、无水乙醇、甲醇(均为分 析纯) 天津市天力化学试剂有限公司。
DNA提取试剂盒 美国MP Biomedicals公司; 琼脂糖 西班牙Biowest公司;FastPfu Polymerase 中国TransGen公司;AxyPrep DNA Gel Extraction Kit 美国Axygen公司;建库试剂盒 美国Bioo Scientific 公司;测序试剂盒 美国Illumina公司。
1.2 仪器与设备
U3000高效液相色谱仪(配有可变波长紫外检测器和Chromeleon 7.10色谱工作站) 美国赛默飞世尔公司;TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;FA1004N电子分析天平 上海精密科学仪器有限公司;EX125DZH电子天平 奥豪斯仪器(常州)有限公司;GZX-9246MBE电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;KH5200DE型医用数控超声波 清洗器 昆山禾创超声仪器有限公司;HH-2电热恒温水浴锅 北京科伟永兴仪器有限公司;TD5A大容量低速离心机 长沙英泰仪器有限公司;DZ-2BC型真空干燥箱 天津市泰斯特仪器有限公司;ELx800 酶标仪 美国BioTek公司;Quantus™ Fluorometer微型荧光计 美国Promega公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;Illumina Miseq测序仪 美国Illumina公司。
1.3 方法
1.3.1 活性成分检测
水浸出物参考GB/T 8305—2013《茶 水浸出物测定》检测;总黄酮参照《中国药典:一部》山楂叶提取物部分方法检测[14];多糖按文献[15]方法检测;咖啡碱参考 GB/T 8312—2013《茶 咖啡碱测定》的规定检测;多酚、儿茶素类参考GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》检测;氨基酸参考GB/T 8314—2013《茶 游离氨基酸总量的测定》检测;绿原酸按文献[16]方法检测。
1.3.2 DNA提取和PCR扩增
样品D N A 采用FastDNA®Spin Kit for Soil试剂盒按操作流程进行提取, 使用338F (ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对16S rRNA基因V3-V4 可变区进行P C R 扩增,使用ITS1F(CTTGGTCATTTAGAGGAAGTAA)/I T S 2 R(GCTGCGTTCTTCATCGATGC)对ITS rDNA基因的ITS1-ITS2区进行PCR扩增,扩增程序如下:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,27 个循环;72 ℃稳定延伸10 min,最后在4 ℃进行保存。
1.3.3 16S rDNA和ITS序列高通量测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus™ Fluorometer微型荧光计对回收产物进行检测定量,使用NEXTFLEX®Rapid DNA-Seq Kit进行建库,在上海美吉生物医药科技有限公司基于Illumina平台进行高通量测序分析。
1.4 数据分析
2 结果与分析
2.1 不同原料茯砖茶活性成分分析
按照1.3.1节方法对分别以安化黑茶、滇红、蒲公英和杜仲叶为原料加工制作而成的茯砖茶产品中水浸出物、多糖、总黄酮、绿原酸、咖啡因、氨基酸等13 种活性成分进行测定,各不同原料加工所得茯砖茶产品中活性成分含量见表1。
由表1可知,不同原料加工的茯砖茶活性成分差异较大,以安化黑茶为原料加工的茯砖茶中总黄酮、氨基酸、多酚、GA以及儿茶素类成分均较其他茯砖茶含量高。滇红茯砖茶所含咖啡因含量最高,和其他类茯砖茶相比,氨基酸和多酚含量也较高。蒲公英茯砖茶水浸出物含量最高,儿茶素类成分相较滇红和杜仲叶茯砖茶高。杜仲叶茯砖茶中多糖和绿原酸含量较其他茯砖茶高,其中多糖含量较其他类型茯砖茶均高97%以上。绿原酸在蒲公英茯砖茶有少量的检出,在安化黑茶和滇红茯砖茶中均未检测到。此外,蒲公英茯砖茶中未检测到+C,杜仲叶茯砖茶中GA和儿茶素类活性成分含量较低,其中儿茶素类活性成分中EGC、EGCG和ECG未检出。

表1 不同原料茯砖茶活性成分Table 1 Bioactive components of Fuzhuan tea samples produced from different raw materials
对各活性成分分析可以发现:各不同原料加工的茯砖茶中以安化黑茶和杜仲叶为原料加工的茯砖茶水浸出物含量相当,二者与滇红和蒲公英为原料加工的茯砖茶中水浸出物差异极显著(P<0.01);4 种茯砖茶多糖、总黄酮和多酚含量相互差异均极显著(P<0.01);蒲公英茯砖茶和杜仲叶茯砖茶中绿原酸含量差异也达到极显著水平(P<0.01);以安化黑茶和滇红为原料加工的茯砖茶咖啡因含量差异较显著(P<0.05),二者与蒲公英和杜仲叶含量差异均达到极显著水平(P<0.01),且蒲公英与杜仲叶茯砖茶咖啡因含量差异极显著 (P<0.01);以滇红和安化黑茶为原料加工的茯砖茶中氨基酸含量相当,差异不显著(P>0.05),二者与蒲公英和杜仲叶茯砖茶差异极显著(P<0.01);以安化黑茶、滇红和蒲公英为原料加工的茯砖茶相互间EGC、EGCG、ECG含量差异均极显著(P<0.01);滇红和蒲公英茯砖茶EC含量差异不显著(P>0.05),但二者与安化黑茶和杜仲叶为原料加工的茯砖茶含量差异达到极显著水平(P<0.01);杜仲叶和滇红加工的茯砖茶中+C含量差异较显著(P<0.05),二者与安化黑茶相比差异极显著(P<0.01);以滇红和蒲公英为原料加工的茯砖茶中GA含量差异显著 (P<0.05),二者与安化黑茶和杜仲叶为原料加工的茯砖茶含量差异极显著(P<0.01)。上述结果表明,所采集的4 种茯砖茶样品活性成分差异较大,具有一定的代表性。
2.2 不同原料茯砖茶真菌群落结构
2.2.1 不同原料茯砖茶真菌群落α多样性
由表2可以看出,所有测试的样本测序深度均在0.999 8以上,说明样本中未被测出的序列概率极低,测序结果能代表各不同原料加工的茯砖茶样本中真菌群落的真实情况[20]。α多样性指数结果表明,各样本Shannon指数均极低,而Simpson指数接近于1,说明所有茶样真菌群落多样性较低。由ACE指数和Chao指数可以看出,所有茶样真菌群落丰富度也较低。

表2 不同原料茯砖茶真菌群落多样性指数Table 2 Fungal community richness and diversity indexes of Fuzhuan tea samples produced from different raw materials
2.2.2 不同原料茯砖茶真菌群落结构分析

图1 基于门(A)和属(B)水平不同原料茯砖茶真菌群落结构Fig. 1 Fungal community structure in Fuzhuan tea produced from different raw materials at phylum (A) and genus (B) levels
图1 为基于门和属分类水平的样本与物种共现性关系图,反映了各不同原料茯砖茶中真菌群落结构,可以发现,在门分类水平上,子囊菌门(Ascomycota)占所有样本99.99%以上,占绝对优势,仅有少数未知分类地位的unclassified_k__Fungi及其他的真菌。从属分类水平上可以看出,注释到明确分类地位的有曲霉属(Aspergillus)和篮状菌属(Talaromyces),其他属丰度较低而统一归为一类(others),其中Aspergillus在所有样本中的相对丰度均在99.99%以上,为绝对优势菌群。真菌群落α多样性及结构分析表明,不同原料加工的茯砖茶产品真菌群落多样性无明显差异,可以推断,影响茯砖茶产品真菌群落多样性的因素可能为加工工艺和环境。
2.3 不同原料茯砖茶细菌群落结构
2.3.1 不同原料茯砖茶细菌群落α多样性

表3 不同原料茯砖茶细菌群落多样性指数Table 3 Bacterial community richness and diversity indexes of Fuzhuan tea produced from different raw materials
由表3可以看出,所有样本测序深度均在0.998 6以上,能够较好地代表不同原料加工的茯砖茶样本中细菌群落的真实情况。一般情况下,Shannon指数越高,Simpson指数越低,说明样本中细菌群落多样性指数 越高[21],从表3可以看出,以滇红为原料加工的茯砖茶产品细菌群落多样性高,杜仲叶、蒲公英茯砖茶次之,以安化黑茶为原料加工的茯砖茶细菌群落多样性最低。Chao指数和ACE指数反映了样本细菌群落的丰富度,杜仲叶茯砖茶细菌群落丰富度最高,其次为以滇红为原料加工的茯砖茶产品,而以安化黑茶为原料加工的茯砖茶产品细菌群落丰富度最低,说明不同原料加工的茯砖茶产品细菌的丰度和多样性存在较大的差异。
2.3.2 OTU聚类分析

图2 不同原料茯砖茶细菌群落OTU的Venn图Fig. 2 Venn analysis of OTUs in Fuzhuan tea samples produced from different raw materials
对97%相似水平下的OTU进行生物信息统计分析,并进一步绘制Venn图,从而可以直观反映样本在不同分类水平上的组成相似性和重叠情况。从图2可以看出,所有样本可划分为906 个OTU,以安化黑茶、蒲公英、杜仲叶、滇红4 种原料加工的茯砖茶样品OTU分别为211、175、571、366 个。其中,以安化黑茶为原料加工的茯砖茶和蒲公英茯砖茶共有的OTU为71 个,与杜仲叶茯砖茶共有的OTU为121 个,与以滇红为原料加工的茯砖茶共有的OTU为93 个。蒲公英茯砖茶与杜仲叶茯砖茶共有的OTU为108 个,与以滇红为原料加工的茯砖茶共有的OTU为84 个,而杜仲叶茯砖茶与以滇红为原料加工的茯砖茶共有的OTU为163 个。安化黑茶、蒲公英、杜仲叶、滇红4 种原料分别加工的茯砖茶样品各自独有的OTU分别为74、54、345、185 个,分别占各自总数的35.1%、30.9%、60.4%和50.5%,而4 种茯砖茶共有的OTU数量为54 个,占所有样本OTU总数的6.0%,说明不同原料加工的茯砖茶细菌群落结构发生了明显的变化。
2.3.3 不同原料茯砖茶细菌群落结构分析

图3 基于门(A)和属(B)水平不同原料茯砖茶细菌群落结构Fig. 3 Bacterial community structure in Fu brick tea samples produced from different raw materials at phylum (A) and genus (B) levels
由图3A可知,在门分类水平上,不同原料加工的茯砖茶共注释到明确分类地位的有9 个门,分别是变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、栖热菌门(Deinococcus-Thermus)和蓝藻门(Cyanobacteria),其中Proteobacteria在4 种不同原料茯砖茶产品种均为优势菌。不同茯砖茶产品中微生物在门水平上组成有较大差异,以安化黑茶为原料加工的茯砖茶中Proteobacteria(94.96%)占绝对优势,其次为Firmicutes(3.52%)和Actinobacteria(0.84%);而杜仲叶茯砖茶中相对丰度由高到低依次为Proteobacteria(78.70%)、Firmicutes(12.08%)、Actinobacteria(2.92%)、Bacteroidetes(1.74%)、Chloroflexi(1.28%)等;以滇红为原料加工的茯砖茶门水平上的细菌群落分布与杜仲叶茯砖茶较相似,但各菌群相对丰度不同,其中Proteobacteria(61.19%)相对丰度最高,其次为Actinobacteria(18.32%)、Bacteroidetes(8.99%)、Firmicutes(6.20%);蒲公英茯砖茶中Proteobacteria(71.35%)相对丰度最高,其次为Bacteroidetes(15.93%)、Actinobacteria(6.15%)、Firmicutes(3.71%)等。
由图3B可知,在属水平上注释到明确分类地位的有30 个属,其他相对丰度较低的合并为一类(others),其中相对丰度较高的为假单胞菌属(Pseudomonas)、属级分类地位未知的肠杆菌(unclassified_f__Enterobacteriaceae)、Burkholderia-Caballeronia-Paraburkholderia、雷尔氏菌属(Ralstonia)、不动杆菌属(Acinetobacter)、CL500-29_marine_group、黄杆菌属(Flavobacterium)、嗜冷杆菌属(Psychrobacter)等。以安化黑茶为原料加工的茯砖茶中,优势菌群为unclassified_f__Enterobacteriaceae(42.38%)、Pseudomonas(39.97%),其次相对丰度较高的为Burkholderia-Caballeronia-Paraburkholderia(9.49%)、Psychrobacter(1.14%)、漫游球菌属(Vagococcus,0.89%)、乳杆菌属(Lactobacillus,0.88%)和肉杆菌属(Carnobacterium,0.72%),其他类细菌属相对丰度均低于0.3%。杜仲叶茯砖茶中相对丰度较高的为Pseudomonas(22.34%)、Burkholderia-Caballeronia-Paraburkholderia(21.04%),其次为Acinetobacter(11.71%)、Ralstonia(6.90%)、Vagococcus(3.65%)、Psychrobacter(3.64%)、Carnobacterium(2.48%)、栖水菌属(Enhydrobacter,2.32%)、弧菌属(Vibrio,1.92%)、短波单胞菌属(Brevundimonas,1.19%)等。以滇红为原料加工的茯砖茶中相对丰度最高的为Burkholderia-Caballeronia-Paraburkholderia(18.06%),其次为Ralstonia(12.73%)、Pseudomonas(11.98%)、CL500-29_marine_group(11.92%)、Flavobacterium(7.28%)、unclassified_f__Enterobacteriaceae(3.97%)、hgcl_clade(2.02%)、Carnobacterium(1.92%)、Psychrobacter(1.87%)、Stenotrophomonas(1.54%)、分支杆菌属(Mycobacterium,1.54%)等。蒲公英茯砖茶中相对丰度较高的细菌属包括Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium(17.85%)、金黄杆菌属(Chryseobacterium,14.75%)和甲基杆菌属(Methylobacterium,12.34%),其次为Pseudomonas(8.56%)、norank_f__Mitochondria(8.06%)和Burkholderia-Caballeronia-Paraburkholderia(6.05%)、微杆菌属(Microbacterium,4.23%)、Ralstonia(4.11%)、Acidovorax(4.04%)等。通过比较可以发现,Pseudomonas和Burkholderia-Caballeronia-Paraburkholderia在4 种茯砖茶种均有较高的丰度,而其他类细菌属在各不同原料加工的茯砖茶中丰度随原料的不同而存在明显的差异。
2.3.4 不同原料加工茯砖茶微生物群落主成分分析
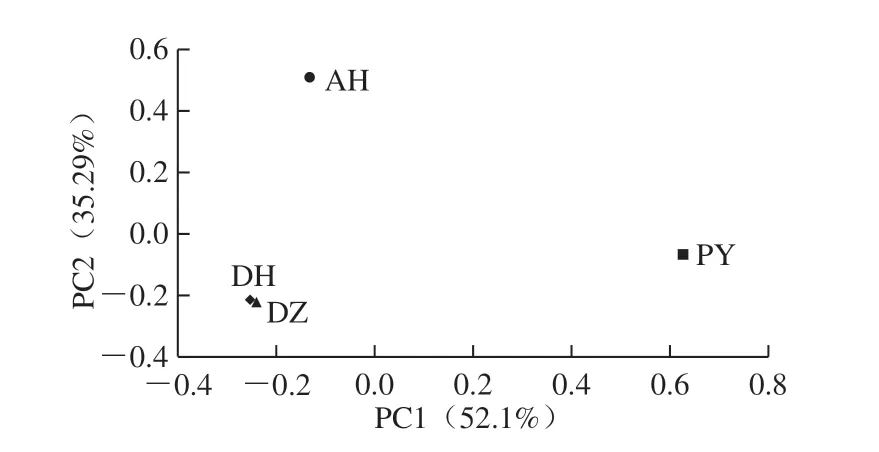
图4 不同原料加工茯砖茶的主成分分析Fig. 4 PCA of Fuzhuan tea produced from different raw materials
如图4所示,PC1和PC2主要贡献之和为87.3%,说明该主成分分析图可以较好地反映各不同原料加工茯砖茶样之间细菌群落结构差异的影响因素。其中分别以滇红和杜仲叶为原料加工的茯砖茶距离较近,而以安化黑茶和蒲公英为原料加工的茯砖茶距离较远,表明以滇红和杜仲叶为原料加工的茯砖茶细菌群落结构更相似,而与安化黑茶和蒲公英为原料加工的茯砖茶细菌群落结构差异较大,说明原料种类对茯砖茶产品细菌群落结构有一定的影响。
2.4 不同原料茯砖茶细菌群落组成与活性成分相关性分析
表4为茯砖茶活性成分与属水平上相对丰度较高细菌群落之间相关性分析,可以看出,Pseudomonas、Lactobacillus与类黄酮显著正相关(P<0.05),unclassified_f__Enterobacteriaceae与多酚、+C、EC、EGC和GA显著正相关(P<0.05),Burkholderia-Caballeronia-Paraburkholderia与EGCG呈显著负相关(P<0.05),Acinetobacter与多糖呈显著正相关 (P<0.05),与绿原酸呈极显著正相关(P<0.01),而与氨基酸呈显著负相关(P<0.05),Psychrobacter与绿原酸呈显著正相关(P<0.05),与ECG呈显著负相关(P<0.05),Carnobacterium与EC、EGC、ECG均呈显著负相关(P<0.05),Enhydrobacter与绿原酸呈显著正相关(P<0.05),Vibrio与多糖呈显著正相关(P<0.05),与绿原酸呈极显著正相关(P<0.01),而与氨基酸呈显著负相关(P<0.05),短波单胞菌属(Brevundimonas)与多糖呈显著正相关(P<0.05),与绿原酸呈极显著正相关(P<0.01),而与氨基酸呈显著负相关(P<0.05)。
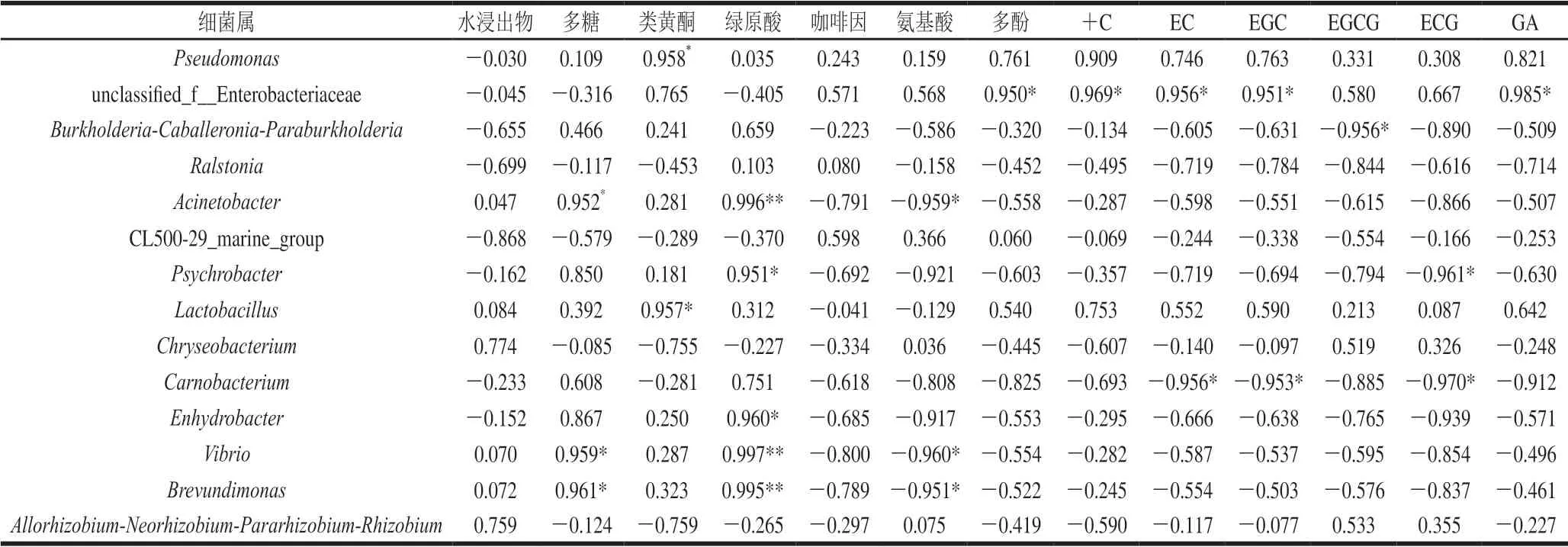
表4 不同原料茯砖茶活性成分与主要细菌属相关性分析Table 4 Pearson’s correlation coefficients between the relative abundances of important genera and bioactive components of Fuzhuan tea samples produced from different raw materials
3 讨 论
不同原料茯砖茶真菌群落多样性分析结果表明,Aspergillus为所有采集茯砖茶样品中绝对优势菌群,在所有不同原料茯砖茶中的相对丰度均大于99.99%,这与Li Qin等[5]的研究结果相似,将茯砖茶的加工过程分为S1~S10共10 个阶段,并对每个阶段真菌多样性进行研究,结果表明,Aspergillus在茯砖茶发酵的各个阶段,其相对丰度呈先下降后上升的趋势,且在S5阶段时,Aspergillus就已经成为绝对优势菌群,其相对丰度达到98%,最终在成品中的相对丰度达到99.95%。 赵仁亮等[10]研究了不同地域茯砖茶产品中的真菌群落多样性,结果表明,不同地域茯砖茶产品中真菌群落存在一定差异,同时,所选取的4 个地域的茯砖茶产品中Aspergillus相对丰度均在92%以上,除Aspergillus外,还包括属级分类地位未知的Trichocomaceae-unclassified、Eurotiomycetes-unclassified、Eurotiales-unclassified、Ascomycota-unclassified、Candida、Wallernia等,真菌中Aspergillus相对丰度低于本研究所采集的样本。对上述结果共同分析可以发现,茯砖茶中真菌群落结构的差异主要和加工工艺以及加工环境有关,原料对于茯砖茶产品中真菌群落多样性影响不大。冠突散嚢菌属于散囊菌目发菌科Aspergillus属,是茯砖茶中的优势菌,其数量是评价茯砖茶品质的重要指标之一[22-23],GB/T 9833.3—2013《紧压茶 第3部分:茯砖茶》规定冠突散囊菌数量应大于20×104CFU/g,本研究所采集的样本Aspergillus相对丰度高,一定程度上反映了本产品质量较好,说明高通量测序技术应用于茯砖茶质量评价具有较好的可行性和实际意义。目前,由于二代测序读长较短[24],因此一般注释到属水平相对准确,而在种水平上的分类学信息置信度较低,后续研究中可考虑结合第三代测序技术[25]对茯砖茶中真菌群落结构进行分析,从而在种水平上反映茯砖茶中真菌群落组成,有助于更加科学地对茯砖茶质量进行评价。
冠突散囊菌是茯砖茶中的优势菌,近年来,对于茯砖茶中微生物群落组成的研究主要集中于以冠突散囊菌等为主的真菌,而对于茯砖茶中细菌群落组成的研究较少。研究表明,细菌是茯砖茶中重要的菌群,刘石泉等[26]采用变性梯度凝胶电泳法对茯砖茶发花过程中细菌群落变化进行了研究,结果表明,茯砖茶中细菌种类较为丰富,在发花早期,由于冠突撒囊菌的生长,细菌的生长受到一定抑制,而在发花后期细菌总数量呈上升趋势,与冠突散囊菌保持共生关系。赵仁亮等[9]对不同地域茯砖茶产品中的细菌群落多样性,结果发现不同地域茯砖茶细菌群落多样性存在一定的差异。本实验通过对不同原料加工的茯砖茶中细菌群落多样性的研究结果表明,在门分类水平上,4 种茯砖茶检测到3 个丰度较高的相同的门,分别是Proteobacteria、Firmicutes和Actinobacteria,而分别以滇红、杜仲叶和蒲公英为原料加工的3 种茯砖茶还检测到相同的Bacteroidetes,但各不同门水平的细菌丰度有较大差异,Proteobacteria在以安化黑茶为原料加工的茯砖茶中丰度为94.96%,为所有样本中最高;Firmicutes在杜仲叶茯砖茶中相对丰度最高,达12.08%;Actinobacteria在以滇红为原料加工的茯砖茶中相对丰度最高,达18.32%;而Bacteroidetes在蒲公英茯砖茶中相对丰度为最高,达15.93%。在属水平上,4 种茯砖茶中检测到2 个相对丰度较高的相同的属,分别是Pseudomonas和Burkholderia-Caballeronia-Paraburkholderia,其中Pseudomonas在以安化黑茶为原料加工的茯砖茶中相对丰度最高,达39.97%,Burkholderia-Caballeronia-Paraburkholderia在杜仲叶茯砖茶中相对丰度最高,为21.04%。以安化黑茶、杜仲叶和滇红为原料加工的3 种茯砖茶中检测到2 个共同的属,分别是Psychrobacter和Carnobacterium,二者均在杜仲叶茯砖茶中相对丰度最高,分别为3.64%和2.48%。Ralstonia在以杜仲叶、滇红和蒲公英为原料加工的茯砖茶中均被检测到,且在滇红为原料加工的茯砖茶中相对丰度最高,为12.73%。茯砖茶中含有的Pseudomonas、Vibrio、Brevundimonas等通常被认为属于条件致病菌,刘石泉[26]、赵仁亮[9]等也在茯砖茶中发现了类似菌,此外,姚静等[27]在普洱茶中分离出了Pseudomonas,上述致病菌中Pseudomonas在各种不同原料茯砖茶中均有较高丰度,这些细菌在茯砖茶中的作用和安全性还有待进一步研究。
综上所述,不同原料茯砖茶中真菌群落结构差异不大,而细菌群落结构差异明显,茯砖茶中部分活性成分如多糖、黄酮、绿原酸等和一些细菌属丰度的相关性达到显著或极显著水平。有研究表明,茯砖茶原料活性成分和微生物代谢过程有较密切的关系,发花过程中多糖[15]、 总黄酮[28]、绿原酸[16]、氨基酸[29]、EGC、EGCG、多酚等活性成分存在一定程度的下降,这是由于微生物代谢的结果,普洱茶中也存在类似的现象,微生物代谢所分泌的纤维素酶、半纤维素酶、蛋白酶等对主要代谢产物具有催化作用[5,30],因此,在后续研究中有必要进一步对各种不同原料茯砖茶发花过程中活性成分和微生物多样性进行研究,明确不同原料茯砖茶发花过程中微生物代谢机制,从而为采用不同原料在加工茯砖茶时针对原料特点更好的进行人工调控提供依据,最终达到提高茯砖茶品质的目的。
