肿瘤组织病理图像定量分析在腹膜假黏液瘤中的研究进展
2020-12-29马茹闫风彩李鑫宝林育林李雁
马茹,闫风彩,李鑫宝,林育林,李雁,
(首都医科大学附属北京世纪坛医院 a.腹膜肿瘤外科,b.病理科,北京 100038)
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一种以黏液性肿瘤细胞产生的黏液在腹腔内积聚、再分布为特征的恶性临床综合征,典型临床表现为黏液性腹水、腹膜种植、网膜饼和卵巢受累。PMP主要源自阑尾黏液性肿瘤,其机制为肿瘤阻塞阑尾腔、黏液持续聚集导致阑尾破裂穿孔,含有瘤细胞的黏液释放入腹腔,沿两侧结肠旁沟再播散至全腹腔;也有少部分是来源于卵巢、胃、结肠等腹腔内器官的原发性黏液性肿瘤[1]。PMP的整体发病率为(2~4)/100万,男女比例为1∶1.2~3.4,年龄为43~63岁,肿瘤细胞减灭术+腹腔热灌注化疗是目前的标准治疗方案,可显著延长患者生存期[2-3]。作为一种罕见的临床肿瘤综合征,PMP早期诊断困难,且认识参差不齐,极易引起漏诊、误诊,进而延误最佳治疗时机。提高PMP诊断的准确性有助于更好地评估疾病进展及预后情况,从而为患者提供更合理的治疗方案。
PMP的病理组织学分型和分级对疾病评估至关重要。目前国际公认的PMP组织病理学分类主要依据肿瘤细胞的数量及癌巢形态、细胞异型性、核分裂象及侵犯周围形式等方面[4],目前处于基于经验的定性阶段,肿瘤病理诊断的准确性高度依赖于病理特征、病理医师经验水平以及视觉搜索过程的交互作用,易受阅片者主观情绪和疲劳阅片等因素影响。随着数字病理的兴起,肿瘤病理学逐渐由人工定性诊断向计算机辅助的定量诊断发展,极大地降低了医师阅片负担及误诊率,目前已应用于乳腺癌、结直肠癌等肿瘤的诊断[5]。建立客观准确的病理图像定量分析系统能有效提高病理学诊断预测PMP预后的价值。现就肿瘤组织病理图像定量分析在PMP中的研究进展进行综述。
1 肿瘤组织病理图像定量分析
1.1病理图像定量分析的发展历程 1959年,Ledley和Lusted[6]首次将数学模型引入医学,并于1966年提出计算机辅助诊断(computer-aided diagnosis,CAD)[7],形成计量医学,但随后的十余年因技术瓶颈,CAD陷入低谷。19世纪80年代起计算机迅速发展,CAD才开始被认真且系统研究,并于1998年正式用于临床[8-9]。同时期各种浅层机器学习模型被相继提出,但由于理论分析及训练方法经验不足,多层神经网络研究相对稀少。2006年Hinton和Salakhutdinov[10]提出深度网络和深度学习的概念,开启了深度学习的研究热潮。20世纪90年代起,数字病理学成像技术见证了全切片扫描图像技术(whole slide imaging,WSI)的诞生和发展,实现全切片扫描及全景信息获取、全维度病理信息挖掘等,推动了CAD的图像分析在组织病理领域的应用[11](图1)。
1.2CAD的工作流程 数字病理学中的CAD开辟了图像计算的新领域,将传统手工特征与深度学习方法结合,可准确、定量地描述组织细胞形态结构变化以及肉眼不可见的亚视觉特征,以期揭示病理现象与疾病本质的关系,提高病理分型、诊断及预后评估的准确性。CAD的工作流程:①经图像采集将显微镜下组织切片的图像通过数码相机或WSI转化为能被计算机直接处理的数字图像;②模拟病理医师长期阅片等经验学习过程处理并分析图像,包括图像预处理、图像分割、目标参数选择及测量;③根据临床病理数据选择有临床意义的特征,并整合构建不同预后模型(图2)。

HE:苏木精-伊红染色;CAD:计算机辅助诊断;WSI:全切片扫描图像技术;DICOM:医学数字成像和通信;FDA:食品药品管理局图1 病理图像定量分析的发展历程
1.2.1图像采集 图像采集是病理图像分析的前提。传统采集系统是通过安装在显微镜上的数码相机捕捉感兴趣视野。近年来兴起的WSI可扫描整张病理切片,实现高质量图像的永久存档、浏览及注释,且不受时空限制[12],因此可最大化地从中提取病理信息,做出客观有效的决策。研究表明,使用WSI和常规显微镜进行病变诊断的准确度和精密度相似[13]。WSI不仅可用于一般组织细胞病理学及免疫组织化学诊断,还在远程病理会诊、教育及科学研究等方面有重要意义[14]。
1.2.2图像预处理 图像质量变化对后续的图像分割和目的参数提取均有重要影响,处理不当可导致病理图像定量分析准确性下降。这些变化由多种因素造成,包括疾病异质性或切片制备、图像采集过程条件不一致等,如染色试剂的批次或制造商不同、组织切片厚度不等、染色方案不同及扫描条件差异等。适当的预处理可在一定程度上减少误差,如祛除大的杂质斑点、敲除卷折或破损切片、图像去噪、颜色归一化处理消除染色不均、伪彩处理、增强图像对比度等[15-16]。
1.2.3图像分割 图像分割的质量是决定测量精度的关键因素之一。图像分割是基于区域或边界的分割方法,或两者结合,实现对组织病理图像中感兴趣区域的分割和提取,如对肿瘤组织病理图像的细胞分割(如细胞核分割)、组织分割(腺体分割)等。
1.2.3.1分割算法 基于相邻像素的特性可将分割算法分成基于边界的算法(利用区域间特性的不连续性)和基于区域的算法(利用区域内特性的相似性),较为常见的分割算法有阈值分割法、模糊聚类法、区域生长和深度学习等分割算法[17]。
阈值分割法以图像像素的某一阈值(如灰度值)为分界值,划分目标区域和背景区域,适用于像素对比度较大的图像[18];聚类分割法基于图像像素的不同特征,按一定规则进行区域划分,适用于形状模糊的图像,常与其他分割方法联合使用[19];区域生长法是将具有相似特征的图像像素或子区域聚合形成区域块实现图像分割;深度学习是一种特殊的人工神经网络,利用多层神经网络完成足够数量的数据训练,进而识别图像表征,实现图像分割。与其他分割算法不同,人工神经网络主要利用区域结构信息,而不依赖于染色强度或手工特征,因此具有较强的鲁棒性[20],越来越多地应用于医学图像处理。

a1-a2:肿瘤组织制备成病理切片;b1-b2:病理图像采集;c1:PMP病理图像中腺体分割;c2:PMP病理图像中肿瘤癌巢与间质分割;c3:乳腺癌病理图像中肿瘤细胞核分割,CAD:计算机辅助诊断图2 CAD的工作流程
1.2.3.2图像分割应用 腺体分割——腺体形状对腺癌的诊断具有重要意义。腺体结构形状与肿瘤分级有很强的相关性,可用于识别正常组织与不同恶性程度的肿瘤。Nguyen等[21]根据腺体形状和大小制订了一种与肿瘤恶性程度相关的癌症指数,用于区分正常组织与前列腺癌组织。Sirinukunwattana等[22]提出了一种新的组织学图像腺结构随机模型,这种随机多边形模型可用于检测和提取正常结肠组织图像中的腺状结构。Cruz-Roa等[23]提出的卷积神经网络(convolutional neural networks,CNN)可用于乳腺癌WSI中浸润性导管癌的分类,其结果优于基于手工特征的图像分割。
癌巢分割——肿瘤微环境通过肿瘤细胞与基质成分协同作用影响肿瘤细胞的增生、侵袭及转移。肿瘤细胞和肿瘤微环境特征在肿瘤病理图像定量分析中有重要作用。阚贤响等[24]基于像素级别分类方法引入间隔采样和阈值法,该分割模型实现苏木精-伊红染色(hematoxylin-eosin staining,HE染色)的乳腺癌组织病理图像中癌巢与间质的分割。Linder等[25]采用一种基于纹理的局部二值模式算法,从组织芯片图像中成功分割上皮和间质成分。Beck等[26]开发的计算机辅助机器学习系统能实现肿瘤实质与间质组织区域的分割,通过测定乳腺癌肿瘤上皮和基质中的图像特征发现,肿瘤基质形态结构是乳腺癌的独立预后因素。Xu等[27]利用CNN的特征学习方法,实现乳腺癌和结直肠癌病理图像中上皮与间质细胞的自动分割。
细胞核分割——肿瘤细胞核的定位是定量研究肿瘤病理学的一个重要方向,分析细胞核的大小、形状、轮廓及有丝分裂象等形态特征对肿瘤的早期检测和预防有重要作用。Fatakdawala等[28]依据良恶性细胞核形态及间质染色特点,应用活动轮廓模型从HE染色的组织病理图像中分割出单个细胞核。Abdolhoseini等[29]提出了一种基于多级阈值分割技术和分水岭算法联合的细胞核分割方法,适用于不同染色方法获得的组织病理图像。Song等[30]基于多尺度CNN和图像分割法精确分割细胞质和细胞核,将细胞核从图像中提取出来。局部敏感的CNN可自动检测和分类HE染色的癌组织细胞核,在结直肠癌图像数据集评估中显示该算法效果良好[31]。有丝分裂象是细胞核的特殊形式,检测有丝分裂有助于评估肿瘤的增殖活性。Wang等[32]将手工特征(形态、颜色、纹理特征)与CNN相结合检测有丝分裂象,与单纯深度学习或基于手工特征的算法相比,这种集成方法的检测精度更高。
其他应用——图像分割还可用于肿瘤生物学标志物的定量分析:Niazi等[33]提出了一种深度学习方法,可用来区分Ki-67染色的肿瘤和非肿瘤区域,有望解决免疫组织化学染色中的假阳性问题。
1.2.4目标参数选择及测量 图像分割后,需要先去除错误检测区域、填充微小孔洞等后才能用于测量[34]。病理学家通常采用低、中、高分辨率读取病理图像中不同的形态结构特征,最大程度地描述组织形态,包括像素级、对象级以及语义级三个层次的特征。像素级特征描述图像的颜色和纹理特征,颜色特征量化颜色扩散、突出和共现,纹理特征量化图像的清晰度、对比度、强度变化等。对象级特征描述细胞结构的属性,如细胞核、细胞质和腺体等的形状、纹理和空间分布[35]。语义级特征是基于低层次特征获得的描述细胞间生物学领域的信息,如一定区域内的对象密度、不同对象数量比和空间结构等[36]。
图像测量涉及大量参数,主要包括三类:①几何参数,描述组织、细胞结构的形状及大小,如周长、面积、圆形度、密度参数、分布参数等;②光密度参数,描述图像信号强弱变化以反映细胞中某物质的显色强度,如平均光密度、积分光密度等;③特化参数,描述某一结构量化特征的专用参数,如细胞增生指数、核质比等[17,36]。
1.2.5定量特征建模 上述病理图像中提取的特征参数不仅可以准确、定量描述肿瘤组织和细胞的形态结构变化,提高传统病理诊断的客观性和工作效率,而且可从病理图像的大量特征中挖掘潜在信息,发现新的诊断指标。将这些人眼不易识别或总结的指标,通过计算机技术分析与肿瘤病情发展、预后之间的关系,一定程度上可作为诊断和判断预后的依据。Chen等[37]采用CAD图像分析乳腺浸润性导管癌患者的HE染色图像,提取出730个形态学参数,Kaplan-Meier生存分析显示12个参数与无病生存期显著相关,Cox比例风险回归模型显示癌巢特征、癌巢细胞核特征、间质细胞结构特征以及癌巢细胞密度是影响预后的独立因素,并以此建立了乳腺浸润性导管癌预后模型。Bychkov等[38]利用卷积和递归架构训练出的深度网络分析肿瘤组织病理图像以预测结直肠癌的预后。结果显示,与有经验的病理医师相比,深度学习可以从结直肠癌的病理组织形态中提取更多的预后信息。CAD可从肿瘤组织病理图像中挖掘可能影响预后的信息,帮助预测疾病的发展和预后情况,从而使肿瘤患者获得更为精准的治疗。
2 PMP病理图像分析的发展
2.1PMP病理的发展历程 1995年,Ronnett等[39]将黏液肿瘤分为:①播散性腹膜黏液腺瘤病(disseminated peritoneal adenomucinosis,DPAM),肿瘤上皮细胞较少有细胞异型性或核分裂象;②腹膜黏液腺癌病(peritoneal mucinous carcinomatosis,PMCA),肿瘤上皮细胞表现为癌的组织学和细胞学特征;③PMCA-I,具有中间型组织学特征。2005年,Loungnarath等[40]在Ronnett等[39]的基础上加入肿瘤形态和是否存在印戒细胞两个特征将PMP分为:①DPAM(G1),肿瘤上皮细胞呈单细胞或单层排列包绕腺体结构,纤维基质成分少,上皮细胞无异型性或有丝分裂象;②混合型(G2),大部分肿瘤特征与DPAM类似,但出现明显的细胞异型性和腺体结构融合;③黏液腺癌(G3),明显细胞异型性、侵袭性,或出现印戒细胞。Bradley等[41]研究发现,DPAM和PMCA-I患者的器官侵犯发生率及生存率比较差异无统计学意义,但PMCA的预后差,基于此研究结果将PMP分为低级别和高级别两类。2016年,腹膜表面肿瘤国际联盟就PMP病理类型达成共识,根据肿瘤细胞数量及癌巢形态、细胞异型性、核分裂数及侵犯周围形式分为无细胞性黏液、DPAM、PMCA、PMCA伴印戒细胞(PMCA-S)四类[4](图3、4)。
2.2PMP病理图像定量分析现状 PMP的组织学分级是影响患者预后的独立因素,对患者治疗方案的选择和疗效评估尤为重要。目前国际公认的PMP病理组织学分级主要根据肿瘤细胞数量及癌巢形态、细胞异型性、核分裂数及侵犯周围形式等对肿瘤进行评估,结果的准确性受病理医师经验水平、病理图像特征复杂程度等因素影响;此外,Mohamed等[42]研究发现,尽管大量病理学类型为DPAM的PMP患者预后相对较好,但部分DPAM患者死于快速进展的侵袭性疾病,5年生存率低于分化类型更差的DPAM-I患者,这与既往研究矛盾[39]。该研究认为,目前的病理学分类尚不足以准确预测患者预后,需要更深入的病理图像特征分析辅助。国内外已有少数学者尝试对PMP的病理图像进行定量分析,但由于PMP较为罕见且研究起步较晚,病理图像相关研究还处于半定量阶段,且研究较为粗糙,计算方法简单。

PMP:腹膜假黏液瘤;DPAM:播散性腹膜黏液腺瘤病;PMCA:腹膜黏液腺癌病;HE:苏木精-伊红;3a:无细胞性黏液:纤维结缔组织中可见大量黏液,黏液中无上皮细胞;3b:DPAM:黏液内上皮成分罕见,肿瘤细胞呈条带状、簇状或岛状结构,肿瘤细胞轻度异型性,核小且规则,核分裂象罕见;3c:PMCA:肿瘤上皮细胞多,可排列呈条索状、筛状或岛状等;肿瘤细胞高度异型性,核大且核仁明显,核分裂象常见;3d:PMCA-S:黏液中漂浮大量印戒细胞,胞质中大量黏液聚集,核位于细胞一侧,蓝色箭头所示为印戒细胞图3 PMP主要病理学类型(HE染色×200)
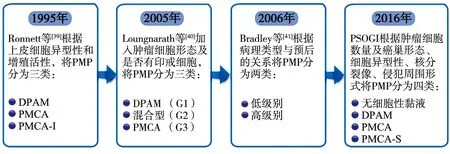
PMP:腹膜假黏液瘤;DPAM:播散性腹膜黏液腺瘤病;PMCA:腹膜黏液腺癌病;PMCA-I:中间型;PMCA-S:腹膜黏液腺癌病伴印戒细胞;PSOGI:腹膜表面肿瘤国际联盟图4 PMP病理诊断学研究的发展历程
Badyal等[43]回顾性分析21例PMP患者的腹水涂片,观察细胞密度(低、中、高)、黏液物质特征、上皮细胞簇数量、细胞异型性(轻、中、重)、核仁、核分裂象和印戒细胞等的情况。上皮细胞簇数量用半定量法评估:在高倍镜视野(×400)下,0(无细胞簇)、+(少量,1~3个细胞簇)、++(中量,3~10个细胞簇)、+++(大量,>10个细胞簇)。结果显示,PMCA具有高细胞密度、中度至重度细胞异型性、大量上皮细胞簇和明显的核仁及有丝分裂象。该研究除了上皮细胞簇的计数使用较为客观的分层方法,其余观察指标如细胞密度、核仁情况、细胞异型性和有丝分裂象等仍依赖病理医师主观视觉搜索的传统阅片模式,未进行定量评估。
Bhatt等[44]根据肿瘤组织的细胞学特征将DPAM分成三个亚组,组1为单层柱状上皮,组2为低级别柱状上皮细胞,组3为局灶高级别柱状上皮细胞。随访显示:组1患者均存活,且组1和组2患者的无病生存期长于组3。但由于患者数量较少,无法得出统计学差异,需要行进一步的大样本数据研究。虽然该结果未获得验证,但为PMP预后评估研究提供了新思路,即肿瘤细胞形态可能对PMP的预后有重要影响。
Choudry等[45]回顾性分析了310例行肿瘤细胞减灭术联合腹腔热灌注化疗术治疗的PMP患者的临床病理资料,根据肿瘤上皮细胞密度将患者分为4组:无细胞性黏液、低细胞密度(<2%)、中细胞密度(2%~19%)、高细胞密度(>20%)。结果显示:与无细胞性黏液患者相比,中或高细胞密度的PMP患者的无进展生存期更短。Horvath等[46]的研究也得到类似的结果,其参照Choudry等[45]的研究,回顾性分析25例DPAM患者的临床病理资料发现,随着细胞密度的升高,PMP患者的复发风险也随之增加。以上两项研究提示,中或高细胞密度的PMP患者具有更强的肿瘤生物学活性,疾病进展风险也更高。以上发现有助于指导患者的预后随访,对中或高细胞密度的PMP患者需进行深入而细致的随访以早期发现复发性疾病。
肿瘤细胞密度、形态等病理学特征可能会影响PMP患者的预后,其不仅为PMP预后预测提供新的研究方向和研究指标,也是对现有PMP的组织学分级诊断体系的补充。
3 结 语
当前研究提示,PMP的病理图像定量分析可以用于挖掘影响患者预后的信息,但PMP作为一种罕见病,病理研究起步较晚;且由于病理图像本身的复杂性,少有类似于免疫组织化学或荧光染色的商业化图像分析软件,这些因素导致PMP的病理图像分析发展缓慢,目前针对PMP病理图像的研究多为经验性分析诊断。数字病理图像定量分析在其他肿瘤中已进行广泛深入的研究,PMP亟须建立计算机辅助的图像定量分析,以提高PMP组织学分级的精确性。
