口腔鳞状细胞癌组织中TM4SF1 mRNA的筛选及其蛋白的表达变化观察
2020-12-29刘佳艺邵梦楠檀燕君郑盛峰1杨小丽李萍
刘佳艺,邵梦楠,檀燕君,郑盛峰1,,杨小丽,李萍
1广西医科大学第一附属医院,南宁530021;2广西医科大学附属口腔医院;3广西医科大学科学实验中心
口腔鳞状细胞癌(鳞癌)约占口腔面部恶性肿瘤的80%以上,是最常见的一种口腔癌病理类型,其病死率约占世界癌症病死率的第 6 位[1],具有很高的转移潜能[2],延迟治疗被认为是存活率无改善的主要原因。因此,寻找能准确预测肿瘤的发生以及监测肿瘤进展的分子靶点具有重要意义。跨膜四超家族成员1蛋白(TM4SF1)是一种在多数上皮细胞癌中高表达的肿瘤相关抗原,并具有抗体介导治疗的潜在靶点[3]。研究表明,TM4SF1对前列腺癌[4]、肺癌[5]、乳腺癌[6]、肝癌[7]特别是胰腺癌[8]等多种癌细胞的增殖、黏附、运动和侵袭有调节作用。然而,TM4SF1在口腔鳞癌中的作用尚未阐明。2019年5~10月,本研究结合高通量基因表达数据库(GEO,https://www.Ncbi.nlm.nih.gov/gds)和免疫组化方法观察了TM4SF1在口腔鳞癌患者的癌组织和癌旁黏膜组织中的表达变化,并分析其与临床病理资料的关系,以探讨其临床意义。
1 资料与方法
1.1 临床资料 2018年1月~2019年5月在广西医科大学附属口腔医院接受手术治疗的口腔鳞癌患者41例,年龄30~ 88岁,发病部位在舌体21例、唇部 6例、牙龈6例、颊部4例、腭部2例、扁桃体腺窝及颌下区分别为1例。按American Joint Committee on Cancer(AJCC,2016年第八版)分期标准,Ⅰ期5例、Ⅱ期9例、Ⅲ期8例、Ⅳ期10例。手术前,患者均未采取放、化疗等措施,术中留取肿瘤组织及癌旁黏膜组织(距离肿瘤组织>3 cm或无癌组织浸润的手术切缘),组织离体后立即用4%中性甲醛缓冲液固定。在采集标本前,均取得患者及其家属同意并签署相关知情同意书,后经广西口腔医院伦理委员会审核通过。
1.2 口腔鳞癌和癌旁黏膜组织中TM4SF1 mRNA的筛选及分析 从GEO公共数据库(https://www.Ncbi.nlm.nih.gov /gds)下载口腔鳞癌基因表达谱及相关临床数据(研究号分别为GSE13601、GSE19089、GSE74530、GSE78060、GSE9844)。GSE13601 包含1个芯片平台,为 Affymetrix Human Genome U95 Version 2 Array(GPL8300);GSE19089含1个芯片平台,为Illumina HumanHT-12 V3.0 expression beadchip(GPL6947);GSE74530含1个芯片平台,为Affymetrix Human Genome U133 Plus 2.0 Array(GPL570);GSE78060含1个芯片平台,为Affymetrix Human Genome U133 Plus 2.0 Array(GPL570);GSE9844含1个芯片平台,为Affymetrix Human Genome U133 Plus 2.0 Array(GPL570)。从这5个TM4SF1探针中获得标准化均数差(SMD)和中间表达值。利用GEO数据库的GEO2R工具对口腔鳞癌和癌旁黏膜组织中TM4SF1 mRNA进行筛选和分析。用Stata软件将提取的芯片信息组合在一起,5个基因表达矩阵生成森林图。
1.3 口腔鳞癌及癌旁组织中TM4SF1蛋白检测 采用免疫组织化学SP法。口腔鳞癌及癌旁黏膜组织经常规石蜡包埋后,用4 μm厚度连续切片,采用0.01 mmol/L枸橼酸缓冲液抗原修复5 min;室温自然冷却,加入SP-9000试剂盒(购自北京中杉金桥生物技术有限公司)中的内源性过氧化酶阻断剂反应15 min;PBS冲洗3次,加入封闭用正常山羊血清工作液15 min;倾倒后分别加入兔抗人多克隆TM4SF1抗体(1∶200,ab113504,购自Abcam公司),4 ℃恒温冰箱孵育过夜;PBS冲洗3次,加山羊抗小鼠/兔IgG聚合物反应15 min,PBS冲洗3次;加辣根酶标记链酶卵白素工作液15 min,PBS冲洗3次;利用DAB显色试剂盒(购自北京中杉金桥生物技术有限公司)显色后苏木素复染。最后所有切片在显微镜下进行双盲免疫反应性评分系统(IRS)评分。IRS是由细胞染色强度和细胞染色比例的数据结合而成,染色强度分为0~3级:细胞不着色计0分;弱染色(淡黄色)计1分;中度染色(中黄色)计2 分;强烈染色(棕黄色)计3 分。细胞染色的比例按0~4等级评分如下:染色细胞<1%计0分;1%~10%计1分;11%~50%计2分;51%~80%计3分;>80%计4分。最终IRS为染色得分乘以染色比例,总得分大于3为阳性表达,总分1~3为低表达,0为阴性表达[9]。
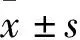
2 结果
2.1 口腔鳞癌组织中TM4SF1 mRNA的筛选、分析结果 GSE13601、GSE19089、GSE74530、GSE78060、GSE9844基因表达矩阵分析结果显示,口腔鳞癌组织中TM4SF1 mRNA表达高于癌旁组织(P均<0.05)。森林图显示,口腔鳞癌组织中TM4SF1 mRNA表达高于癌旁组织(SMD=1.520;I2=81.3%;95%CI:0.507~0.958;P<0.05)。
2.2 口腔鳞癌组织及癌旁黏膜组织TM4SF1蛋白、mRNA表达比较 TM4SF1蛋白在口腔鳞癌癌细胞中主要定位于细胞膜,呈连续性表达,部分呈棕黄色细颗粒状出现在细胞质;癌旁黏膜组织中TM4SF1蛋白表达主要呈阴性或低表达。口腔鳞癌组织及癌旁黏膜组织中TM4SF1蛋白高表达分别为22、17例,低表达或阴性表达分别为19、24例,两者比较,P<0.05。口腔鳞癌组织和癌旁黏膜组织的IRS评分分别为4.20、2.44分,两者比较,P<0.05。
2.3 口腔鳞癌组织中TM4SF1蛋白表达与患者临床病理资料的关系 TM4SF1蛋白在Ⅲ~Ⅳ期口腔鳞癌组织中的阳性表达量高于Ⅰ~Ⅱ期(P<0.05),但其他临床病理参数包括民族、年龄、性别、吸烟、饮酒、血型、分级、肿瘤大小、淋巴结转移与TM4SF1蛋白表达无关(P均>0.05)。
3 讨论
TM4SF1是跨膜4蛋白16超家族的成员,由202个氨基酸组成的低分子量蛋白质,相对分子质量约为21 kD[10,11]。在染色体区TM4SF1基因定位于3q21-3q25,在质膜和胞内小泡中大量表达。在活化的内皮细胞中TM4SF1蛋白呈高表达状态,可激活血管内皮生长因子(VEGF)-A或凝血酶来刺激血管生成,通过增加丝状伪足的形成,促进细胞转移。
TM4SF1也称肿瘤相关抗原L6(TAAL6),是TM4SF家族的一个远亲。Gordon 等[12]认为 TM4SF1可促进胸膜间皮肿瘤细胞的生长和肺癌细胞的侵袭能力,抗体(Anti-TM4SF1)可以使肺癌细胞的侵袭能力显著降低[13]。亦有文献报道,TM4SF1基因的低表达、不表达可明显减弱宫颈癌细胞和前列腺细胞的转移能力。Shih等发现,在多种肿瘤的血管内皮细胞(EC)中TM4SF1蛋白呈高表达,并与EC 的伪足形成密切相关,将TM4SF1基因沉默后可有效阻止EC的伪足形成、抑制EC的迁移,可大量抑制VEGF-A诱导的微血管形成。Gordon等[12]报道,TM4SF1是恶性胸膜间皮瘤细胞凋亡的负调控基因,可促进肿瘤细胞的生长。多种肿瘤的发生发展被证实与TM4SF1有关,然而TM4SF1在口腔鳞癌中的表达情况目前尚未见报道。
本研究首先通过GEO数据库分析发现,口腔鳞癌组织中TM4SF1的mRNA表达水平显著高于癌旁组织。进一步通过免疫组化实验发现,TM4SF1蛋白在口腔鳞癌组织中的表达水平高于癌旁黏膜组织,提示TM4SF1可作为口腔鳞癌潜在诊断标志物。Gao等[14]发现,TM4SF1蛋白在FIGO Ⅲ~Ⅳ期卵巢上皮性癌组织中的阳性表达率高于FIGOⅠ~Ⅱ期。本研究发现,Ⅲ~Ⅳ期口腔鳞癌患者癌组织中TM4SF1蛋白表达量高于Ⅰ~Ⅱ期口腔鳞癌,与文献报道结果相似,提示TM4SF1的表达随着口腔黏膜上皮细胞的异常增生和恶性转化而升高,因此认为,TM4SF1可能参与了口腔鳞癌的发生发展。研究[4]表明,TM4SF1对癌细胞的部分生物行为有重要影响,包括癌细胞的分化程度、转移能力和生长情况,但本研究并未发现TM4SF1与口腔鳞癌分化程度、转移能力和肿瘤大小有关,可能与本研究病例数偏少及入选病例中壮族人口占比较多有关。
综上所述,本研究发现,TM4SF1 mRNA及蛋白在口腔鳞癌中的表达水平高于癌旁黏膜组织,并与口腔鳞癌高临床分期有关,表明TM4SF1可能参与了口腔鳞癌的发生发展,但其确切机制目前尚不清楚,进一步拟设计实验探究TM4SF1参与口腔鳞癌进展的机制。
