含蛋白结构域A的纤维连接蛋白在根尖囊肿中的表达及作用机制*
2020-12-28陈柚杉王海丞
陈柚杉,王海丞
1.同济大学附属口腔医院检验科,上海 200072;2.同济大学附属口腔医学院/上海牙组织修复与再生工程技术研究中心,上海 200072
在使颌骨变形的良性病变中,牙源性囊肿约占18.5%,其中52.0%~68.0%为根尖囊肿[1]。根尖囊肿的囊壁主要由细胞外基质(ECM)、细胞因子和成纤维细胞的代谢产物组成[2-3],其通过调节破骨细胞的分化或活化,创造有利于破骨细胞生成的微环境,诱导破骨细胞形成,导致骨破坏,从而参与病变的发展[4-5]。纤维连接蛋白(FN)是ECM的主要成分,广泛分布于结缔组织中,可通过将FN基因中的蛋白结构域A(EDA)、蛋白结构域B(EDB)和CS1结构域交替剪接产生不同的FN亚型,包括含EDA的FA(EDA+FN)、含EDB的FN(EDB+FN)和含CS1的FN(CS1-FN)[6]。在慢性炎性反应浸润下,根尖囊肿的基质可能形成一种微环境,激活成纤维细胞产生不同的FN亚型。不同的FN亚型可参与各种疾病的细胞增殖、转移或局部浸润,从而影响疾病的发展[7-8]。有研究表明,EDA+FN、EDB+FN和CS1-FN可能与分泌破骨相关因子的成纤维细胞相互作用,从而影响破骨细胞的形成[4,9]。本文在研究不同FN亚型与根尖囊肿颌骨病变范围关系的基础上,通过比较不同条件下体外诱导破骨细胞的数量和破骨细胞相关因子的微小RNA(mRNA)表达水平,探讨了EDA+FN与根尖囊肿骨破坏间的关系。
1 资料与方法
1.1一般资料 选取2016-2017年同济大学附属口腔医院口腔颌面外科手术切除的根尖囊肿标本20例作为研究组,6例接受正颌手术患者的正常颌骨标本作为对照组。所有研究对象均签署知情同意书,本研究经医院伦理委员会批准。
1.2方法
1.2.1免疫组织化学法染色 将研究组20例根尖囊肿标本经40%甲醛固定,石蜡包埋,4 μm连续切片;4 ℃下用IST-9、BC-1和P1F11抗体染色过夜(IST-9、BC-1和P1F11分别检测EDA+FN、EDB+FN、CS1-FN);采用磷酸盐缓冲液(PBS)代替一抗作为阴性对照,然后加生物素二抗(1∶500),37 ℃孵育30 min;采用二氨基联苯胺染色。染色强度用积分光密度与染色面积之比表示。
1.2.2细胞培养 从研究组根尖囊肿标本中分离出成纤维细胞,并在α修饰的Eagle培养基(α-MEM)中培养;对照组6例正常颌骨标本处理步骤与研究组相同;鼠破骨细胞前体细胞系Raw264.7也在α-MEM中培养。α-MEM中加入10%胎牛血清(FBS)、2 mmol/L L-谷氨酰胺、100 U/mL青霉素及100 μg/mL链霉素;培养条件:37 ℃、95%湿度、5%CO2。
1.2.3体外诱导破骨细胞形成 上述研究组与对照组分离的成纤维细胞分别在100 mm培养皿中生长至70%~80%融合时,采用无血清α-MEM置换培养基。培养7 d后,收集上清液并离心(550×g,10 min),将50%上清液、40%α-MEM、10%FBS和12 ng/μL重组鼠核因子-κB受体活化因子配体(RANKL)混合,以制备用于在体外诱导破骨细胞的条件培养基。将鼠破骨细胞前体细胞系Raw264.7以1 000个/孔接种于24孔板中,加入上述条件培养基进行培养,2 d更换1次培养基,持续培养10 d。用4%多聚甲醛固定细胞,用抗酒石酸酸性磷酸酶(Trap)试剂盒进行细胞染色。Trap染色阳性的多核(≥3个核)细胞计为破骨细胞。
1.2.4敲除EDA外显子 从研究组20例标本中选取6例可提供足够细胞的根尖囊肿标本,用于分离成纤维细胞,当成纤维细胞生长至60%~70%融合时,将培养基替换为无血清α-MEM,孵育6 h;用脂质体2000将pX330载体CRISPR/Cas9质粒转染到细胞中敲除EDA外显子;48 h后,收集存活的细胞制备条件培养基[10],使用该条件培养基在体外诱导破骨细胞,作为EDA敲除组。另从研究组中选取6例根尖囊肿标本作为非EDA敲除组,保留EDA外显子,其余处理步骤与EDA敲除组相同。
1.2.5RNA提取和实时荧光定量PCR(RT-qPCR)检测 各组提取RNA,将Trizol试剂纯化的2 μg RNA用反转录试剂盒合成cDNA;吸取20 μL cDNA,用RT-qPCR检测各组成纤维细胞中破骨相关因子[肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、血管内皮生长因子A(VEGFA)、白细胞介素-17(IL-17)、环氧化酶-2(COX-2)、巨噬细胞集落刺激因子(M-CSF)、白细胞介素-1α(IL-1α)、RANKL、骨骼保护素(OPG)、RANKL/OPG]的mRNA表达水平;检测研究组与对照组EDA+FN、EDB+FN、CS1-FN的mRNA表达水平。反应条件:孵育95 ℃ 10 min,退火/扩增95 ℃ 15 s,60 ℃ 1 min,40个循环。

2 结 果
2.1EDA+FN染色强度与根尖囊肿颌骨病变范围的关系 EDA+FN明显比EDB+FN和CS1-FN的染色面积更大、颜色更深。以EDA+FN、EDB+FN和CS1-FN的染色强度中值为界分为高、低染色强度,分析不同FN亚型染色强度与根尖囊肿颌骨病变范围的关系。结果显示,EDA+FN高染色强度患者病变范围>150 mm2的人数比例高于低染色强度患者(P<0.05);进一步行相关性分析发现,EDA+FN的染色强度与病变范围呈正相关(r=0.594,P=0.006);而EDB+FN与CS1-FN不同染色强度患者病变范围>150 mm2的人数比例比较,差异均无统计学意义(P>0.05)。见表1。
2.2EDA+FN促进破骨细胞的形成和破骨相关因子的表达 分析研究组和对照组成纤维细胞中不同FN亚型的mRNA表达水平,所有亚型中以EDA+FN mRNA表达水平最高,且研究组EDA+FN mRNA表达水平(0.389±0.175)明显高于对照组(0.183±0.138),差异有统计学意义(P<0.05)。相关性分析结果显示,研究组成纤维细胞诱导的破骨细胞数与EDA+FN mRNA表达水平呈正相关(r=0.817,P<0.001)。研究组成纤维细胞诱导的破骨细胞数为(12.075±7.500)个,明显高于对照组的(5.290±2.170)个(P<0.05),见图1。研究组成纤维细胞中COX-2、IL-6、IL-17和RANKL/OPG的mRNA表达水平明显高于对照组,IL-1α的mRNA表达水平明显低于对照组,差异均有统计学意义(P<0.05),见表2。
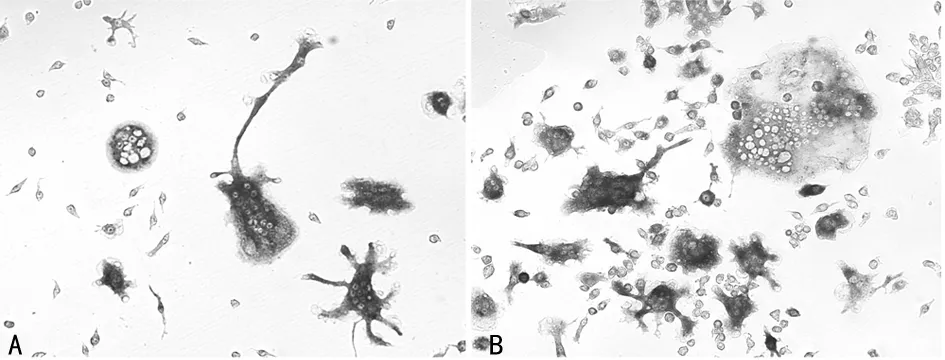
注:A为对照组体外诱导的破骨细胞;B为研究组体外诱导的破骨细胞。
2.3EDA敲除组与非EDA敲除组成纤维细胞中破骨相关因子mRNA表达水平比较 EDA敲除组成纤维细胞诱导的破骨细胞数为(6.083±2.217)个,明显少于非EDA敲除组的(9.292±1.933)个(P<0.05)。EDA敲除组成纤维细胞中IL-6、M-CSF、TNF-α、VEGFA、RANKL和RANKL/OPG的mRNA表达水平均低于非EDA敲除组(P<0.05)。见表3。
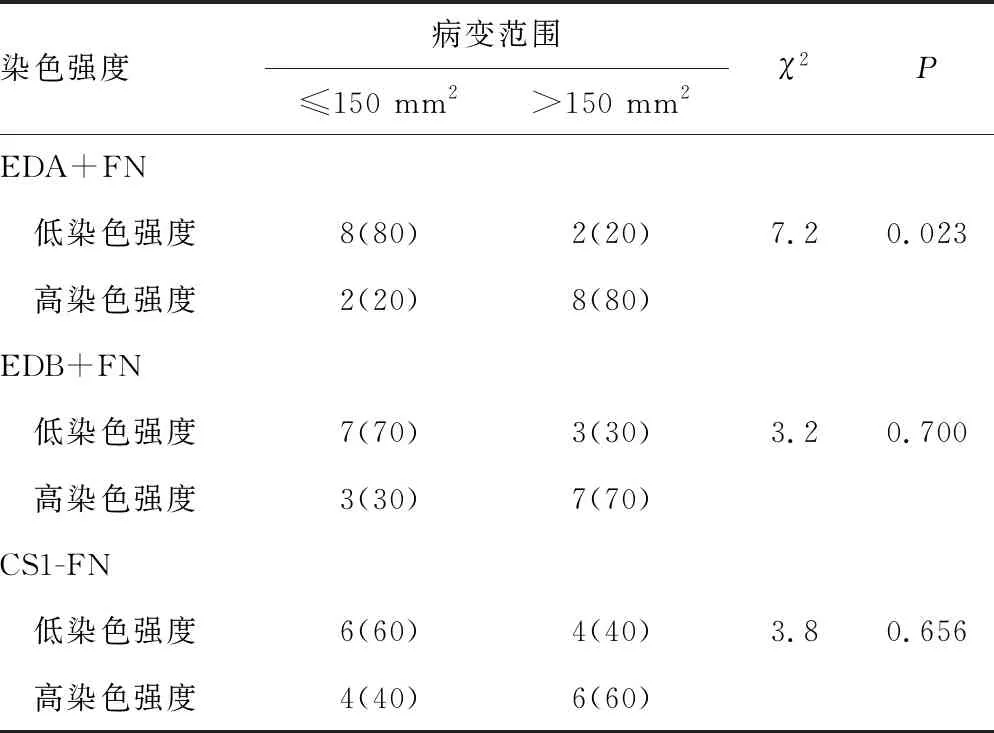
表1 不同FN亚型染色强度与根尖囊肿颌骨病变范围的关系[n(%)]
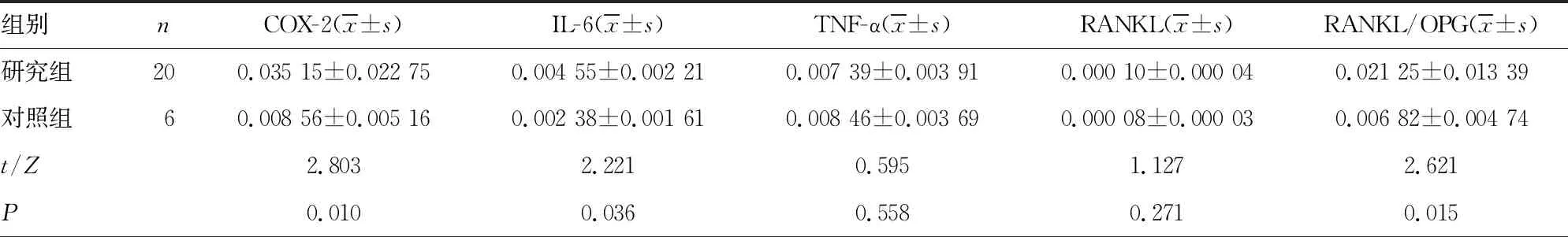
表2 研究组、对照组成纤维细胞中破骨相关因子的mRNA表达水平比较

组别nIL-17(x±s)VEGFA(x±s)OPG[M(P25,P75)]M-CSF[M(P25,P75)]IL-1α[M(P25,P75)]研究组200.014 53±0.005 000.007 71±0.002 810.003 85(0.001 09,0.014 24)0.005 96(0.003 88,0.008 06)0.003 68(0.002 07,0.003 69)对照组60.007 64±0.006 600.006 73±0.003 640.015 01(0.008 02,0.024 47)0.000 15(0.000 04,0.020 54)0.011 16(0.007 44,0.025 60)t/Z2.7550.7011.5221.0962.721P0.0110.4900.1280.2730.007
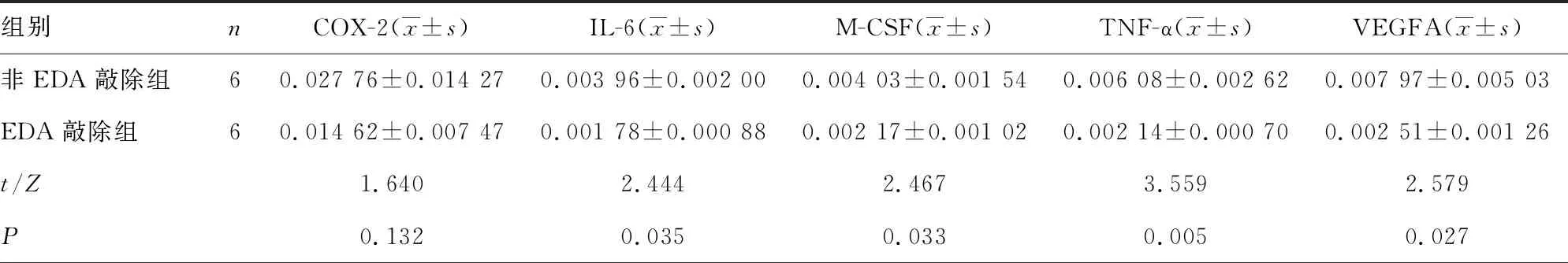
表3 EDA敲除组与非EDA敲除组成纤维细胞中破骨相关因子mRNA表达水平比较
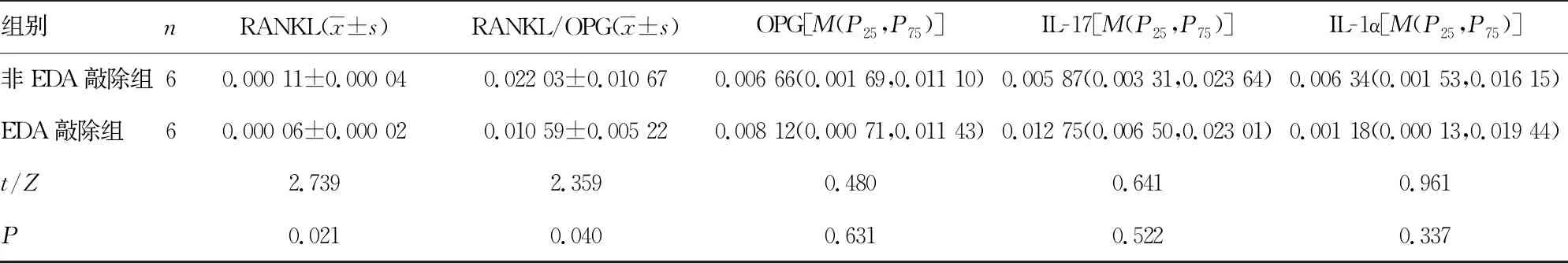
组别nRANKL(x±s)RANKL/OPG(x±s)OPG[M(P25,P75)]IL-17[M(P25,P75)]IL-1α[M(P25,P75)]非EDA敲除组60.000 11±0.000 040.022 03±0.010 670.006 66(0.001 69,0.011 10)0.005 87(0.003 31,0.023 64)0.006 34(0.001 53,0.016 15)EDA敲除组60.000 06±0.000 020.010 59±0.005 220.008 12(0.000 71,0.011 43)0.012 75(0.006 50,0.023 01)0.001 18(0.000 13,0.019 44)t/Z2.7392.3590.4800.6410.961P0.0210.0400.6310.5220.337
3 讨 论
根尖囊肿是慢性根尖周炎的一种,会破坏患者牙齿根尖周围的牙槽骨[11-12],且在此破坏过程中,成纤维细胞的增殖或囊肿基质中的炎症环境促进了FN基因的可变剪接,产生EDA+FN、EDB+FN和CS1-FN亚型[13-15],这些亚型可刺激成纤维细胞产生破骨相关因子,诱导破骨细胞生成[4,9]。
在本研究中,采用免疫组织化学法对根尖囊肿标本进行染色,比较了不同亚型的染色强度,结果显示,EDA+FN明显比EDB+FN和CS1-FN的染色面积更大、颜色更深,且EDA+FN的染色强度与颌骨病变病变范围呈正相关,提示EDA+FN可能是造成骨破坏的主要亚型。本研究中,研究组破骨相关因子COX-2、IL-6、IL-17和RANKL/OPG的mRNA表达水平高于对照组,提示上述破骨相关因子在根尖囊肿骨破坏中发挥重要作用。但研究组IL-1α的mRNA表达水平低于对照组,考虑与纳入样本量较少有关。既往研究表明,牙源性囊肿纤维囊中的成纤维细胞有利于破骨细胞形成,在颌骨骨破坏中起重要作用[2]。在本研究中,分别用根尖囊肿和正常颌骨的成纤维细胞体外诱导破骨细胞,根尖囊肿成纤维细胞诱导的破骨细胞明显多于正常颌骨成纤维细胞诱导的破骨细胞,这表明根尖囊肿成纤维细胞可促进破骨细胞的形成,与上述研究结果一致。相关性分析结果显示,研究组成纤维细胞诱导的破骨细胞数与EDA+FN mRNA表达水平呈正相关(r=0.817,P<0.001),提示EDA+FN可能是成纤维细胞中发挥促进破骨细胞形成的主要亚型。进一步使用CRISPR/Cas9系统敲除根尖囊肿中成纤维细胞的EDA外显子,发现敲除EDA外显子后的成纤维细胞所诱导的破骨细胞明显减少,且根尖囊肿成纤维细胞中TNF-α、RANKL、RANKL/OPG、IL-6、M-CSF和VEGFA的表达也被抑制,表明是EDA+FN中的EDA外显子在成纤维细胞分泌破骨相关因子中发挥了关键作用,并影响了破骨细胞的形成。根尖囊肿成纤维细胞能分泌EDA+FN,EDA+FN又作用于成纤维细胞,导致一系列破骨相关因子的高表达,从而刺激并促进破骨细胞的生成,造成骨破坏,提示EDA有可能成为抑制骨破坏的潜在靶点。
综上所述,根尖囊肿成纤维细胞能分泌EDA+FN,促进骨破坏,而敲除EDA外显子可抑制骨破坏,为临床治疗提供了新的靶点。
