响应面法优化苦荞麦水溶性清蛋白提取工艺研究
2020-12-18吴颖王啸邱树毅马琳娜张芮瑞蒲璐璐
吴颖,王啸,邱树毅,马琳娜,张芮瑞,蒲璐璐
(贵州大学酿酒与食品工程学院,贵州贵阳550025)
苦荞麦,又名万年荞、野兰荞,简称苦荞,学名“鞑靼荞麦”(Fagopyrum tararicum),属蓼料双子叶植物[1],起源于中国西南地区[2],在陕西、山西、甘肃、云南、贵州、四川等省份均有栽种,是一种药食同源的农作物。苦荞麦含有淀粉(40.70%~86.41%)[3]、蛋白质(8.51%~18.87%)[4]、膳食纤维(3.4%~5.2%)[5]、微量元素以及抗氧化剂[6]等营养物质,与一般的粮食作物相比有较好的营养价值。苦荞麦富含的18种氨基酸中[7],赖氨酸、甘氨酸和精氨酸含量相对较高,可以成为其它食品的补充剂[8]。苦荞麦蛋白有降低胆固醇、抗高血压、改善便秘和肥胖[9-11]、抗疲劳、抑菌等生理活性[12-13]。苦荞麦蛋白与豆类作物相似,根据能在不同的溶剂中溶解可分为清蛋白、球蛋白、谷蛋白及醇溶蛋白。不同地区苦荞麦各蛋白组分有所差异,苦荞麦不同部位蛋白所占比例也有差异。大部分研究显示清蛋白和球蛋白含量相对较高[3],而其余两种蛋白含量则相对较少[8,14],李红梅等[15]在研究贵州威宁苦荞麦蛋白时得出清蛋白占总蛋白42.65%;有关学者[16]在研究甘肃定西苦荞麦蛋白时得出清蛋白占总蛋白32.20%。苦荞麦中不同蛋白均具有不同程度的降血脂功能,其中降血脂能力依次为清蛋白>球蛋白>谷蛋白[17]。李相沂[18]通过研究苦荞麦不同蛋白组分,分析表明在中性蛋白酶作用下清蛋白的酶解物对血管紧张转化素酶(angiotensin converting enzyme,ACE)有抑制活性,其抑制率可达33.38%,除此之外清蛋白还有较好的功能特性。目前对清蛋白提取条件进行优化的研究多集中在绿豆、芸豆、菜籽粕、米糠等谷物和副产物[19]。苦荞麦蛋白的研究大部分集中在对总蛋白的提取条件进行优化,而对苦荞麦清蛋白提取条件的优化相对较少。
目前对苦荞麦蛋白提取的方法主要有碱法提取、酶法提取、微波辅助提取、等电点法、Osborne分级法。大部分研究者多采用传统的碱溶酸沉法,但是在使用酸碱的过程中,容易引起蛋白质中部分氨基酸发生反应从而生成有毒物质,而且大量使用酸碱也会对环境造成污染。Osborne分级法提取蛋白操作简单、成本低。本文采用响应面法多个影响因素与响应值之间的函数关系,利用Box-Behnken中心组合试验设计,对试验数据进行分析,利用二次回归方程进行拟合,通过数据分析找出最佳工艺条件,为苦荞麦水溶性清蛋白的提取及综合开发利用提供依据。
1 材料与方法
1.1 材料和仪器
1.1.1 原料和试剂
苦荞麦:采摘于贵州省威宁县;85%磷酸:成都金山化学试剂有限公司;牛血清蛋白、考马斯亮蓝G-250:北京索莱宝科技有限公司;95%乙醇、石油醚:天津市富宇精细化工有限公司。
1.1.2 主要仪器
冷冻型多功能离心机(Thermo CR3i):美国赛默飞世尔科技公司;集热式恒温加热磁力搅拌器(DF-101S):上海邦西仪器科技有限公司;酶标仪(Spectra-Max190):MolecularDevices;电子分析天平(FA2004N):上海菁海仪器有限公司;高速多功能粉碎机(XTP-200G):浙江永康市红太阳机电有限公司;循环水式多用真空泵(SHB-Ⅲ):郑州长城科工贸有限公司。
1.2 试验方法
1.2.1 材料的处理
将干燥的苦荞麦种子于多功能粉碎机中粉碎,过80目筛。在苦荞麦粉中以1∶5(g/mL)的比例加入石油醚进行脱脂处理,脱脂期间数次更换石油醚[20-22]将脱脂后的苦荞麦粉过滤收集,于通风橱中风干备用[23]。
1.2.2 苦荞麦粗蛋白质含量测定
苦荞麦粗蛋白质含量测定采用凯氏定氮法,参照GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》[24]。
1.2.3 蛋白提取率计算方法
蛋白质提取率/%=提取液中蛋白质质量/苦荞麦粉中粗蛋白质质量×100[25]
1.2.4 蛋白含量测定
采用考马斯亮蓝法G-250测定蛋白含量:以牛血清白蛋白(bovine serum albumin,BSA)为标准品,分别吸取浓度为0.10 g/mL的标准蛋白溶液0、0.20、0.40、0.60、0.80、1.00 mL于试管中,用双蒸水补足溶液为1.00 mL。每管加入5.00 mL考马斯亮蓝G-250溶液反应5 min后,在595 nm条件下使用酶标仪测定蛋白吸光度,绘制牛血清白蛋白标准曲线[26]。建立回归方程:y=0.003 9x+0.006 2(R2=0.9973),其中 y 为吸光度,x为蛋白质质量浓度(mg/L),蛋白质标准曲线见图1。

图1 蛋白质标准曲线Fig.1 Protein standard curve
1.2.5 苦荞麦清蛋白提取工艺
称取5.00 g处理过的苦荞麦粉,按一定的料液比将苦荞麦粉置于双蒸水中搅拌提取,在一定温度和搅拌速度下,搅拌浸提一定时间后,在8 000 r/min的转速下离心20 min,取上层清液测定蛋白含量。
1.2.6 苦荞麦清蛋白提取单因素试验
1.2.6.1 料液比对苦荞麦水溶性清蛋白提取率的单因素试验
取5.00 g苦荞麦粉,在搅拌45 min,35℃的条件下做料液比 1 ∶5、1 ∶10、1 ∶15、1 ∶20、1 ∶25(g/mL)的单因素试验,在转速为8 000 r/min,20 min的条件下离心取上清液测定蛋白含量。
1.2.6.2 时间对苦荞麦水溶性清蛋白提取率的单因素试验
取5.00 g苦荞麦粉,在料液比为1∶10(g/mL),35℃的条件下做搅拌时间为 30、45、60、75、90 min 的单因素试验,在转速为8 000 r/min,20 min的条件下离心取上清液测定蛋白含量。
1.2.6.3 温度对苦荞麦水溶性清蛋白提取率的单因素试验
取 5.00 g苦荞麦粉,在料液比为 1 ∶10(g/mL),搅拌浸提时间为45 min的条件下做温度为30、35、40、45、50℃的单因素试验,在转速为8 000 r/min,20 min的条件下离心取上清液测定蛋白含量。
1.2.7 提取苦荞麦清蛋白响应面试验
本试验选取料液比、搅拌时间、搅拌温度3个影响因素,以清蛋白提取率为响应值,优化提取清蛋白的最佳工艺参数。根据设计结果共17个组合试验,其中12个组合为分析试验,5个组合为中心试验[27]。设计三因素三水平的响应分析试验,每个试验组合重复测定2次,取其平均值作为结果,其因素水平编码表见表1。
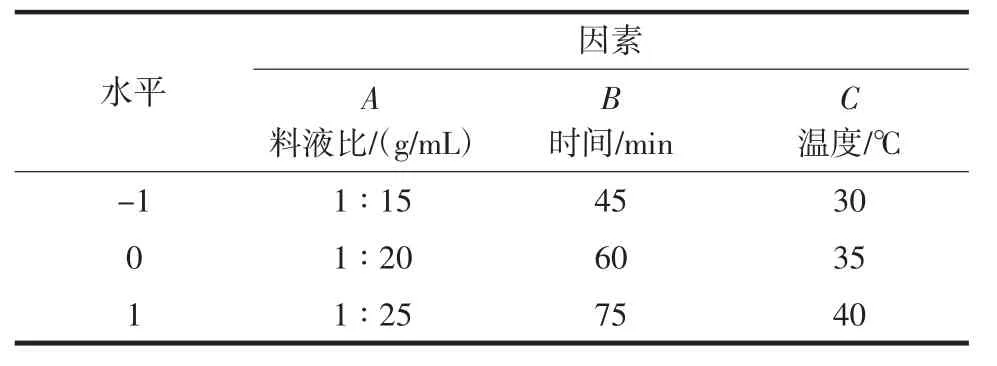
表1 Box-Behnken试验设计因素水平表Table 1 Factors and levels of Box-Behnken design
1.3 数据处理
采用 Origin 9.0软件进行作图和 Design-Expert 8.0.6软件进行Box-Behnken设计及数据分析和方差分析。
2 结果与讨论
2.1 料液比对苦荞麦清蛋白提取率的影响
料液比对苦荞清蛋白提取率的影响见图2。

图2 料液比对苦荞清蛋白提取率的影响Fig.2 The influence of solid-liquid ratio on the buckwheat albumin extraction yield
由图2可知在料液比为1∶5(g/mL)时,蛋白提取率最低,可能是溶剂太少且苦荞麦中含有较多的淀粉,溶剂可能被淀粉吸收,提取黏度大,没有足够的溶剂去溶解清蛋白,导致清蛋白溶出困难[28]。随着溶剂体积的增加,蛋白提取率与料液比呈正相关,当料液比为1∶20(g/mL)时,蛋白提取率达到最大值31.06%,溶剂体积的增加有助于清蛋白的溶出。随后蛋白提取率开始下降,可能是蛋白的溶出已达到饱和状态,苦荞麦清蛋白与水结合力降低,随着溶剂体积的增加清蛋白浓度反而减小,清蛋白提取率下降。有研究者[29]对苦荞麦麸皮的清蛋白进行提取,得出最佳工艺参数为:料液比 1∶12(g/mL),提取温度 35℃,提取时间60 min。因清蛋白提取的部位不同,所以最佳料液比有所差异。
2.2 时间对苦荞麦清蛋白提取率的影响
时间对苦荞清蛋白提取率的影响见图3。

图3 时间对苦荞清蛋白提取率的影响Fig.3 The influence of time on the buckwheat albumin extraction yield
从图3可知当提取时间从30 min增加到60 min时,蛋白提取率与时间呈正相关,在提取时间为60 min时,清蛋白溶出达到饱和状态,蛋白提取率达到最大22.91%。随着提取时间的继续增加蛋白质可能发生分解和变性,或是其它成分与蛋白质发生了结合,导致蛋白含量下降[30]。杨海霞[31]在提取内蒙甜荞清蛋白时,提取时间为30 min时达到最佳,有研究者[18]在料液比为1∶10(g/mL),温度为40℃,提取时间为3 h的条件下甜荞清蛋白得率为(4.95±2.23)g/100 g,可能本试验用的是苦荞,因品种不同所以最佳提取时间有所差异。
2.3 温度对苦荞麦清蛋白提取率的影响
温度对苦荞清蛋白提取率的影响见图4。
从图4可以看出30℃~35℃之间随着温度增加蛋白提取率增加,可能是刚开始温度的增加有助于分子的扩散运动,从而利于蛋白质溶出[32],蛋白提取率上升,35℃时达到最大值。35℃以后蛋白提取率与温度成负相关,温度越高蛋白提取率反而下降,可能是清蛋白是热不稳定、对温度较敏感的蛋白质[33],过高的温度对维持蛋白质空间结构造成破坏,导致清蛋白溶出少,且过高的温度会影响蛋白质的营养价值,所以清蛋白提取温度为35℃。陈晓萌[30]在提取大红芸豆清蛋白时,研究发现在40℃时蛋白提取率最大,过高的温度则引起蛋白质变性,提取率反而降低。姚海霞[19]在提取竹豆清蛋白时,45℃时清蛋白提取率达到最大,在55℃时蛋白提取率显著下降,可能是蛋白已经发生变性。因选取的原料有差异,所以清蛋白的最佳提取温度有所差异。

图4 温度对苦荞清蛋白提取率的影响Fig.4 The influence of temperature on the buckwheat albumin extraction yield
2.4 响应面试验设计及结果
根据提取苦荞麦清蛋白单因素试验结果,由Design-Expert 8.0.6软件设计出的试验方案及结果见表2。
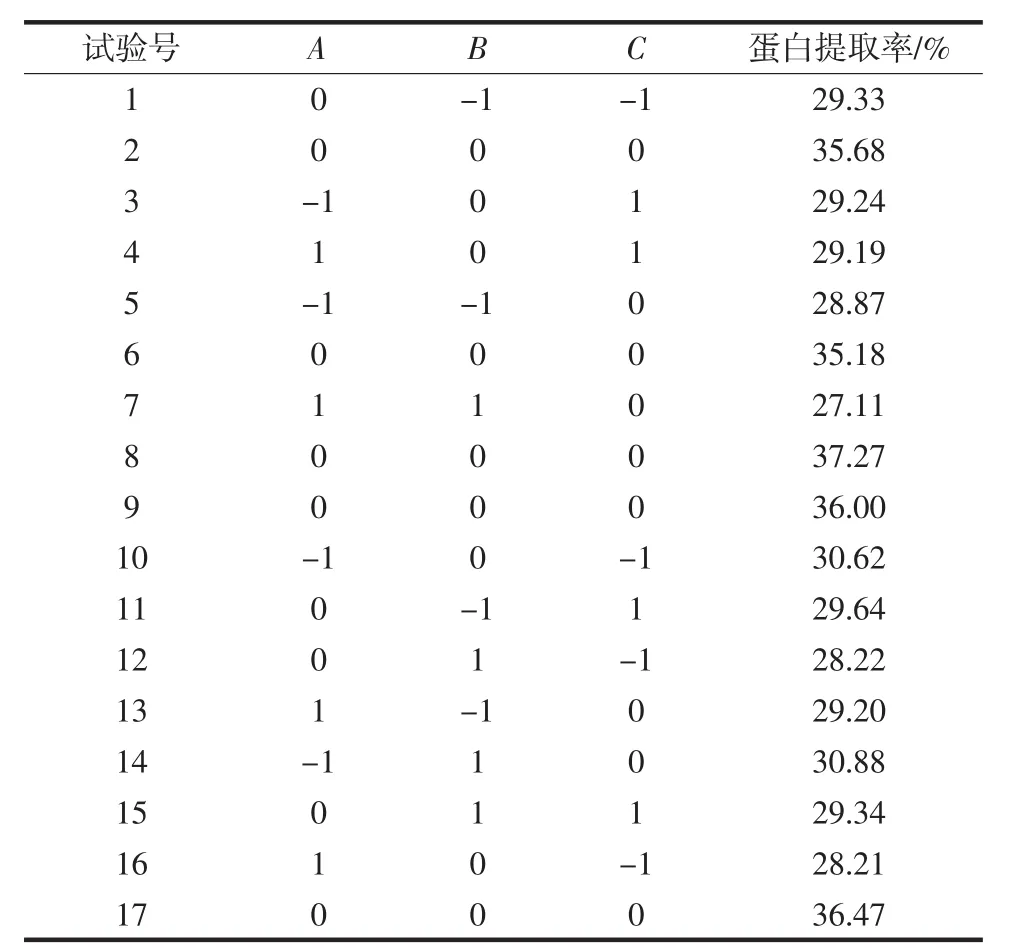
表2 响应面试验设计及结果Table 2 The response surface design of experimental results
2.5 回归方程及方差分析
通过表2的试验数据,采用Design-Expert 8.0.6软件进行拟合,得如下回归方程:蛋白提取率=36.12-0.74A-0.19B+0.13C-1.03AB+0.59AC+0.20BC-3.46A2-3.64B2-3.34C2。
响应面数据的方差分析结果见表3,结果显示该模型p值小于0.000 1,表明回归模型极显著。失拟检验是一种用来判断回归模型是否可以接受的检验,本试验失拟误差p=0.765>0.05,表明该模型与试验拟合误差不显著,数据较准确,该模型可以使用。本试验决定系数R2=0.9822,表明有98.22%的数据可以用此方程解释;校正系数R2adj=0.987 2,表明该试验结果有98.72%受控制因素的影响,未控制因素对试验结果造成的影响很小[32]。变异系数C.V.%=2.20%,C.V.%值越小,试验越可靠,精确度越高,可对苦荞麦清蛋白的提取工艺做初步分析和预测,试验实际值与预测值几乎一致。由各因素的p值可知,对苦荞麦清蛋白提取率影响顺序依次为:料液比(A)>搅拌时间(B)>搅拌温度(C);各因素之间交互作用对苦荞麦清蛋白提取率影响顺序依次为:料液比与时间(AB)>料液比与温度(AC)>时间与温度(BC)。
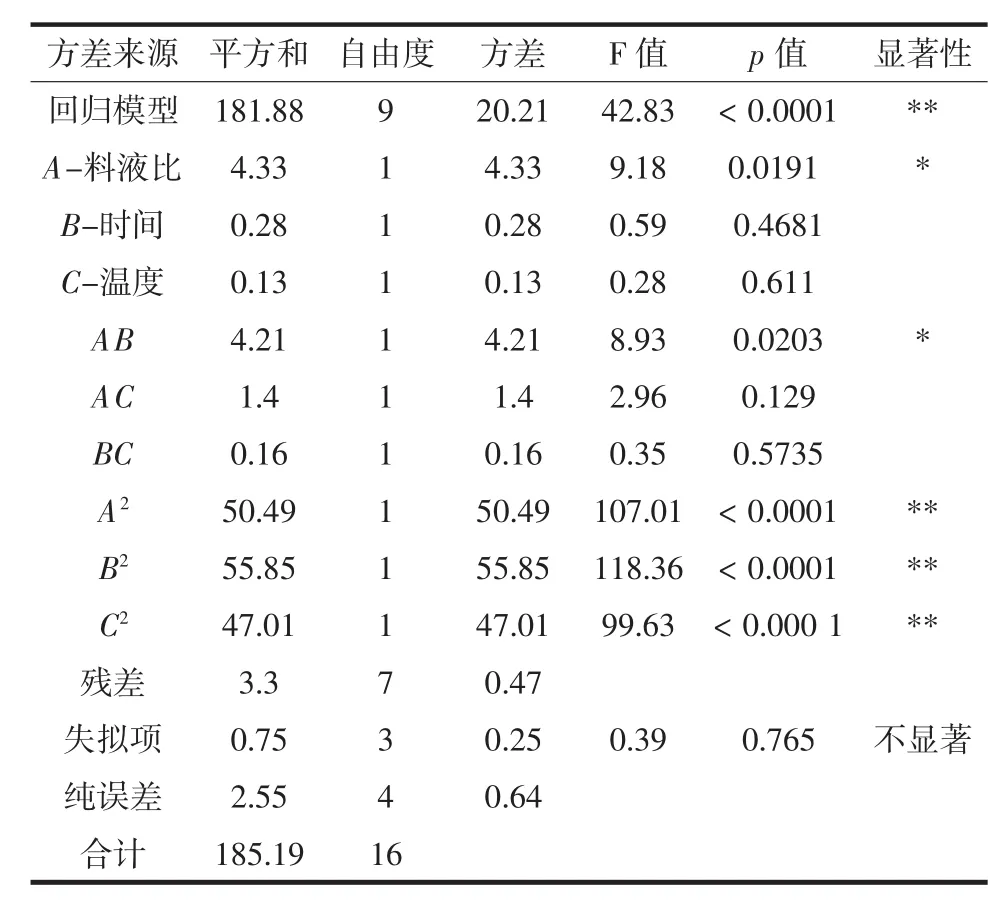
表3 回归模型方差分析Table 3 Variance analysis of regression model
2.6 响应面结果分析
料液比与时间交互作用对苦荞清蛋白提取率的影响见图5。

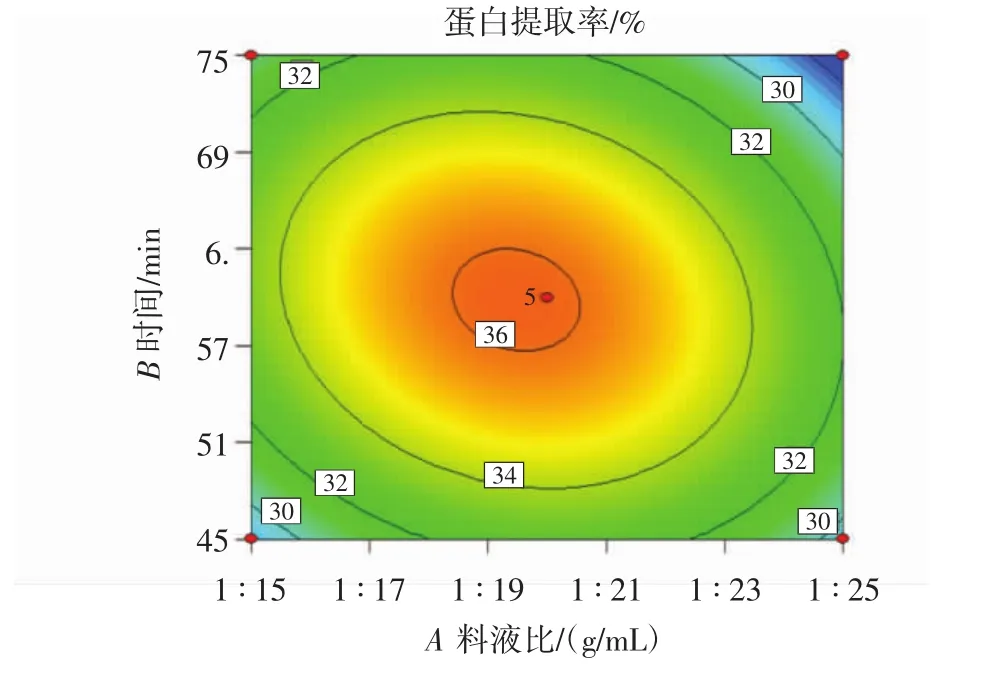
图5 料液比与时间交互作用对苦荞清蛋白提取率的影响Fig.5 Effect of material-liquid ratio interaction with time on the buckwheat albumin extraction rate
由图5的响应面图可知当料液比不变时,随着时间的增加,蛋白提取率呈现先上升后下降的趋势;当时间一定时,随着溶剂体积的增加,蛋白提取率呈现先上升后下降的趋势,在响应面的最顶处出现最大响应值。等高线图呈椭圆形,颜色逐渐加深,料液比和时间(AB)交互作用显著,在图5的等高线图中最小椭圆的中心点位置有响应面最大值。
料液比与温度交互作用对苦荞清蛋白提取率的影响见图6。

图6 料液比与温度交互作用对苦荞清蛋白提取率的影响Fig.6 Effect of interaction between feed-liquid ratio and temperature on the buckwheat albumin extraction rate
由图6的响应面图可知当其中一个变量不变时,蛋白提取率均呈现先上升后下降的趋势,在响应面的最顶处出现最大响应值。在图6的等高线图中最小椭圆的中心点位置有响应面最大值,料液比与温度(AC)的交互作用次于(AB)。
时间与温度交互作用对苦荞清蛋白蛋白提取率的影响见图7。

图7 时间与温度交互作用对苦荞清蛋白蛋白提取率的影响Fig.7 Effect of time and temperature interaction on the buckwheat albumin extraction rate
由图7的响应面图可知,当温度不变时,随着时间的增加,蛋白提取率先增加后减小;当时间不变时,随着温度的增加,蛋白提取率呈先上升后下降的趋势。在图7的等高线图中,等高线椭圆不明显,接近圆形,温度与时间两因素之间的交互作用对响应值的影响不显著,与方差分析结果一致。
2.7 验证试验
据所建立的数学模型进行参数最优分析,得到最佳预测工艺条件为:料液比1∶19.48(g/mL)、时间59.84 min、温度35.05℃,在此条件下得出的蛋白提取率为36.16%。考虑实际操作把条件更改为料液比1 ∶20(g/mL)、时间 60 min、温度 35℃,在此条件下,得出蛋白提取率为35.86%,与预测值36.16%接近,说明该模型能较好地预测实际蛋白提取率。
3 结论
本研究结果表明,在单因素试验基础上,采用三因素三水平的响应面分析方法,以料液比、搅拌时间、搅拌温度为试验因素,以清蛋白提取率为响应值。试验中苦荞麦水溶性清蛋白的最佳提取工艺条件为料液比 1 ∶20(g/mL),搅拌时间 60 min,搅拌温度 35 ℃,在此条件下蛋白提取率为35.86%。苦荞麦蛋白是调节人体生理功能的良好食品,食品界与医药界都有相关研究,且日益受到人们的关注。本研究结果为解决苦荞麦在食品和医药界的应用提供思路,为高效制备苦荞麦清蛋白提供一定的依据。
