泰州鹅开产前后肝脏组织转录组对比分析
2020-12-16章敬旗章玮月何文杰
张 蕾,章敬旗,章玮月,糜 娟,何文杰,王 健
(江苏农牧科技职业学院,江苏 泰州 225300)
0 引言
【研究意义】家禽的繁殖过程受到下丘脑-垂体-性腺轴的调控,该轴可分泌一系列激素从而影响家禽产蛋和繁殖周期[1−2]。正常情况下,家禽的性成熟开始于下丘脑分泌的GnRH(Gonadotropin-releasing hormone,性腺激素释放激素),从而刺激垂体分泌促LH(Luteinizing hormone,黄体生成素)和FSH(Follicle-stimulating hormone,促卵泡激素),这些相互关联的激素将触发鞘细胞和颗粒细胞合成性腺类固醇(雌二醇、睾酮、黄体酮),从而促进卵巢中卵泡的生长,也包括排卵前卵泡的发育和排卵[3−5]。家禽这种控制卵子形成的神经内分泌系统不仅仅使输卵管和卵巢发生相应生理变化,也刺激肝脏中相关激素依赖基因的表达[6−8]。肝脏中这些激素依赖基因的表达同时也支持着与生殖器官发育相关的脂质变化,包括蛋黄以及支持组织的形成等过程[9−10]。由此可见,肝脏在家禽产蛋过程中发挥着至关重要的作用。【前人研究进展】有研究表明,开产后蛋鸡的肝脏活动发生变化,开始合成大量的脂蛋白[11−12]。Li 等[13]首次对蛋鸡不同产蛋时期的肝脏转录组进行了对比分析,构建了蛋鸡肝脏中的脂肪代谢模式;张臻等[14]应用RNA-seq 技术对首次产蛋前后的鸡肝脏组织进行对比分析,获得了222 个差异基因,这些基因影响了肝脏中物质代谢途径的变化。我国养鹅历史悠久,是全球鹅品种资源遗传多样性最丰富的国家,现已知经国家或地方鉴定的大中小型地方鹅品种或者培育品种有40 多个[15]。随着经济的快速发展,“安全、营养、健康、绿色”的食品需求日益递增,鹅蛋、鹅肉等产品已经逐渐开始成为大众的消费热潮[16]。在养鹅生产蓬勃发展的推动下,对鹅优良品种的选育提出了更高的需求,推动了鹅遗传繁育研究工作的进展。泰州鹅是泰州市肉蛋兼用型地方优良畜禽资源,10 周龄体重可达4.0 kg,肉质优良;母鹅初产年产蛋量可达60~65 枚,高于大多数国内外其他大中型鹅种。【本研究切入点】但是由于受到季节性繁殖的限制和其他商品鹅配套系的冲击,泰州鹅种质资源一直未能很好地开发与利用。目前有关鹅产蛋过程中肝脏分子调控机制的研究甚少。【拟解决的关键问题】本研究通过RNA-Seq 技术,对首次开产前后泰州鹅的肝脏转录组数据进行了对比分析。通过挖掘筛选差异表达基因并进行GO分析和KEGG 生物信息学分析,以获得参与泰州鹅肝脏中与其开产相关的候选关键基因和信号通路,为加速泰州鹅地方种群的进一步选育以及特色配套系的开发利用提供理论参考。
1 材料与方法
1.1 试验动物
所用的泰州鹅为江苏省泰州市丰达水禽育种提供,选择同一来源(同批孵化、同批出雏、同一环境下予以全价日粮自由采食)的健康鹅群。随机抽样选取开产前10 周龄泰州鹅个体3 只(样品编号1、2、3)以及开产后40 周龄泰州鹅个体3 只(样品编号4、5、6)。按照国家实验动物处理行为准则进行屠宰,并立即采取肝脏组织放入无酶冻存管,保存于液氮中备用。
1.2 试验方法
1.2.1 RNA 提取及转录组测序 通过Trizol 法进行泰州鹅肝脏组织总RNA 提取,Nanodrop 检测提取的RNA 纯度,Qubit 2.0 检测提取的RNA 浓度,Aglient 2100 检测RNA 的完整性。所有样品RNA 提取并检测合格后,用干冰保存并送至上海欧易生物技术有限公司,应用Illumina HiSeq2500 高通量测序平台进行测序分析[17]。
1.2.2 测序数据分析 对测序滤得的clean data,通过TopHat2 软件进行序列比对,获得泰州鹅肝脏样本特异序列信息,并进行基因组定位分析。以|log2Fold change|≥1(P<0.05)为阈值进行差异表达基因的筛选,结合GO(Gene Ontology,基因本体)和KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)数据库对筛选获得的差异表达基因进行功能注释及通路富集分析[18]。
1.2.3 qRT-PCR 检测 随机选取1.2.2 中获得的5 个差异表达基因,采用Oligo 7.5 软件设计qRT-PCR 引物(表1),以反转录得到的开产前后泰州鹅肝脏样本(样本号1~6)的cDNA 为模板进行PCR 扩增,验证上述基因的表达规律。
1.3 数据分析
所有数据以平均值±标准误(X±SEM)表示,应用SPASS 19.0 统计学软件,采用两样本均数间t检验的方法,以P<0.05 视为差异显著(“*”表示);P<0.01 视为差异极显著(“**”表示)。目的基因表达量qRT-PCR 结果分析采用 2−△△Ct方法。

表 1 qRT-PCR 引物序列、退火温度以及目的片段大小Table 1 Primer sequences, annealing temperature, andpredicted length for qRT-PCR
2 结果与分析
2.1 开产前后泰州鹅肝脏组织转录组测序
本试验共构建开产前后泰州鹅6 个肝脏组织转录组文库,从表2 中可以看出,本试验6 个样品获得75 754 528~81 525 658 条reads,测序数据去除接头以及低质量数据后分别获得73 596 894~79 837 756个高质量数据(Clean reads),过滤后高质量序列数占原始下机序列数的比例均大于97%,表明6 个样品构建的文库质量较好;同时,过滤后总序列中准确率在99.9% 以上的碱基总数比例(Q30%)占95%以上,进一步说明测序结果质量较好。以上结果表明,本试验构建的泰州鹅6 个肝脏组织转录组文库质量好,可用于进一步试验,保证了后续研究的可靠性。
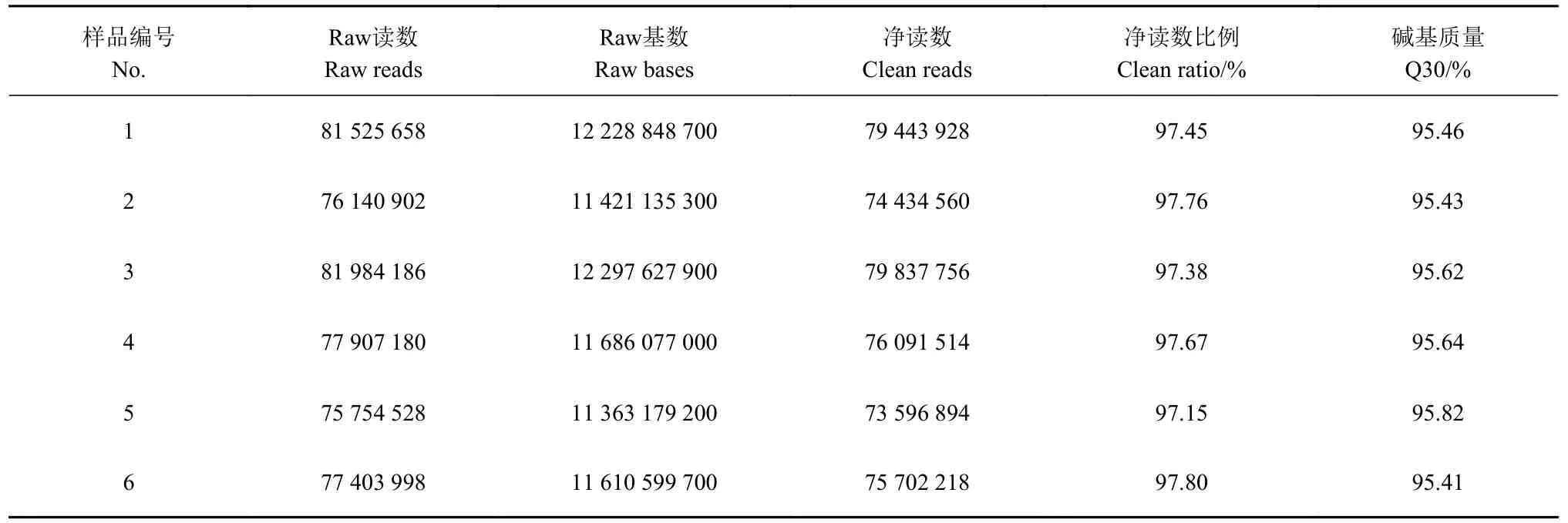
表 2 样本数据质量预处理评价分析Table 2 Quality evaluation and analysis on data preprocessing
2.2 测序数据比对分析
基因覆盖数指每个基因上的 reads 覆盖的碱基数跟基因编码区所有碱基数的比值。将RNA-Seq 过滤后的转录组数据(Clean data)与参考基因组进行比对分析,比对效率在88.61%~90.45%,多重覆盖率在2.5%~3.1%(表3)。上述比对结果表明,本试验的转录组数据利用率正常,所选用的参考基因组能够满足后续数据分析的要求。进一步结合HISAT软件对获得的转录组数据进行基因组结构比对分析,泰州鹅产蛋前、后肝脏组织的clean reads 依次分布于外显子区域、内含子区域和基因间区,其中外显子区域分布最多(图1)。上述比对结果表明,本试验的转录组数据丰富性较好,能有效筛选差异基因。

图 1 转录组数据比对基因区域分布统计Fig. 1 Transcriptome data vs. regional distribution of genes
2.3 差异基因筛选与验证
结合FPKM 值定量估计所检测的基因表达值,以开产前泰州鹅肝脏组织为对照,开产后泰州鹅肝脏组织为试验组,获得检测基因的参考差异倍数(Fold change 值),进一步筛选|log2Fold change|≥1(P<0.05)的差异基因作为显著差异基因,根据差异基因的Fold change 对数值以及统计学显著程度绘制火山图(图2),以进一步获得开产前后泰州鹅肝脏组织差异基因表达水平的分布情况。最终筛选出202 个差异基因,其中上调差异表达基因100 个,下调差异表达基因102 个。

图 2 差异表达基因火山图Fig. 2 Volcano plot of differentially expressed genes
对上述筛选出的差异表达基因进行聚类分析(图3),开产前、后泰州鹅肝脏组织的3 个生物学重复各自聚类到了一起,而不同时间点的基因表达模式则出现分离,表明本试验所用样本生物学重复性较好,且样本的分组也较为合理。

图 3 差异表达基因热图聚类分析Fig. 3 Heat map of differentially expressed genes
为进一步了解每个差异表达基因的功能,通过En-semble、NCBI 以及Uniprot 数据库对差异表达基因进行综合注释,获得差异表达基因的详细描述信息。筛选泰州鹅开产前后肝脏组织差异基因表达最显著的TOP10 基因进行说明,结果见表4。为检验转录组测序技术筛选出的差异表达基因的表达量是否准确,随机筛选上述10 个差异表达基因中的CHRNA9、SLC13A5、MRAP、EPSTI1和TLDC2等5 个基因,并以β-actin为内参基因来进行qRT-PCR验证。qRTPCR 结果显示,上述5 个基因的表达规律与转录组测序获得的表达规律基本一致。所以转录组测序结果可信,可继续进行后续数据分析(图4)。

图 4 开产前后泰州鹅肝脏组织相关基因表达检测Fig. 4 Expressions of related genes in liver of Taizhou geese before and after start of egg-laying

表 3 转录组数据与参考基因组比对结果统计Table 3 Results of clean reads on sample vs. reference genome
2.4 差异基因GO 功能富集分析
为进一步了解差异表达基因的功能,通过GO(Gene Ontology,基因本体)数据库对筛选到的差异表达基因进行基因功能富集分类,包括细胞组分(Cellular component,CC)、生物过程(Biological process,BP)以及分子功能(Molecular function,MF)3 个方面(图5)。202 个显著差异基因进行GO 功能注释后,上述3 个功能分别被区分为5、18 和9 个功能亚类,共计42 个类别,详情如图4 所示。在CC 功能中,两组间的差异表达基因在细胞结构(Cell part)与膜结构(Membrane part)中所占比例最大;在BP 功能中,细胞过程(Cellular process)与生物调控(Biological regulation)富集到的差异基因数目最多。在MF 功能中,差异基因在结合功能(Binding)中所占的比例最高,催化活性(Catalytic activity)次之。

表 4 泰州鹅开产前、后肝脏组织上调/下调差异最大的前10 位基因Table 4 Top 10 upregulated and downregulated genes in Taizhou geese before and after start of egg-laying
2.5 差异基因KEGG 通路注释
为深入解析差异基因在泰州鹅开产前、后肝脏细胞活动过程中的作用,通过KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)的信号通路数据库对筛选获得的差异基因进行通路注释分析(P≤0.05),共获得202 个差异表达基因富集的信号通路,以差异富集值(Rich ratio≥1)进行筛选,共获得显著性富集的63 条差异信号通路(图6),文中列举出富集后最显著的前5 个通路以作示例说明(表5),包括:药物代谢-细胞色素P450(Drug metabolism-cytochrome P450)信号通路、氮代谢(Nitrogen metabolism)信号通路、戊糖和葡萄糖醛酸相互转化(Pentose and glucuronate interconversion)信号通路、视黄醇代谢(Retinol metabolism)信号通路以及类固醇激素生物合成(Steroid hormone biosynthesis)信号通路。

表 5 泰州鹅开产前、后肝脏组织富集显著性最显著的前5 条通路Table 5 Top 5 enriched pathways in liver of Taizhou geese before and after start of egg-laying

图 5 差异表达基因GO 注释Fig. 5 GO annotation on differentially expressed genes

图 6 KEGG 富集分析Fig. 6 KEGG enrichment on differentially expressed genes
3 讨论与结论
肝脏是禽类脂质合成的主要场所,约有超过90% 的脂肪是在禽类肝脏中合成的[19]。在性成熟时,家禽的肝脏会发生许多代谢活动以支持卵黄发生;在产蛋时期,家禽的肝脏脂质代谢活动会变得极为活跃,主要合成分泌极低密度脂蛋白(Very low density lipoprotein y, VLDLy)、 中 密 度 脂 蛋 白(Intermediate density lipoprotein, IDL)以及低密度脂蛋 白(Low density lipoprotein, LDL)[20−22]。其 中,VLDLy 可以直接到达卵母细胞的质膜中,通过膜上受体介导的内吞作用进入到卵母细胞,最终被卵母细胞吸收沉积,形成卵黄[23]。除此之外,肝脏也是生物机体最大、功能较多的腺体器官,参与胆汁分泌、激素合成等多项生理活动[24]。
转录组测序简称为RNA-Seq 技术,主要研究某一时间段内特定细胞在一种功能状态下转录出的所有RNA 的总和,是研究基因遗传图谱以及蛋白质生物信息功能的重要方法[18]。本研究通过RNA-Seq 技术对开产前、后的泰州鹅肝脏组织进行了差异表达基因筛选,并对其中的5 个基因进行了qRT-PCR 验证。上述筛选并验证的基因中,部分基因已有相关报道表明参与肝脏的脂质代谢过程。黑皮质素受体辅助蛋白(Melanocortin receptor accessory protein,MRAP)属于G 蛋白偶联受体家族中的一员,是一种含有跨膜域的小蛋白,影响着动物的生长、发育和代谢过程[25]。雌激素与鸡肝脏脂肪代谢过程密切相关,任俊晓等[26]研究表明,鸡肝脏中MRAP 的表达受到雌激素的调控,是雌激素在肝脏的重要靶基因之一。SLC13A5(Solute carrier family 13 member 5)是溶质载体家族成员,是一种钠偶联转运蛋白,可介导细胞对柠檬酸的吸收,从而脂肪酸和胆固醇合成中发挥着重要作用[27],小鼠SLC13A5 基因的敲除可有效抑制肝脏脂质的从头合成过程[28]。
在qRT-PCR 验证确保了测序结果可靠性的基础上,本试验结合GO 数据库对差异基因主要参与的生物学过程进行了分类,发现差异表达基因主要参与细胞结构、细胞过程以及结合功能等生物学过程。泰州鹅的开产意味着其已经开始性成熟并发生着其他重要的生理变化,肝脏是性成熟的重要因素。本试验通过差异基因GO 富集得到42 个生物学功能,综合分布于细胞组分、生物过程以及分子功能3 个亚类,由此可以看出,开产后泰州鹅的肝脏在生殖激素的刺激下发生了许多生理性和代谢变化,以适应自身生殖功能(产蛋)的需求。其中,生物过程中富集到了生殖过程与泰州鹅的产蛋性能密切相关,其在肝脏中的调控机制有待进一步研究。
为进一步分析差异表达基因功能,本试验继续结合KEGG 富集分析,筛选出65 个差异表达基因显著富集的信号通路,列举富集后最显著的前5 个通路,包括药物代谢-细胞色素P450 信号通路、氮代谢信号通路、戊糖和葡萄糖醛酸相互转化信号通路、视黄醇代谢信号通路以及类固醇激素生物合成信号通路。其中,视黄醇代谢信号通路参与胚胎发育、细胞增殖和分化、生殖生理等过程。视黄醇是维生素A 的活性衍生物,视黄醇在体内被进一步氧化为视黄酸(Retinoic Acid, RA)[29],在生物机体细胞内扩散并到达细胞核,组织中RA 的表达水平与视黄酸代谢酶细胞色素P450 密切相关[30],进一步表明RA 影响畜禽的生殖系统功能,尤其在减数分裂启动和性别分化中起到重要作用[31]。本试验筛选出的Top 5 信号通路中同时包含了药物代谢-细胞色素P450 信号通路和视黄醇代谢信号通路,表明在泰州鹅的开产期,上述2 条通路可能在肝脏中发挥着协同作用,是否参与此阶段泰州鹅的生殖调控过程还有待进一步验证。类固醇激素包括雌二醇、睾酮、黄体酮等,脂肪水解形成的胆固醇是类固醇激素形成的原材料,有研究表明类固醇激素能通过黄体类固醇激素受体直接参与生殖系统功能调节过程[32],可以调控卵泡生长,包括排卵前卵泡的发育和排卵[5],这些功能也应征了本试验筛选出的类固醇激素生物合成信号通路。综上所述,参与泰州鹅开产前后肝脏组织脂质代谢以及生殖过程相关的信号通路相互交织,组成了一个庞大复杂的细胞信号传导网络,其具体的功能和调节机制有待进一步研究。
本试验选取开产前、后泰州鹅肝脏组织进行RNA-Seq 测序分析,初步筛选出10 个差异表达基因以及5 条信号通路,可能参与泰州鹅开产前后肝脏的脂质代谢以及生殖过程调控。试验结果丰富了与泰州鹅开产相关的肝脏组织功能分析,为进一步研究泰州鹅肝脏的产蛋调控以及加速泰州鹅地方种群的进一步选育提供了新的数据支撑。
