长春西汀通过PI3K/AKT通路改善冠心病大鼠模型心肌氧化应激损伤的机制研究
2020-12-16谭安安陈晨
谭安安,陈晨
冠状动脉粥样硬化性心脏病(冠心病,CHD)与内源性物质的代谢异常密切相关,炎症和氧化应激反应亡引起的动脉粥样硬化(AS)是导致冠心病发生、发展的重要原因[1,2]。PI3K/AKT通路不仅具有调控细胞增殖、凋亡和行为的功能,也是重要的调控氧化应激反应和反应的通路,PI3K/AKT通路激活通过直接诱导其下游的血红素加氧酶-1(HO-1)的表达,消除活性氧(ROS)水平并抑制炎性细胞因子白介素-6(IL-6)和肿瘤坏死因子(TNF-α)等炎性因子的表达,缓解氧化应激反应[3,4]。研究显示提高CHD动物模型中的PI3K/AKT通路的水平可抑制氧化应激反应和炎性反应,保护心肌细胞。长春西汀是一种磷酸二酯酶(PDE)抑制剂,不但可调控AS的发生,还可调节生物电信号放松平滑肌细胞增加血流量[5]。最新研究显示长春西汀可缓解CHD并抑制炎性反应[6]。但关于长春西汀缓解CHD的机制仍不明确。本文主要通过研究长春西汀对CHD大鼠模型氧化应激反应和PI3K/AKT的影响,探究分子机制,为临床应用长春西汀治疗CHD,提供更好的理论依据。
1 材料与方法
1.1 实验试剂 SD大鼠(SPF级,雄性220~250 g,上海斯莱克实验动物中心,中国)。长春西汀(H20133334,遂成药业,中国)。SMT100V小动物自动生化分析仪(南京电子医疗器械厂,中国)。Hoechst 33258溶液试剂(Merck 公司,德国)。CCK-8和ELISA试剂盒(碧云天公司,中国)。酶标仪(Model 680,Bio-Rad,美国)。组织匀浆机(Thermo Fisher Scientific公司,美国)。TRIzol(Sigma公司,美国)。PrimeScript-RT和SYBR Premix Ex Taq试剂盒(Takara公司,日本)。RIPA裂解缓冲液(中国,北京,Beyotime)。BCA试剂盒(武汉博斯特生物技术有限公司,中国)。抗体购自美国Abcam公司。PVDF膜(Bio-Rad公司,美国)。DMEM培养基和抗体、血清(Invitrogen公司,美国)。显微镜和倒置荧光显微镜(Olympus公司,日本)。
1.2 分组和建模 30只SD大鼠分为对照组、CHD组和CHD+长春西汀组(每组n=10),根据文献构建CHD模型[7],自制高脂饲料持续喂养8周,高脂饲料在正常饲料中加入蛋黄粉(10%)、胆固醇(2%)、猪油(10%)、丙基硫氧嘧啶(0.2%)、胆酸钠(0.5%),30 g/d。对照组的10只大鼠应用正常饲料喂养,30 g/d。通过尾静脉收集血样,用SMT100V小动物自动生化分析仪检测三酰甘油(TG)和胆固醇(TC)和高密度脂蛋白胆固醇(LDL-C)验证建模结果。CHD+长春西汀组大鼠腹腔注射长春西汀,剂量为1.0 mg/kg[8],其余两组大鼠注射等量的生理盐水作为对照,连续7 d。
1.3 指标和方法
1.3.1 ELISA 应用ELISA检测心肌酶指标、炎性因子和内皮功能指标。大鼠麻醉后处死,采集心脏内的血液样本,离心(2000 rpm,20 min)后收集上层血清。根据试剂盒说明书分别加入抗体和显色剂,通过酶标仪检测450 nm处吸光度,根据标准曲线计算乳酸脱氢酶(LD)和肌酸激酶同工酶(CK-MB)的浓度,炎性因子IL-6和TNF-α的浓度,以及内皮功能指标内皮素-1(ET-1)和一氧化氮(NO)。
1.3.2 HE染色检测心肌细胞损伤 大鼠腹腔注射戊巴比妥后断头处死,取出心脏,收集结扎周围的心肌组织用4%的聚甲醛固定并用梯度醇脱水,包埋在石蜡中,制成厚度为4 μm的切片制作玻片标本。加入Mayer's苏木精在室温下赋孵育10 min,加入0.5%曙红溶液室温下孵育3 min,显微镜下观察。
1.3.3 氧化应激指标 将心肌组织制作成组织匀浆,以3000 rpm离心25 min,根据的速度氧化应激试剂盒(三工生物技术有限公司,中国)检测丙二醛(MDA)和超氧化物歧化酶(SOD)水品。
1.3.4 qPCR 使用Trizol获得心肌组织中总RNA,使用逆转录cDNA试剂盒逆转录1μg RNA用于合成cDNA(42℃ 60 min,70℃ 5 min,4℃保存)。使用SYBR Green PCR Master Mix和PCR检测系统进行qPCR实验(95℃/10 min,40个循环,94℃/15 s,60℃/1 min, 60℃/1 min,4℃保存)。使用GAPDH6作为内参,比较循环阈值(ΔΔCt)用于分析PI3K和AKT mRNA的水平表达。
1.3.5 Western blot 将心肌组织用匀浆机均匀研磨萃取总蛋白,通过BCA试剂盒测量浓度。
分别取总量为40 μg的总蛋白使用10%的聚丙烯酰胺凝胶进行电泳(PAGE)(80~120 V,90 min)。在100 mV的恒定电压下与PVDF膜进行湿转移。在5%牛血清白蛋白(BSA)中于室温孵育1 h。将1:500稀释的anti-PI3K和anti-AKT添加到分离的蛋白质中,4℃下孵育过夜。洗涤后在室温下添加二抗孵育1 h。加化学发光试剂显影。GAPDH用作内部参考。Image J软件分析目标条带灰度值。
1.4 统计学处理 统计分析使用SPSS 19.0软件。数据以平均值±标准偏差(SD)表示。多组间比较行单因素方差分析,两两比较用SNK-q检验。P<0.05,为差异有统计学意义。
2 结果
2.1 长春西汀对CHD模型大鼠血脂的影响 CHD组大鼠的TC(3.25±0.35)mmol/L、TG(1.36±0.14)mmol/L、LDL(1.89±0.27)mmol/L均高于对照组(P<0.05),CHD+长春西汀组的TC(2.64±0.31)mmol/L、TG(0.93±0.12)mmol/L、LDL(1.25±0.22)mmol/L水平高于对照组而低于CHD组(P<0.05),表1。

表1 长春西汀对CHD模型大鼠血脂的影响
2.2 长春西汀对CHD大鼠模型心肌酶指标的影响 CHD组大鼠的LD(2374.27±278.43 IU/L)与CK-MB(1264.44±142.53 IU/L)均高于对照组(P<0.05),CHD+长春西汀组LD(1804.93±271.36IU/L)和CK-MB(865.28±131.69IU/L)高于对照组而低于CHD组(P<0.05),表2。

表2 长春西汀对CHD大鼠模型心肌酶的影响
2.3 长春西汀对CHD大鼠模型炎性因子的影响 CHD组大鼠的IL-6(14.47±2.89)pg/ml和TNF-α(11.46±2.04)pg/ml均高于对照组(P<0.05),CHD+长春西汀组的IL-6(9.80±2.45)pg/ml和TNF-α(7.52±2.01)pg/ml水平高于对照组而低于CHD组(P<0.05),表3。

表3 长春西汀对CHD大鼠模型炎性因子的影响
2.4 长春西汀对CHD大鼠模型内皮功能的影响CHD组大鼠的ET-1(1.92±0.18 pg/ml)高于0.18 pg/ml)高于对照组而NO(30.75±6.73)μmol/L低于对照组(P<0.05)。CHD+长春西汀组的ET-1(1.59±0.16)pg/ml高于对照组低于CHD组,而NO(39.24±9.76)μmol/L低于对照组,而高于CHD组(P<0.05),表4。
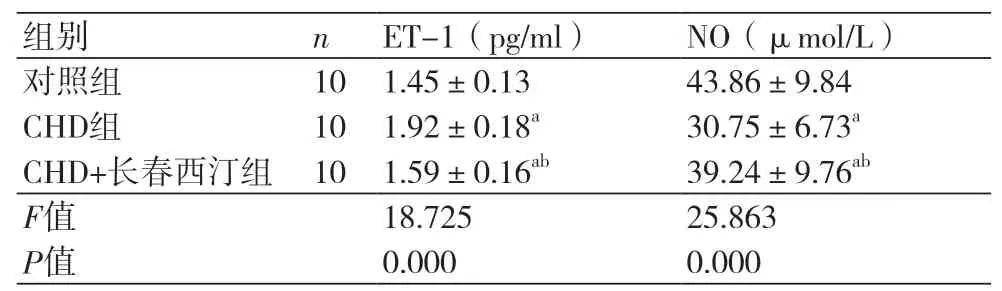
表4 长春西汀对CHD大鼠模型内皮功能的影响
2.5 长春西汀对CHD大鼠心肌组织损伤的影响对照组大鼠的心肌细胞成纤维状有序排列,细胞质和细胞核染色均匀,细胞核饱满;CHD组大鼠心肌细胞染色不均匀,排列紊乱;CHD+长春西汀组的心肌组织损伤情况较CHD组有所缓解,心肌细胞染色不均匀但排列有序。
2.6 长春西汀对CHD大鼠氧化应激指标的影响CHD组大鼠的MDA(10.56±1.06)nmol/ml高于对照组,SOD(116.84±10.64)U/ml低于对照组(P<0.05)。CHD+长春西汀组的MDA(5.93±0.55)nmol/ml显著高于对照组而低于CHD组,而SOD(158.59±12.18)U/ml低于对照组而高于CHD组(P<0.05)。
2.7 长春西汀对CHD大鼠PI3K和AKT mRNA的影响 PI3K和AKT mRNA水平(1.32±0.13,1.05±0.11)显著低于对照组(P<0.05),CHD+长春西汀组的PI3K和AKT mRNA水平(4.75±0.46,4.83±0.47)显著高于对照组和CHD组(P<0.05)。
2.8 长春西汀对CHD大鼠PI3K/AKT通路的影响PI3K和AKT蛋白水平(0.98±0.08,1.05±0.09)均显著低于对照组(P<0.05),CHD+长春西汀组的PI3K和AKT蛋白水平(3.42±0.32,3.36±0.31)高于对照组和CHD组(P<0.05),图1。

图1 Western blot检测长春西汀对CHD大鼠PI3K和AKT蛋白的影响
3 讨论
心血管疾病是全球死亡的主要原因[9]。AS引起的CHD以及相关的疾病是心血管疾病的最主要因素,包括血管腔狭窄、闭塞、心肌缺血、缺氧、坏死,心肌细胞的凋亡等[10]。
长春西汀是从毛竹毛叶中分离的一种半合成生物碱衍生物,通过抑制Na+通道和清除羟自由基来缓解氧化应激反应和细胞代谢[11-14]。AS不但是CHD的关键发病诱因,也是中风等脑血管疾病的主要机制之一,国内研究显示长春西汀对脑供血不足合并CHD病情起到缓解作用[15]。本次研究结果显示长春西汀可明显降低血脂指标,还可抑制炎性反应,从而提高血管内皮功能,保护心肌细胞。提示长春西汀可能通过清除ROS、抑制炎性反应保护血管内皮细胞,提高冠脉供血,缓解心肌细胞损伤,起到治疗CHD的作用。
氧化应激起因于ROS的产生与抗氧化剂机制清除之间的不平衡,机体具有抗氧化防御机制,该机制由抗氧化剂分子(如谷胱甘肽)和酶(如SOD等)组成,以应对氧化应激。在生物分子中,脂质易受到氧化应激,多不饱和脂肪酸和LDL等脂质是主要目标,AS也是引起ROS的病理基础之一[16]。氧化应激水平受到PI3K/AKT通路的调控,PI3K/AKT会通过调控NF-κB或Wnt等途径提高SOD的表达抑制氧化应激反应[17]。本研究结果显示长春西汀可在mRNA和蛋白的水平上显著抑制CHD大鼠心肌组织中PI3K/AKT通路,并抑制MDA和促进SOD的表达。研究显示长春西汀通过抑制NF-κB通路和诱导Nrf2/ARE通路抑制氧化应激反应[18]。在脑缺血/再灌注动物中,长春西汀对PI3K/AKT起到诱导作用,并抑制炎性反应保护神经损伤[19]。提示在CHD大鼠模型中,长春西汀通过诱导PI3K/AKT的表达抑制机体的氧化应激反应,不仅能保护冠脉内皮细胞功能提高心肌血供,还能抑制炎性反应,缓解心肌细胞损伤。
综上所述,长春西汀可能通过促进PI3K/AKT通路抑制氧化应激反应和炎性反应,从而保护血管内皮功能和缓解心肌组织损伤,对CHD大鼠模型起缓解作用。但关于长春西汀调控PI3K/AKT通路的分子机制需进一步分析,疗效仍需临床研究验证。
