肌原纤维蛋白对挥发性风味物质吸附作用研究进展
2020-12-14高子武王恒鹏吴鹏屠明亮吴丹璇孟祥忍
高子武 王恒鹏 吴鹏 屠明亮 吴丹璇 孟祥忍


摘 要:蛋白质对挥发性风味物质的吸附作用一定程度上决定着食品风味品质。肌原纤维蛋白功能特性的变化会直接影响其对肉制品主效风味成分的吸附能力,因此对肌原纤维蛋白功能特性的影响因素进行深入研究对明晰肌原纤维蛋白与挥发性风味物质相互作用机制具有重要意义。本文就肌原纤维蛋白对挥发性风味物质的吸附机制、影响因素、研究技术与方法进行综述,详细介绍肌原纤维蛋白、挥发性风味成分以及多种外界因素对肌原纤维蛋白与挥发性风味物质相互作用影响的研究现状,并对肌原纤维蛋白对挥发性风味物质吸附作用研究尚未深入发掘的领域进行展望,为探究肌原纤维蛋白风味吸附作用在肉制品加工领域的生产应用提供理论参考。
关键词:肌原纤维蛋白;挥发性风味;吸附作用;影响因素;技术方法
Abstract: The adsorption of volatile flavor compounds by proteins determines the flavor quality of food to a certain extent. Changes in the functional properties of myofibrillar proteins will directly affect the adsorption ability of myofibrillar protein for the major flavor components of meat products. Thus, gaining insights into the factors affecting the functional properties of myofibrillar proteins is important for understanding the mechanism of the interaction between myofibrillar proteins and volatile flavor compounds. In this paper, the mechanism of and the factors influencing the adsorption of volatile flavor compounds by myofibrillar proteins, as well as the methods and techniques used in recent research in this regard are reviewed. It summarizes the current status of research on the effects of myofibrillar proteins, volatile flavor components and various external factors on the interaction between myofibrillar proteins and volatile flavor compounds, and presents problems that have yet to be addressed in this research area, which will provide a theoretical rationale for applying the adsorption of flavor compounds by myofibrillar proteins in the field of meat processing.
Keywords: myofibrillar protein; volatile flavor; adsorption; factors; techniques and methods
DOI:10.7506/rlyj1001-8123-20200810-191
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2020)09-0105-08
引文格式:
高子武, 王恒鹏, 吴鹏, 等. 肌原纤维蛋白对挥发性风味物质吸附作用研究进展[J]. 肉类研究, 2020, 34(9): 105-112. DOI:10.7506/rlyj1001-8123-20200810-191. http://www.rlyj.net.cn
GAO Ziwu, WANG Hengpeng, WU Peng, et al. Recent progress in research on the adsorption of myofibrillar proteins for volatile flavor compounds[J]. Meat Research, 2020, 34(9): 105-112. DOI:10.7506/rlyj1001-8123-20200810-191. http://www.rlyj.net.cn
风味是消费者评价肉制品食用品质的关键因素[1]。一般肉制品中含有多种挥发性风味物质,如醛、酮、醇、酯、酸、烷烃、吡嗪、吡啶、含硫化合物等[2]。肉制品中风味化合物的含量及种类受肉的来源、组成、添加剂、加工条件等因素的影响而有所差异,食品组分与风味化合物的相互作用也较大程度影响产品的整体风味感知[3]。
肌肉蛋白是肉类食品的重要组分之一,在人体膳食营养中不可或缺,肌肉蛋白对肉制品感官品质、营养组成和质构特性具有重要影响。对于调控肉制品的风味品质而言,肌肉蛋白吸附与释放风味化合物的程度至关重要[4]。肌原纤维蛋白是构成肌肉蛋白的主要成分,其必需氨基酸的含量和种类十分丰富,很大程度上决定着肉制品的品质特性[5]。目前,国内外关于肌原纤维蛋白对风味化合物吸附作用的研究尚处于初始阶段,在测定风味吸附能力的过程中,确定肌原纤维蛋白风味吸附实验的较优参数及建立标准化测定方法还有待深入研究。研究肌原纤维蛋白对风味化合物的吸附机制,对进一步优化实验参数及确立测定方法具有鲜明指导作用。本文系统梳理肌原纤维蛋白与肉制品主要挥发性风味化合物相互作用的相关研究,就肌原纤维蛋白对挥发性风味物质的吸附机制、影响因素、现有的研究技术方法进行综述,以期为今后肉类加工产业改善肉制品风味品质提供参考。
1 肌原纤维蛋白组成及其风味吸附作用机制
1.1 肌原纤维蛋白组成
肌原纤维蛋白是肌肉中含量最高的蛋白质,约占肌肉蛋白总量的55%~65%[6]。按照肌原纤维蛋白的构成可分为三大类[7],如表1所示。
肌原纤维蛋白既是一种具有生物学功能的盐溶性结构蛋白群,也是肌肉中收缩肌纤维的重要组成[8]。在加工和贮藏过程中,肌原纤维蛋白结构和组分的完整性对肉制品凝胶性、保水性、乳化性以及肌原纤维蛋白的风味吸附能力等有很大影响,进而造成肉制品质构特性和风味品质的差异。
1.2 肌原纤维蛋白风味吸附作用机制
肌原纤维蛋白对挥发性风味物质的吸附能力受多种因素影响,就其吸附一种风味化合物而言,这些影响因素大都可归于蛋白质结合位点的变化。风味化合物结合位点的变化又与肌原纤维蛋白结构、蛋白与蛋白之间以及肌原纤维蛋白与其他物质之间的相互作用密切相关[9]。
肌原纤维蛋白中氨基酸侧链种类繁多,且能与不同种类的挥发性风味化合物发生可逆结合,而维持这种可逆结合的作用力主要取决于蛋白质疏水性、巯基、二硫键含量、二级结构及静电相互作用等功能特性[10]。肌原纤维蛋白的功能特性受许多外界因素的影响,如温度、壓力、pH值、金属离子、蛋白浓度及氧化体系等均会对其功能特性有很大影响[11],现有研究围绕肌原纤维蛋白风味吸附机制主要有以下3 种学说:1)Shen Hui[6]、Lou Xiaowei[12]等研究认为,主要是通过改变肌原纤维蛋白构象,引起结合位点的包埋或暴露,造成肌原纤维蛋白对风味吸附能力的差异;2)Zhou Feibai[13]、Pérez-Juan[14]等研究认为,增强/削弱蛋白-蛋白相互作用,进而影响蛋白与风味化合物之间的相互作用;3)Wang Ying[15]、Sun Weizheng[16]等研究认为,外来添加物竞争性结合风味化合物的结合位点,影响肌原纤维蛋白对风味化合物的吸附。
2 肌原纤维蛋白风味吸附能力的影响因素
肌原纤维蛋白风味吸附能力的强弱取决于肌原纤维蛋白和挥发性风味物质自身性质及外界因素的共同作用。肌原纤维蛋白的组分、质量浓度,挥发性风味化合物的种类、分子结构以及热处理、盐、pH值、氧化体系、改性方式、其他食品添加物等外界因素均会影响肌原纤维蛋白对挥发性风味物质的吸附作用。
2.1 肌原纤维蛋白
2.1.1 肌原纤维蛋白组分
肌动蛋白和肌球蛋白是肌原纤维蛋白的重要组成部分。肌球蛋白约占肌原纤维蛋白总量的43%,是粗丝的主要成分,每根粗丝约含有300 个肌球蛋白分子[17]。球状的G-肌动蛋白和纤维状的F-肌动蛋白是肌动蛋白存在的2 种主要状态,且含量略低于肌球蛋白,总占比约为20%[14]。大量研究表明,肌原纤维蛋白中的G-肌动蛋白与肌球蛋白对挥发性风味物质的吸附能力存在差异。其中,Pérez-Juan等[8]发现,干腌火腿中的G-肌动蛋白和肌球蛋白主要与分配系数较小的风味成分结合,但G-肌动蛋白也吸附了分配系数较大的3-甲基-丁醛;L? Tong等[18]测定不同胰蛋白酶含量对肌球蛋白结构及醛、酮类物质吸附能力的影响时发现,肌球蛋白发生水解增加了挥发性化合物的保留率,同时随着胰蛋白酶含量的增加,醛、酮类物质吸附量增加;Cao Changchun等[19]发现,不同浓度的H2O2影响G-肌动蛋白中α-螺旋、羰基、氢键、巯基及疏水位点的变化,进而引起其对醇、醛吸附能力的差异,且聚集的G-肌动蛋白容易与芳香化合物发生疏水相互作用,形成蛋白质-芳香化合物复合物,从而增强其结合能力。
2.1.2 肌原纤维蛋白质量浓度
肌原纤维蛋白质量浓度是影响肌原纤维蛋白吸附挥发性风味成分能力强弱的关键因素,但相关机制尚未完全阐明。周昌瑜等[20]建立不同质量浓度鸭肉肌原纤维蛋白对醛、酮、酯、醇类等17 种风味化合物的吸附体系,研究发现,蛋白质对风味化合物的吸附能力随着蛋白质质量浓度的增加发生变化,但质量浓度过高时对风味物质的吸附作用有所减弱,可能是肌原纤维蛋白质量浓度的增加使其自身表面张力减小,从而造成挥发性风味物质释放所致;Oneill等[21]用滴体积法测定肌原纤维蛋白在空气-溶剂界面的表面活性,发现初始体相质量浓度10-4~10-2 g/100 mL时,肌原纤维蛋白能够有效抑制自身表面张力的形成。虽然部分学者认为挥发性风味物质决定风味保留值的大小,但实际上风味保留值也会随蛋白质质量浓度的增加而增大。此外,结合常数、风味成分与蛋白质的相互作用以及风味作用位点与蛋白质二级结构结合位点的相互作用也随蛋白质质量浓度的变化而变化。
2.2 挥发性风味物质
2.2.1 种类
现有研究表明,肌原纤维蛋白对不同风味物质的吸附能力存在差异,这与风味物质的碳链长度、沸点、分支程度和特殊官能团密切相关[22]。肌原纤维蛋白对醇、醛、酮、酯类化合物的吸附研究已被陆续报道,醇、醛、酮、酯类是典型的风味化合物,肌原纤维蛋白对它们的吸附能力强弱为:醛类>酯类>酮类>醇类,且肌原纤维蛋白对醛类的吸附作用显著强于其他3 种化合物[23]。但目前仍缺乏对其他种类风味成分(如烷烃、吡嗪、吡啶、含硫化合物)与肌原纤维蛋白相互作用的系统研究。
2.2.2 分子结构
风味化合物分子结构的不同可以导致肌原纤维蛋白对风味化合物吸附能力的差异。就同类风味化合物来说,分子质量越大,碳链越长,分子疏水性越强,蛋白对其的疏水性结合能力也越强,吸附效率越高[24];相反,分子体积越大的化合物,其空间位阻效应越明显,越难进入蛋白分子内部的结合位点,造成吸附效率偏低[25]。Jasinski等[26]研究表明,β-乳球蛋白上有14 个2-壬酮结合位点,蛋白质结构的伸展导致结合位点数增加,但造成肌原纤维蛋白发生伸展的原因尚不明晰;Hansen[27]、Lou Xiaowei[12]等在研究蛋白质对酮类风味化合物吸附作用时均发现,蛋白质对酮类化合物的吸附能力随碳原子数的增加而增强;Han Zhong等[28]研究构象变化的典型肉味化合物(壬醛)与牛肌原纤维蛋白的风味结合机理,发现壬醛与肌原纤维蛋白相互作用对其构象无明显影响,随着温度的升高,结合常数和结合位点数有所增大;申辉[29]研究碳链长度、酮基位置和数量、支链有差异的酮类化合物与肌原纤维蛋白相互作用的影响机制时发现,由于2,3-戊二酮含有更多酮基,2,3-戊二酮淬灭肌原纤维蛋白荧光的效率显著高于2-戊酮和3-戊酮,且随着碳链的增长,蛋白质与长链酮之间产生较强的疏水相互作用,从而提高了同系物酮的Stern-Volmer淬灭常数(Ksv)。
2.3.5 改性方式
肉制品中肌原纤维蛋白的结构状态对其风味品质具有决定性作用[48]。肌原纤维蛋白的功能特性与其结构直接相关,肌原纤维蛋白结构的变化间接影响其对风味化合物的吸附能力。但肉制品加工过程中,有些肌原纤维蛋白的功能特性无法满足实际生产需求,因此需要通过物理、化学等方法对其进行相应的改性,从而形成产品的独特风味。目前有关肌原纤维蛋白风味吸附的研究中,常用的蛋白改性技术主要包括超声波、微波、辐照等,这些技术具有操作简单、便于控制、耗时短等优点。Jo等[49]对制备好的肌原纤维蛋白进行不同剂量辐照处理,结果表明,肉及肉制品经辐射处理后风味会发生改变,这与辐照处理后蛋白质结构的改变有关;蔡梦洁[50]研究发现,微波处理能够有效增强肌原纤维蛋白对醛、酮类风味化合物的吸附能力,肌原纤维蛋白吸附4 种酮类化合物的能力最大的是2-壬酮,其次是2-辛酮,对4 种醛类物质吸附能力的大小顺序依次为壬醛、庚醛、己醛和3-甲硫基丙醛;胡可等[51]以不同关键加工环节中西式火腿的肌原纤维蛋白为研究对象,探究其结构和风味吸附能力的变化,发现在腌制、真空滚揉和斩拌环节,肌原纤维蛋白荧光峰、最大紫外吸收峰、酰胺A、B带及酰胺Ⅲ带均发生位移,氨基酸所处的微环境向有利于风味吸附的极性环境转变;Han Zhong等[28]比较微波和水浴2 种加工方式下牛肉肌原纤维蛋白对酮类化合物吸附能力的区别,结果表明,随着微波或水浴处理时间的延长,肌原纤维蛋白的总巯基含量和表面疏水性增加,且微波的热效应主导了肌原纤维蛋白的结构变化,与水浴加热相比,微波的非热效应对肌原纤维蛋白的结构也有明显影响,从而影响酮类风味化合物的保留和释放。
2.3.6 其他食品成分的添加
谷氨酰胺酶(transglutaminase,TGase)在肌原纤维蛋白的交联反应中起催化作用[52-54]。TGase催化交联的网状结构一定程度上可以减少游离氨基酸等风味前体物的损失,在后续加工生产中风味前体物转化为挥发性风味物质,从而突出呈现产品的主效特征风味[52],因此凝胶网络交联程度一定意义上决定着风味物质的扩散与释放程度[53]。Tsevdou等[54]認为,氨是TGase交联蛋白过程中的主要挥发性成分,影响交联食品的风味,但在牛乳中单独加入TGase并不能显著改善其风味,而在高静压技术灭菌后,其风味明显改善,这可能是由于TGase与高静压发生协同作用使一些活性位点暴露。
此外,在加工过程中肌原纤维蛋白的过度氧化可能会损伤其功能特性及安全性,进而破坏肉制品的食用口感和营养品质。拥有独特结构的多酚不仅天然无毒,而且还具备抗氧化及抑菌等特性,因而在抑制肌原纤维蛋白氧化、减缓肉制品品质劣变等方面被广泛应用[55]。Jongberg等[56]研究发现,牛肉肌原纤维蛋白中巯基含量随着多酚类物质的添加而降低,液相色谱-质谱分析结果显示有“巯基-醌”加成物的形成;Zeng Zicong等[57]研究发现,多酚经过60、80、100 ℃热处理后含量减少,总抗氧化活性降低,其转化为醌类的能力降低,进而影响蛋白质与多酚的共价相互作用。
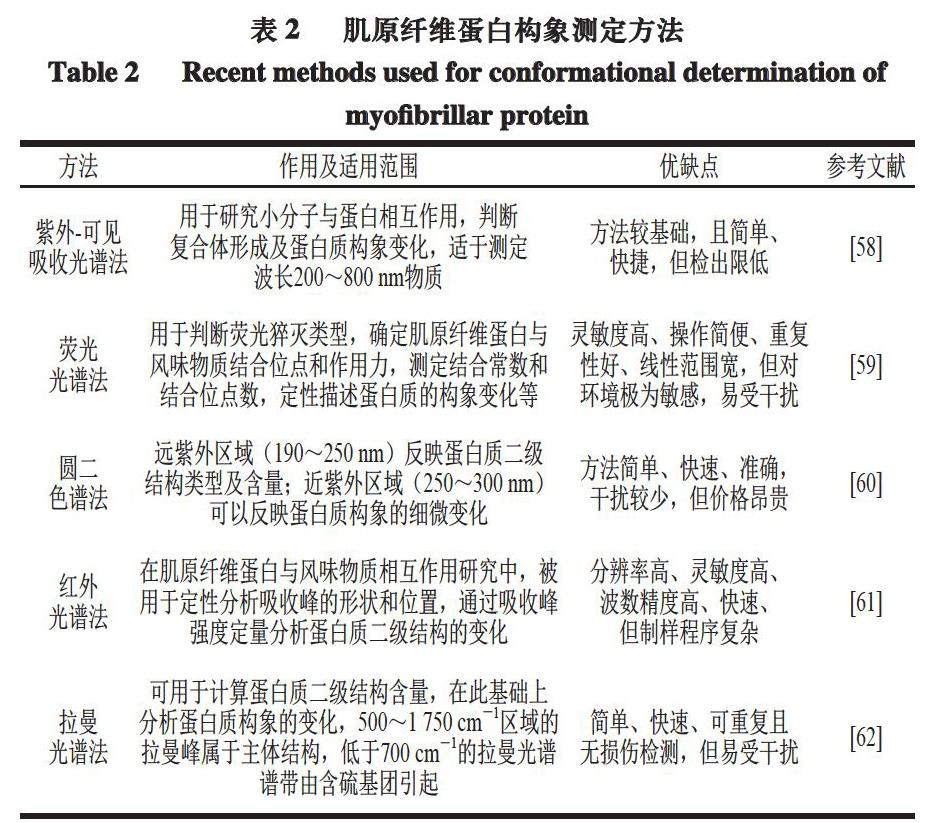
3 肌原纤维蛋白构象及风味吸附的研究方法
3.1 肌原纤维蛋白构象测定方法
肌原纤维蛋白构象的改变会引起蛋白质与风味化合物结合位点的包埋或暴露,进而造成肌原纤维蛋白对风味化合物吸附能力的不同。根据现有相关文献总结了常用的肌原纤维蛋白构象测定方法,如表2所示。
3.2 肌原纤维蛋白风味吸附分析方法
目前,静态顶空固相微萃取气相色谱-质谱联用法已成为大多数学者研究肌原纤维蛋白对挥发性风味成分吸附能力时最为常用的方法。此外,也有部分研究将平衡透析技术、大气压化学电离串联质谱法、三维定量构象和分子模型用于分析肌原纤维蛋白对挥发性风味化合物的吸附作用,如表3所示。
4 结 语
肌原纤维蛋白对挥发性风味物质的吸附作用既取决于二者自身性质,如肌原纤维蛋白的组分、质量浓度及风味物质的种类、分子结构等,同时也受热处理、盐、pH值、氧化体系、改性方式、其他添加物等诸多外界因素的影响,其作用机制还未被系统、明确地阐明。探究肌原纤维蛋白风味吸附作用机制是更好改善肉制品风味品质的理论基础,因此,肌原纤维蛋白对挥发性风味物质的作用规律是一个复杂且有实际价值的研究。目前,关于肌原纤维蛋白风味吸附的探讨在以下几方面尚有较大深入挖掘的空间:1)不同风味化合物之间可能存在竞争或协同性吸附,当前对醛、酮、含硫类、杂环类等风味化合物之间的竞争或协同性结合机制的研究较为缺乏;2)可以将鼻腔风味分析、唾液的口腔模拟及建立风味化合物分子特性对蛋白质风味吸附作用数学模型等新分析方法应用于肌原纤维蛋白风味吸附研究;3)在肉制品加工及贮藏过程中,蛋白质会发生一定程度降解,研究肌原纤维蛋白在不同降解阶段或加工阶段对特定化合物的吸附作用对于实际生产中改善产品风味有重要意义;4)现阶段的研究主要集中在单一的蛋白溶液或凝胶体系中肌原纤维蛋白与挥发性风味成分的相互作用,但全组分肌肉体系才是肌原纤维蛋白所处的真实环境,因此,在全组分肌肉体系中研究其对风味化合物的吸附与释放具有更重要的应用价值。
参考文献:
[1] BREWER M S. Natural antioxidants: sources, compounds, mechanisms of action, and potential applications[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(4): 221-247. DOI:10.1111/j.1541-4337.2011.00156.x.
[2] 张骞, 冯平, 杨海花. 不同加工方式的肉制品中香味物质的形成机制与提取[J]. 食品与发酵工业, 2019, 45(14): 270-276. DOI:10.13995/j.cnki.11-1802/ts.019783.
[3] 劉士健. 壳聚糖与盐溶蛋白对风味化合物吸附能力及其凝胶特性研究[D]. 重庆: 西南大学, 2008: 28-30.
[4] K?HN J, CONSIDINE T, SINGH H. Interactions of milk proteins and volatile flavor compounds: implications in the development of protein foods[J]. Journal of Food Science, 2006, 71(5): 72-82. DOI:10.1111/j.1750-3841.2006.00051.x.
[5] 康大成. 超声波辅助腌制对牛肉品质的影响及其机理研究[D]. 南京: 南京农业大学, 2017: 77-78.
[6] SHEN Hui, HUANG Mingquan, ZHAO Mouming, et al. Interactions of selected ketone flavours with porcine myofibrillar proteins: the role of molecular structure of flavour compounds[J]. Food Chemistry, 2019, 298: 125060. DOI:10.1016/j.foodchem.2019.125060.
[7] DU Xueli, DU Cuihong, LIU Guangming, et al. Effect of a myofibril-bound serine proteinase on the deg of giant protein titin and nebulin[J]. Journal of Food Biochemistry, 2010, 34(3): 581-594. DOI:10.1111/j.1745-4514.2009.00300.x.
[8] P?REZ-JUAN M, FLORES M, TOLDR? F. Model studies on the efficacy of protein homogenates from raw pork muscle and dry-cured ham in binding selected flavor compounds[J]. Journal of Agricultural and Food Chemistry, 2006, 54(13): 4802-4808. DOI:10.1021/jf060374x.
[9] ZHANG Ziye, YANG Yuling, ZHOU Peng, et al. Effects of high-pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217: 678-686. DOI:10.1016/j.foodchem.2016.09.040.
[10] TROY D J, KERRY J P. Consumer perception and the role of science in the meat industry[J]. Meat Science, 2010, 86(1): 216-226. DOI:10.1016/j.meatsci.2010.05.009.
[11] BOYER C, JOANDEL S, OUALI A, et al. Determination of surface hydrophobicity of fast and slow myosins from rabbit skeletal muscles: implication in heat-induced gelation[J]. Journal of the Science of Food and Agriculture, 1996, 72(3): 367-375. DOI:10.1002/(SICI)1097-0010(199611)72:3<367::AID-JSFA668>3.0.CO;2-D.
[12] LOU Xiaowei, YANG Qiuli, SUN Yangying, et al. The effect of microwave on the interaction of flavour compounds with G-actin from grass carp (Catenopharyngodon idella)[J]. Journal of the Science of Food and Agriculture, 2017, 97(12): 3917-3922. DOI:10.1002/jsfa.8325.
[13] ZHOU Feibai, ZHAO Mouming, ZHAO Haifeng, et al. Effects of oxidative modification on gel properties of isolated porcine myofibrillar protein by peroxyl radicals[J]. Meat Science, 2014, 96(4): 1432-1439. DOI:10.1016/j.meatsci.2013.12.001.
[14] P?REZ-JUAN M, FLORES M, TOLDR? F. Binding of aroma compounds by isolated myofibrillar proteins: effect of protein concentration and conformation [J]. Food Chemistry, 2007, 105(3): 932-939. DOI:10.1016/j.foodchem.2007.04.051.
[15] WANG Ying, JIANG Yating, CAO Jinxuan, et al. Study on lipolysis-oxidation and volatile flavour compounds of dry-cured goose with different curing salt content during production[J]. Food Chemistry, 2016, 190: 33-40. DOI:10.1016/j.foodchem.2015.05.048.
[16] SUN Weizheng, ZHAO Qiangzhong, ZHAO Mouming, et al. Structural evaluation of myofibrillar proteins during processing of Cantonese sausage by Raman spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11070-11077. DOI:10.1021/jf202560s.
[17] YANG Fang, JIA Shengnan, LIU Jixuan, et al. The relationship between degradation of myofibrillar structural proteins and texture of superchilled grass carp (Ctenopharyngodon idella) fillet[J]. Food Chemistry, 2019, 301: 125278. DOI:10.1016/j.foodchem.2019.125278.
[18] L? Tong, WANG Ying, PAN Daodong, et al. Effect of trypsin treatments on the structure and binding capacity of volatile compounds of myosin[J]. Food Chemistry, 2017, 214: 710-716. DOI:10.1016/j.foodchem.2016.07.115.
[19] CAO Changchun, XIE Jianchuan, HOU Li, et al. Effect of glycine on reaction of cysteine-xylose: insights on initial Maillard stage intermediates to develop meat flavor[J]. Food Research International, 2017, 99(6): 444-453. DOI:10.1016/j.foodres.2017.06.012.
[20] 周昌瑜, 蔣娅婷, 曹锦轩, 等. 肌原纤维蛋白浓度对风味物质吸附能力的影响[J]. 核农学报, 2016, 30(5): 904-911. DOI:10.11869/j.issn.100-8551.2016.05.0904.
[21] ONEILL T E, KINSELLA J E. Binding of alkanone flavors to beta-lactoglobulin: effects of conformational and chemical modification[J]. Journal of Agricultural and Food Chemistry, 1987, 35(5): 770-774. DOI:10.1021/jf00077a030.
[22] WANG K, ARNTFIELD S D. Binding of carbonyl flavours to canola, pea and wheat proteins using GC/MS approach[J]. Food Chemistry, 2014, 157: 364-372. DOI:10.1016/j.foodchem.2014.02.042.
[23] 周昌瑜, 蒋娅婷, 曹锦轩, 等. 热处理时间对鸭肉肌原纤维蛋白凝胶的风味吸附能力影响[J]. 现代食品科技, 2016, 32(3): 218-224. DOI:10.13982/j.mfst.1673-9078.2016.3.035.
[24] CAO Jinxuan, ZHOU Changyu, WANG Ying, et al. The effect of oxidation on the structure of G-actin and its binding ability with aroma compounds in carp grass skeletal muscle[J]. Food Chemistry, 2018, 240: 346-353. DOI:10.1016/j.foodchem.2014.02.042.
[25] KUN W, ARNTFIELD S D. Binding of selected volatile flavour mixture to salt-extracted canola and pea proteins and effect of heat treatment on flavour binding[J]. Food Hydrocolloids, 2015, 43: 410-417. DOI:10.1016/j.foodhyd.2014.06.011.
[26] JASINSKI E, KILARA A. Flavor binding by whey proteins[J]. Milchwisschaft, 1985, 40(10): 596-599. DOI:10.1016/j.foodhyd.2014.06.011.
[27] HANSEN A P, HEINIS J J. Benzaldehyde, citral, and D-limonene flavor perception in the presence of casein and whey proteins[J]. Journal of Dairy Science, 1992, 75(5): 1211-1215. DOI:10.3168/jds.S0022-0302(92)77869-2.
[28] HAN Zhong, CAI Mengjie, CHENG Hujun. Effects of microwave and water bath heating on the interactions between myofibrillar protein from beef and ketone flavour compounds[J]. International Journal of Food Science and Technology, 2019, 54(5): 1787-1793. DOI:10.1111/ijfs.14079.
[29] 申辉. 猪肉肌原纤维蛋白与特定风味化合物的相互作用机制研究[D]. 广州: 华南理工大学, 2019: 54-56. DOI:10.27151/d.cnki.ghnlu.2019.000276.
[30] ZHAO Di, HE Jing, ZOU Xiaoyu, et al. Influence of hydrothermal treatment on the structural and digestive changes of actomyosin[J]. Journal of the Science of Food and Agriculture, 2019, 99(14): 6209-6218. DOI:10.1002/jsfa.9893.
[31] 康怀彬, 邹良亮, 张慧芸, 等. 高温处理对牛肉蛋白质化学作用力及肌原纤维蛋白结构的影响[J]. 食品科学, 2018, 39(23): 80-86. DOI:10.7506/spkx1002-6630-201823013.
[32] 吕彤, 林俊杰, 周昌瑜, 等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报, 2016, 32(8): 285-291. DOI:10.11975/j.issn.1002-6819.2016.08.040.
[33] XU Yongxia, WANG Rui, ZHAO Honglei, et al. Binding of aldehydes to myofibrillar proteins as affected by two-step heat treatments[J]. Journal of the Science of Food and Agriculture, 2020, 100(3): 1195-1230. DOI:10.1002/jsfa.10130.
[34] 李敬, 杨媛媛, 赵青余, 等. 肉风味前体物质与风味品质的关系研究进展[J]. 中国畜牧杂志, 2019, 55(11): 1-7. DOI:10.19556/j.0258-7033.20190330-05.
[35] 张杰, 唐善虎, 李思宁, 等. 加热温度对牦牛肉肌原纤维蛋白与葡萄糖或果糖美拉德反应挥發性成分的影响[J]. 食品工业科技, 2018, 39(7): 222-231. DOI:10.13386/j.issn1002-0306.2018.07.040.
[36] FLORES M, GIANELLI M, P?REZ-JUAN M, et al. Headspace concentration of selected dry-cured aroma compounds in model systems as affected by curing agents[J]. Food Chemistry, 2007, 102(2): 488-493. DOI:10.1016/j.foodchem.2006.04.011.
[37] GUICHARD E. Flavour retention and release from protein solutions[J]. Biotechnology Advances, 2006, 24(2): 226-229. DOI:10.1016/j.biotechadv.2005.11.003.
[38] VENTANAS S, MUSTONEN S, EERO PUOLANNE E, et al. Odour and flavour perception in flavoured model systems: influence of sodium chloride, umami compounds and serving temperature[J]. Food Quality and Preference, 2010, 21(5): 453-462. DOI:10.1016/j.foodqual.2009.11.003.
[39] XIONG YoulingL.. Role of myofibrillar proteins in water-binding in brine-enhanced meats[J]. Food Research International, 2005, 38(3): 281-287. DOI:10.1016/j.foodres.2004.03.013.
[40] 韩裕睿. 氧化环境中代钠盐处理对肌原纤维蛋白凝胶特性和风味吸附作用的影响[D]. 广州: 华南理工大学, 2018: 7-9.
[41] 楼宵玮, 蒋娅婷, 潘道东, 等. 氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J]. 食品科学, 2017, 38(5): 74-79. DOI:10.7506/spkx1002-6630-201705012.
[42] P?REZ-JUAN M, FLORES M, TOLDR? F. Effect of pork meat proteins on the binding of volatile compounds[J]. Food Chemistry, 2008, 108(4): 1226-1233. DOI:10.1016/j.foodchem.2007.04.037.
[43] SHEN Hui, ZHAO Mouming, SUN Weizheng. Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds[J]. Food Chemistry, 2019, 287: 93-99. DOI:10.1016/j.foodchem.2019.02.060.
[44] GIANELLI M P, FLORES M, TOLDR? F. Interaction of soluble peptides and proteins from skeletal muscle with volatile compounds in model systems as affected by curing agents[J]. Journal of Agricultural and Food Chemistry, 2005, 53(5): 1670-1677. DOI:10.1021/jf040357c.
[45] 余娱乐. pH调节法制备兔肉分离蛋白及其性质研究[D]. 重庆: 西南大学, 2018: 11-13.
[46] SHEN Hui, STEPHEN ELMORE J, ZHAO Mouming, et al. Effect of oxidation on the gel properties of porcine myofibrillar proteins and their binding abilities with selected flavour compounds[J]. Food Chemistry, 2020, 329: 127032. DOI:10.1016/j.foodchem.2020.127032.
[47] LUO Ji, NASIRU M M, YAN Wenjing, et al. Effects of dielectric barrier discharge cold plasma treatment on the structure and binding capacity of aroma compounds of myofibrillar proteins from dry-cured bacon[J]. LWT-Food Science and Technology, 2019, 117: 108606. DOI:10.1002/ffj.3365.
[48] CAI Mengjie, GUO Zhiwei, XING Guoqiang, et al. Transcranial direct current stimulation improves cognitive function in mild to moderate Alzheimer disease: a Meta-analysis[J]. Alzheimer Disease and Associated Disorders, 2019, 33(2): 170-178. DOI:10.1097/wad.0000000000000304.
[49] JO C, AHN D U. Production of volatile compounds from irradiated oil emulsion containing amino acids or proteins[J]. Journal of Food Science, 2000, 65(4): 612-616. DOI:10.1111/j.1365-2621.2000.tb16059.x.
[50] 蔡夢洁. 恒功率微波处理牛肉肌原纤维蛋白对风味物质吸附能力研究[D]. 广州: 华南理工大学, 2019: 19-21.
[51] 胡可, 常瑞, 朱秋劲, 等. 西式火腿关键加工环节对肌原纤维蛋白结构及风味吸附能力的影响[J]. 食品与发酵工业, 2020, 46(6): 163-169. DOI:10.13995/j.cnki.11-1802/ts.022756.
[52] TOMASZ L, GREGG K R, XIONG Y L. Polyphosphate and myofibrillar protein extract promote transglutaminase-mediated enhancements of rheological and textural properties of PSE pork meat batters[J]. Meat Science, 2017, 128(6): 40-46. DOI:10.1016/j.meatsci.2017.02.002.
[53] 王武, 任志偉, 张静, 等. 食用胶对鸭肉脯保藏期间挥发性风味物质变化的研究[J]. 中国食品添加剂, 2012(1): 97-106. DOI:10.3969/j.issn.1006-2513.2012.01.010.
[54] TSEVDOU M, SOUKOULIS C, CAPPELLIN L, et al. Monitoring the effect of high pressure and transglutaminase treatment of milk on the evolution of flavour compounds during lactic acid fermentation using PTR-TOF-MS[J]. Food Chemistry, 2013, 138(4): 2159-2167. DOI:10.1016/j.foodchem.2012.12.007.
[55] UTRERA M, MORCUENDE D, ESTEVEZ M. Temperature of frozen storage affects the nature and consequences of protein oxidation in beef patties[J]. Meat Science, 2014, 96: 1250-1257. DOI:10.1016/j.meatsci.2013.10.032.
[56] JONGBERG S, LUND M N, WATERHOUSE A L, et al. 4-methylcatechol inhibits protein oxidation in meat but not disulfide formation[J]. Journal of Agricultural and Food, 2011, 59(18): 10329-10335. DOI:10.1021/jf202268q.
[57] ZENG Zicong, HU Xiuting, MCCLEMENTS D J, et al. Hydrothermal stability of phenolic extracts of brown rice[J]. Food Chemistry, 2019, 271: 114-121. DOI:10.1016/j.foodchem.2018.07.180.
[58] GUO Zhiyong, KONG Zhijie, WEI Yanshan, et al. Effects of gene carrier polyethyleneimines on the structure and binding capability of bovine serum albumin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2017, 173: 783-791. DOI:10.1016/j.saa.2016.10.026.
[59] 张莉, 刘倩倩, 吴长玲, 等. 多酚与蛋白质相互作用研究方法进展[J]. 食品工业科技, 2018, 39(24): 340-345. DOI:10.13386/j.issn1002-0306.2018.24.058.
[60] ADITY B. Interaction of tea polyphenols with serum albumins: a fluorescence spectroscopic analysis[J]. Journal of Luminescence, 2016, 169: 220-226. DOI:10.1016/j.jlumin.2015.09.018.
[61] TANG Bin, HUANG Yanmei, MA Xiangling, et al. Multispectroscopic and docking studies on the binding of chlorogenic acid isomers to human serum albumin: effects of esteryl position on affinity[J]. Food Chemistry, 2016, 212: 434-442. DOI:10.1016/j.foodchem.2016.06.007.
[62] 刘畅, 孟庆翔, 周振明. 拉曼光谱技术在肉品质评价中的应用[J]. 中国畜牧杂志, 2017, 53(2): 10-14. DOI:10.19556/j.0258-7033.2017-02-010.
[63] ZHOU Feibai, ZHAO Mouming, SU Guowan, et al. Binding of aroma compounds with myofibrillar proteins modified by a hydroxyl-radical-induced oxidative system[J]. Journal of Agricultural and Food Chemistry, 2014, 62(39): 9544-9552. DOI:10.1021/jf502540p.
[64] GUO Juan, HE Zhiyong, WU Shengfang, et al. Binding of aromatic compounds with soy protein isolate in an aqueous model: effect of pH[J]. Journal of Food Biochemistry, 2019, 43(10): e12817. DOI:10.1111/jfbc.12817.
[65] VIRY O, BOOM R M, AVISON S, et al. A predictive model for flavor partitioning and protein-flavor interactions in fat-free dairy protein solutions[J]. Food Research International, 2018, 109: 52-58. DOI:10.1016/j.foodres.2018.04.013.
[66] BATONNETPICHON S, BEHIN A, CABET E, et al. Myofibrillar myopathies: new perspectives from animal models to potential therapeutic approaches[J]. Journal of Neuromuscular Diseases, 2017, 4(1): 1-15. DOI:10.3233/JND-160203.
