高危型人乳头瘤病毒感染与阴道微生态及宫颈局部细胞免疫的关系
2020-12-14黄敏敏印志法秦新蕾
黄敏敏 印志法 秦新蕾
[摘要] 目的 探究高危型人乳頭瘤病毒(HR-HPV)感染与阴道微生态及宫颈局部细胞免疫的关系。 方法 选择2017年2月—2019年8月于连云港市第二人民医院(以下简称“我院”)诊治的160例人乳头状瘤病毒(HPV)感染患者,根据患者是否伴有HR-HPV感染分为85例非HR-HPV组和75例HR-HPV组。同时选择同期在我院进行体检的80名健康妇女作为对照组。采用酶化学反应法对阴道微生态进行检测,采用荧光探针杂交捕获技术检测HPV-DNA,采用流式细胞技术检测白细胞分化抗原3+(CD3+)、白细胞分化抗原4+(CD4+)和白细胞分化抗原8+(CD8+)阳性细胞比例。比较各组阴道微生态发生率、阴道菌群分布和T淋巴细胞亚群分布。 结果 HR-HPV患者以单一型HPV感染患者为主,其中又以HPV16、18和HPV33为主。HR-HPV组阴道微生态失调发生率高于非HR-HPV组和对照组,而非HR-HPV组阴道微生态失调发生率高于对照组(P < 0.05)。HR-HPV组和非HR-HPV组的乳酸杆菌异常、细菌性阴道炎、衣原体、解脲脲原体及滴虫菌群阳性率均明显高于对照组(P < 0.05)。HR-HPV组的乳酸杆菌异常、衣原体菌群阳性率均明显高于非HR-HPV组(P < 0.05)。HR-HPV组CD3+、CD4+及CD4+/CD8+均低于非HR-HPV组和对照组,而非HR-HPV组CD3+、CD4+及CD4+/CD8+均低于对照组(P < 0.05);HR-HPV组CD8+高于非HR-HPV组和对照组,而非HR-HPV组CD8+高于对照组(P < 0.05)。 结论 HR-HPV感染会引起阴道微生态严重失调,同时导致患者阴道菌群分布紊乱加剧以及T淋巴细胞亚群数量进一步减少,导致患者病情恶化。
[关键词] 高危型人乳头瘤病毒;阴道微生态;细胞免疫;阴道菌群;T淋巴细胞
[中图分类号] R711 [文献标识码] A [文章编号] 1673-7210(2020)10(c)-0118-05
Relationship between high risk human papillomavirus infection and vaginal microecology and cervical local cellular immunity
HUANG Minmin1 YIN Zhifa2 QIN Xinlei1
1.Department of Gynecology, the Second People′s Hospital of Lianyungang, Jiangsu Province, Lianyungang 222023, China; 2.Department of Stomatology, the Second People′s Hospital of Lianyungang, Jiangsu Province, Lianyungang 222023, China
[Abstract] Objective To explore the relationship between high risk human papillomavirus (HR-HPV) infection and vaginal microecology and cervical local cellular immunity. Methods One hundred and sixty patients with human papillomavirus (HPV) infection treated in the Second People′s Hospital of Lianyungang (“our hospital” for short) from February 2017 to August 2019 were divided into non HR-HPV group (85 cases) and HR-HPV group (75 cases) according to whether the patients were accompanied with HR-HPV infection. At the same time, 80 healthy women who had physical examination in our hospital at the same time were selected as control group. The vaginal microecology was detected by enzyme chemical reaction method, HPV-DNA was detected by fluorescence probe hybridization capture technology, and the proportion of positive cells of leukocyte differentiation antigen 3+ (CD3+), leukocyte differentiation antigen 4+ (CD4+) and leukocyte differentiation antigen 8+ (CD8+) were detected by flow cytometry. The incidence of vaginal microecology, the distribution of vaginal flora and the distribution of T lymphocyte subsets among groups were compared. Results HR-HPV patients were mainly single type of HPV infection, and HPV16, 18 and HPV33 were the main types. The incidence of vaginal microecological disorder in HR-HPV group was higher than that in non HR-HPV group and control group, while that in non HR-HPV group was higher than that in control group (P < 0.05). The positive rates of Lactobacillus abnormality, bacterial vaginitis, Chlamydia, Ureaplasma urealyticum and trichomonas in HR-HPV group and non HR-HPV group were significantly higher than those in control group (P < 0.05). The positive rates of Lactobacillus and Chlamydia in HR-HPV group were significantly higher than those in non HR-HPV group (P < 0.05). CD3+, CD4+ and CD4+/CD8+ in HR-HPV group were lower than those in non HR-HPV group and control group, while CD3+, CD4+ and CD4+/CD8+ in non HR-HPV group were lower than those in control group (P < 0.05). CD8+ in HR-HPV group was higher than that in non HR-HPV group and control group, while CD8+ in non HR-HPV group was higher than that in control group (P < 0.05). Conclusion HR-HPV infection can cause serious imbalance of vaginal microecology, increase the distribution of vaginal flora and further reduce the number of T-lymphocyte subsets, resulting in the deterioration of patients′ condition.
[Key words] High risk human papillomavirus; Vaginal microecology; Cellular immunity; Vaginal flora; T lymphocyte
女性当中普遍存在人乳头瘤病毒(HPV)感染,约有8%的患者会逐渐发展成为宫颈癌以及宫颈癌前病变[1]。HPV感染是宫颈癌发病的主要危险因素,并且尤其以高危型人乳头瘤病毒(HR-HPV)感染为主,70%~80%的宫颈癌发病与HR-HPV感染相关[2]。女性的阴道是由免疫系统、阴道菌群和阴道生理性结构共同组成的微生态系统,在抑制炎症反应和抵抗外部病原菌感染等过程中均起到关键作用[3]。HR-HPV感染往往会引起患者的阴道微生态紊乱,导致患者的局部免疫功能障碍和阴道菌群失调,进而诱发宫颈癌和宫颈癌前病变的发生[4-5]。本研究探究HR-HPV感染对阴道微生态及宫颈局部细胞免疫的影响,现报道如下:
1 资料与方法
1.1 一般资料
选择2017年2月—2019年8月于江苏省连云港市第二人民医院(以下简称“我院”)诊治的160例HPV感染患者,年龄28~52岁,平均(42.08±6.72)岁;有分娩史患者121例,无分娩史患者39例;产次0~2次,平均(2.18±0.62)次;有口腔黏膜病变9例,无口腔黏膜病变151例。根据患者是否伴有HR-HPV感染分为85例非HR-HPV组和75例HR-HPV组。纳入标准:①经HPV-DNA检测、TCT检测和阴道镜活检确诊为HPV感染;②月经周期规律;③近2个月内未接受过抗病毒治疗以及抗生素治疗。排除标准:①存在宫颈手术史;②合并恶性肿瘤;③存在严重肝肾功能损伤;④存在全身性感染性疾病;⑤3 d内有性生活。同时选择同期在我院进行健康体检的80名健康妇女作为对照组,年龄29~50岁,平均(41.52±6.96)岁;有分娩史妇女57名,无分娩史妇女23名;产次0~2次,平均(2.38±0.96)次。各组年龄、产次和分娩史等一般资料比较,差异无统计学意义(P > 0.05),具有可比性。患者签署知情同意书,研究经我院医学伦理委员会同意。
1.2 方法
1.2.1 临床检测样本采集 常规消毒处理后,取膀胱截石位,采用窥阴器使患者的阴道和宫颈口充分暴露。使用棉拭子刮取部分阴道内侧分泌物于试管中,后续用于阴道微生态检测。使用棉拭子于宫颈口旋转刮取3圈并将其浸没于保存液中,-80℃冻存,后续用于HPV检测。使用宫颈采样刷于柱上皮-阴道后穹隆交界处刮取样本,采集结束后将宫颈采样刷浸没于生理盐水中,后续用于宫颈T淋巴细胞亚群检测。
1.2.2 阴道微生态检测 采用酶化学反应法对阴道微生态进行检测,使用阴道微生态检测试剂盒(山东仕达思生物产业有限公司,货号:YDLV-6884,规格:100T)进行检测,pH检测蓝色为阳性,黄色为阴性。过氧化氢检测不显色为阳性,显色为阴性。白细胞酯酶显色为阳性,不显色为阴性。唾液酸苷酶显色为阳性,不显色为阴性。以上4项指标均为阴性则阴道微生态正常,若有1项指标为阳性则阴道微生态失调。同时对滴虫、解脲脲原体和衣原体等阴道菌群分布情况进行检测。
1.2.3 HR-HPV检测 采用荧光探针杂交捕获技术对HPV-DNA进行检测,使用HR-HPV DNA检测试剂盒(美国凯杰科技有限公司,货号:5199-1220)对HPV DNA的基因型进行检查,HR-HPV基因型包括HPV16、18、31、33、35、39、45、51、52、56、58、59、66和HPV68。
1.2.4 T淋巴细胞亚群检测 生理盐水经5000 r/min离心20 min后弃去上清液,离心半径13 cm,使用500 μL磷酸盐缓冲液将细胞沉淀重悬,充分吹散后使用流式细胞分析仪(美国贝克曼库尔特科技有限公司,型号BK6081)检测白细胞分化抗原3+(CD3+)、白细胞分化抗原4+(CD4+)和白细胞分化抗原8+(CD8+)阳性细胞比例,并计算CD4+/CD8+比值。
1.3 统计学方法
采用SPSS 20.0统计学软件对数据进行分析。计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。计数资料采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 HR-HPV患者HPV感染类型分布情况分析
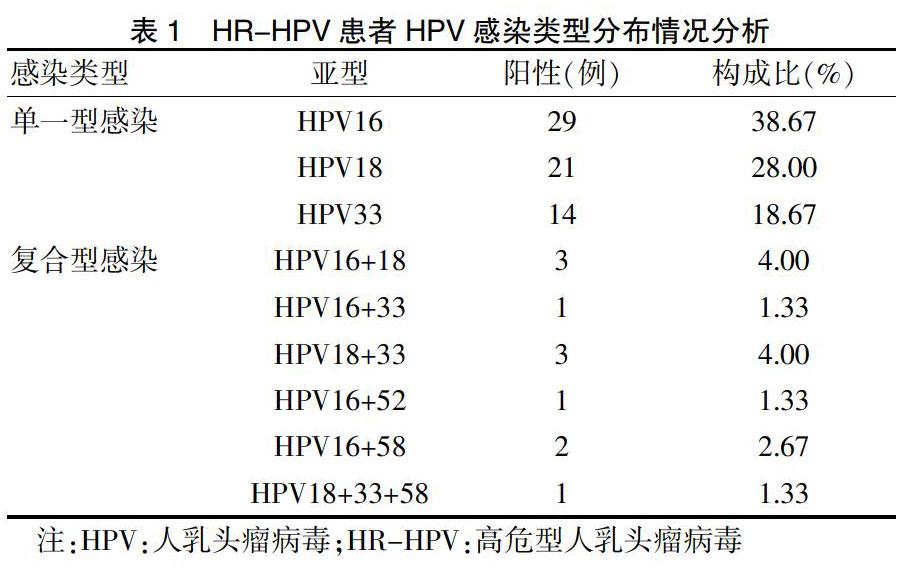
HR-HPV患者共计75例,以单一型HPV感染患者为主,其中又以HPV16、18和HPV33为主,而复合型HPV感染患者占比较少。见表1。
2.2 各组阴道微生态失调发生率比较
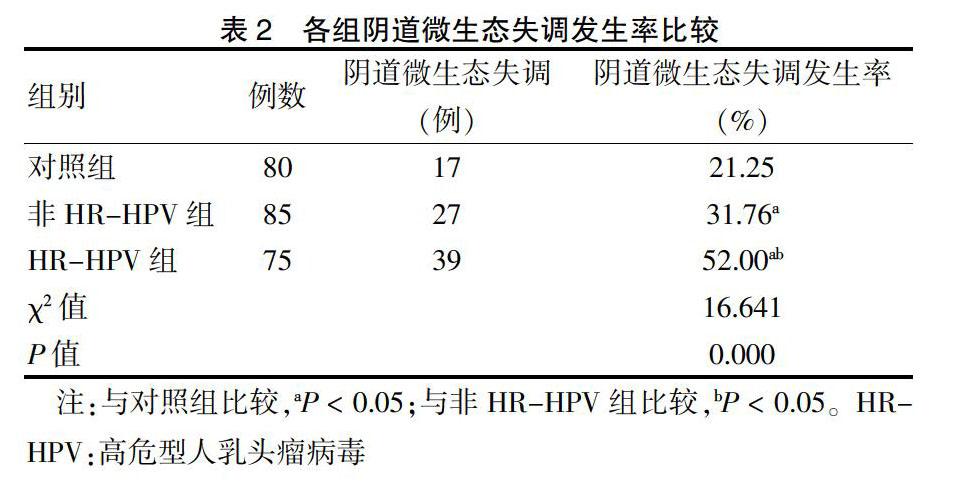
HR-HPV组阴道微生态失调发生率高于非HR-HPV组和对照组,而非HR-HPV组阴道微生态失调发生率高于对照组(P < 0.05)。见表2。
2.3 各组阴道菌群阳性率比较
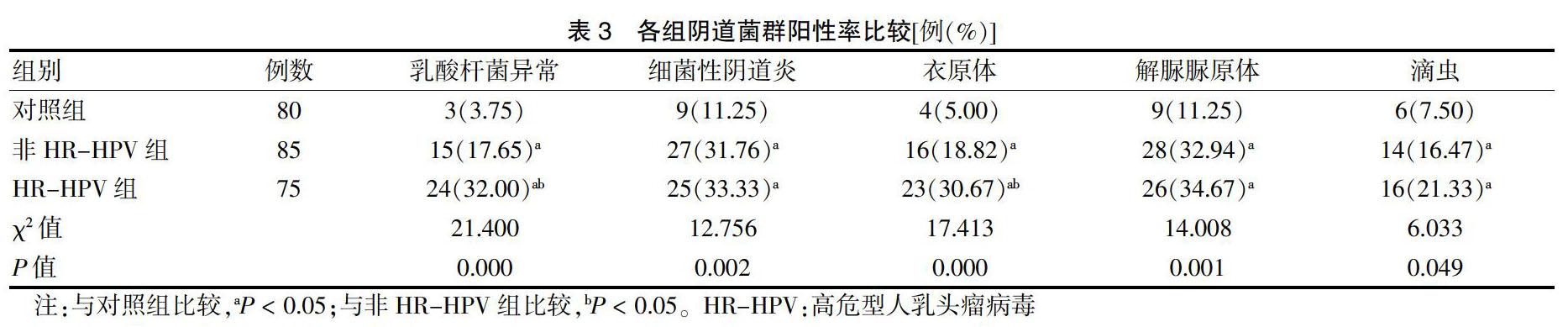
HR-HPV组和非HR-HPV组的乳酸杆菌异常、细菌性阴道炎、衣原体、解脲脲原体及滴虫菌群阳性率均明显高于对照组(P < 0.05)。HR-HPV组的乳酸杆菌异常、衣原体菌群阳性率均明显高于非HR-HPV组(P < 0.05)。见表3。
2.4 各组T淋巴细胞亚群分布情况比较
HR-HPV組CD3+、CD4+及CD4+/CD8+均低于非HR-HPV组和对照组,而非HR-HPV组CD3+、CD4+及CD4+/CD8+均低于对照组(P < 0.05);HR-HPV组CD8+高于非HR-HPV组和对照组,而非HR-HPV组CD8+高于对照组(P < 0.05)。见表4。
3 讨论
阴道微生态平衡对于女性生殖系统健康极为重要,能够有效隔绝外界病原微生物的感染[6]。HR-HPV感染会造成阴道微生态严重紊乱,与宫颈癌、阴道炎和宫颈癌前病变等一系列生殖系统疾病的发生相关[7-9]。阴道菌群分布以及阴道免疫功能是阴道微生态的两个重要组成部分,参与形成阴道微生态[10-11]。目前对HR-HPV感染对阴道菌群分布以及阴道免疫功能的影响仍然缺乏了解,需要进一步深入探究。
HPV的增殖存在复杂的病毒复制周期,不同的HPV病毒复制能力存在較大差异,其中HR-HPV的复制能力较强,更容易引起肿瘤病变的发生[12-15]。Graham[16]的研究对200种以上的HPV病毒复制周期进行研究,发现不同HPV病毒的感染存在组织特异性,并且HR-HPV的感染性明显高于非HR-HPV。本研究发现,HPV感染患者以单一型感染为主,且以HPV16、18和HPV33为主。可能是由于HPV感染能够活化阴道局部细胞中的丝氨酸/苏氨酸激酶(AKT)和信号转导与转录激活因子5(STAT5)等信号通路,从而能够在一定程度上活化机体的免疫功能,进而对后续感染的HPV病毒产生一定排斥作用,导致HPV感染主要以单一型感染为主[17-18]。同时,由于不同病毒在机体内的复制能力存在一定差异,复制能力较强的HPV16、18和HPV33病毒逐渐占据优势,使患者的HPV类型主要以HPV16、18和HPV33为主[19]。研究发现,HR-HPV组和非HR-HPV组的各阴道菌群阳性率均明显高于对照组,而HR-HPV组部分阴道菌群阳性率高于非HR-HPV组。实验结果提示,HPV感染会促进阴道微生物的繁殖,导致阴道微生物菌群分布紊乱,同时HR-HPV感染会进一步加剧这一情况,导致阴道微生态的严重失调。可能是由于HR-HPV感染会引起阴道微环境发生改变,使阴道pH值和免疫功能的改变更有利于微生物的繁殖[20-21],一方面会引起原有的阴道菌群发生改变,导致阴道菌群结构发生紊乱[22];另一方面,外界的病原微生物繁殖加快,促进阴道炎和宫颈炎等生殖系统炎症的发生,进一步诱发宫颈癌的发生[23]。研究结果发现,HR-HPV组阴道T淋巴细胞亚群数量的广泛下降,说明HR-HPV感染会导致患者局部免疫功能下降。可能是由于HR-HPV病毒的E5蛋白会抑制免疫细胞中的AKT信号通路的活化,进而抑制抗原呈递和细胞因子分泌等免疫反应,导致机体的免疫功能抑制[24-25]。同时,HR-HPV能够抑制干扰素信号通路的活化,进而抑制免疫细胞产生干扰素和T淋巴细胞的活化,导致患者T淋巴细胞亚群数量的广泛减少[26-27]。
综上所述,HR-HPV感染以单一型感染为主,HPV类型主要以HPV16、18和HPV33为主。HR-HPV感染会进一步加剧患者阴道微生态失调,导致阴道菌群分布紊乱加剧以及T淋巴细胞亚群数量进一步下降,导致病情恶化。临床检测HR-HPV感染患者的阴道菌群和免疫功能有助于HR-HPV感染的防治,从而减少宫颈癌的发生。
[参考文献]
[1] 高燕,张志军,梁文通,等.人乳头瘤病毒多重感染与宫颈病变的相关性研究[J].中华医院感染学杂志,2016,26(17):4041-4043.
[2] 朱晓华,张晓兰,卢锦,等.高危型人乳头状瘤病毒配合液基波层细胞学检查在宫颈癌早期癌前病变筛查中的应用价值分析[J].中国卫生检验杂志,2019,29(12):1502-1505.
[3] 宋建东,宋静慧,乔峤,等.阴道微生态及阴道免疫状态与宫颈病变相关性研究[J].中国妇产科临床杂志,2019, 20(6):510-513.
[4] 杨惠霞,韩肖燕,林宇庚,等.高危型人乳头瘤病毒与宫颈病变的相关性分析[J].中国医刊,2020,55(1):68-71.
[5] 林琳,傅亚均,林安平.高危型HPV感染与宫颈癌前病变及宫颈癌的关系[J].癌症进展,2019,17(14):1713-1715,1721.
[6] 张旭梅,李芹,柳露,等.阴道微生态与高危型HPV感染和宫颈病变的关系[J].中国妇幼保健,2018,33(8):65-67.
[7] Zhang C,Liu Y,Gao W,et al. The direct and indirect association of cervical microbiota with the risk of cervical intraepithelial neoplasia [J]. Cancer Med,2018,7(5):2172-2179.
[8] 甘露,刘瑞,魏明,等.绝经后妇女612例宫颈HPV感染与宫颈病变关系的临床研究[J].陕西医学杂志,2018,47(5):32-34.
[9] 寿坚,吴鹏,张淑珍,等.宫颈脱落细胞HPV E6/E7mRNA检测与宫颈癌变的相关性[J].中国妇幼保健,2019,34(14):3172-3175.
[10] Blitshteyn S,Brinth L,Hendrickson JE,et al. Autonomic dysfunction and HPV immunization:an overview [J]. Immunol Res,2018,66(6):744-754.
[11] Qin C,Luo G,Luo X,et al. Analysis of the artificial vaginal microecology in patients after laparoscopic peritoneal vaginoplasty [J]. Sci Rep,2019,9(1):8482.
[12] 吴海燕,肖琳,周琴,等.成都北部地区女性人乳头瘤病毒感染特征分析[J].成都医学院学报,2019,14(3):393-396.
[13] 罗锦彬,张桂花,陈旭华.17236例女性受检者HPV基因分型分析[J].检验医学与临床,2018,15(23):133-135.
[14] 桂芳,黄娟,阳大庆,等.HPV感染对宫颈免疫微环境的影响[J].中国医药导报,2019,16(13):163-166.
[15] 涂梅.人乳头瘤病毒感染与阴道微生态环境的相关性研究[J].中国医药科学,2019,9(4):96-99.
[16] Graham SV. The human papillomavirus replication cycle,and its links to cancer progression:a comprehensive review [J]. Clin Sci(Lond),2017,131(17):2201-2221.
[17] Gupta S,Kumar P,Das BC. HPV:molecular pathways and targets [J]. Curr Probl Cancer,2018,42(2):161-174.
[18] Zhang W,Hong S,Maniar KP,et al. KLF13 regulates the differentiation-dependent human papillomavirus life cycle in keratinocytes through STAT5 and IL-8 [J]. Oncogene,2016,35(42):5565-5575.
[19] Bordignon V,Di Domenico EG,Trento E,et al. How human papillomavirus replication and immune evasion strategies take advantage of the host DNA damage repair machinery [J]. Viruses,2017,9(12):390.
[20] 马丹, 周淑芬,张珺,等.宫颈HR-HPV感染患者阴道微环境中IL-17、IL-23、IL-6、TGF-β水平变化及意义[J].山东医药,2019,59(13):77-80.
[21] 钟阳青,陈艳清,肖翔,等.阴道微环境改变与高危型人乳头瘤病毒感染的相关性[J].检验医学与临床,2018, 15(13):98-100.
[22] 黄艳艳,沈琳,朱爱琴.宫颈高危型人乳头瘤病毒感染患者的阴道微生态分析[J].重庆医学,2019,48(5):886-888.
[23] 李姝庆,张阳阳,伊艳茹,等.阴道微生态菌群与宫颈疾病相关性的研究进展[J].国际妇产科学杂志,2020,47(2):223-226.
[24] de Freitas AC,de Oliveira THA,Barros MR Jr,et al. hrHPV E5 oncoprotein:immune evasion and related immunotherapies [J]. J Exp Clin Cancer Res,2017,36(1):71.
[25] 胡國敏,冯丽君,王立锋.高危型HPV感染与阴道微生态及宫颈局部细胞免疫相关性研究[J].陕西医学杂志,2019,48(11):1447-1449,1528.
[26] 林丽,李喜梅,毛郁蕾,等.高危型人乳头瘤病毒持续感染患者阴道菌群与宫颈局部免疫功能改变[J].中国微生态学杂志,2019,31(5):564-566.
[27] Habiger C,J?覿ger G,Walter M,et al. Interferon kappa inhibits human papillomavirus 31 transcription by inducing Sp100 proteins [J]. J Virol,2015,90(2):694-704.
(收稿日期:2020-03-02)
[基金项目] 江苏省自然科学基金项目(BK2016813)。
[作者简介] 黄敏敏(1978.6-),女,副主任医师;研究方向:妇科肿瘤。
[通讯作者] 印志法(1976.7-),男,主任医师;研究方向:口腔面膜病。
