高通量测序分析黑土稀有微生物群落结构
2020-12-14关健飞曹阳
关健飞 曹阳

摘要:稀有微生物群落作为地球生态系统中的重要组成部分,在土壤生态系统中扮演着超比例的角色。以黑龙江省黑土中稀有微生物为研究对象,采用高通量测序技术分析黑土中稀有细菌、真菌群落结构组成及其与土壤理化性质的相关性。对属水平上稀有微生物群落进行分析发现,相对丰度在0.01%以下的稀有细菌菌属420种,稀有真菌菌属210种,各采样点处稀有微生物类群分布差异性较大,存在特征稀有微生物类群,但未见黑土共有稀有菌属的检出。总磷和有效磷的含量分别影响不同种类的稀有细菌菌属,其中放线孢菌属(Actinomycetospora)与总磷含量呈现极显著正相关关系,无色杆菌属(Achromobacter)与有效磷含量呈现极显著正相关关系。真菌稀有菌群中的小孢霉属(Microbotryum)、顶孢霉属(Acremonium)等与土壤含水率、有机质含量、总氮含量、硝态氮含量呈现极显著正相关关系。
关键词:稀有微生物;群落结构;高通量测序;黑土;理化性质
中图分类号: S154.3 文献标志码: A 文章编号:1002-1302(2020)20-0288-05
微生物作为土壤生态系统的重要组成部分,在维持生态系统功能和服务过程中起着关键作用[1]。现阶段对于土壤微生物的研究主要集中在物种组成、结构功能以及遗传多样性等方面。土壤中的微生物群落具有典型的物种丰度分布偏斜特征,表现为相对高丰度的少量优势物种与相对低丰度的大量稀有物种共存[2],稀有群落作为地球生态系统中至关重要的组成部分,在土壤生态系统中扮演着超比例的角色[3],是微生物群落功能的一个潜在驱动力[4],稀有微生物群落是评价微生物多样性的重要因素,是微生物遗传和功能多样性的存储库,具有驱动地球化学循环[5-6]、指示环境变化[7-8]、降解污染物[9-10]、稳定群落结构[11]等重要功能。然而相对于优势类群,现阶段对于稀有微生物类群的研究较少[12]。本研究以黑龙江省黑土为研究对象,解析土壤中稀有细菌和真菌的群落结构组成,分析稀有微生物群落与土壤理化性质的相关性,为稀有微生物的生态学研究奠定基础。1 材料与方法
1.1 土壤样品采集
本研究以黑龙江省表层(0~20 cm)黑土为研究对象,在黑龙江省区域内设置10个采样点(图1),于2019年5月进行土壤样品采集。土壤样品采集过程中去除细根等杂物后,充分混匀,置于密封袋,带回实验室后,-80 ℃保存土壤样品用于高通量测试分析,常温风干土壤样品用于理化性质测定。
1.2 高通量测序
采用Illumina MiSeq测序平台对测序样本进行双端测序,委托上海美吉生物医药科技有限公司完成。测序过程中,采用E.Z.N.A. Soil DNA Kit提取试剂盒(Omega Bio-tek,Norcross,GA,U.S.)提取土壤总DNA。采用细菌16S rRNA基因V3-V4区引物515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)对高变区片段进行扩增,PCR反应条件为95 ℃预变性3 min;27次循环(95 ℃变性30 s,55 ℃退火 30 s,72 ℃延伸45 s);72 ℃延伸10 min,10 ℃保存。20 μL反应体系为4 μL的5×FastPfu Buffer,2 μL的2.5 mmol/L dNTPs,0.8 μL的Forward Primer(5 μmol/L),0.8 μL的Reverse Primer(5 μmol/L),0.4 μL的FastPfu Polymerase,0.2 μL的BSA,10 ng的Template DNA,补ddH2O至20 μL。真菌18S rDNA的V5-V7区引物SSU0817F(5′-TTAGCATGGAATAATRRAATAGGA-3′)和1196R(5′-TCTGGACCTGGTGAGTTTCC-3′)对高变区片段进行扩增,PCR反应条件为90 ℃预变性3 min;37次循环(95 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸45 s);72 ℃延伸10 min,10 ℃保存。20 μL反应体系为 4 μL的5×FastPfu Buffer,2 μL的2.5 mmol/L dNTPs,0.8 μL的Forward Primer(5 μmol/L),0.8 μL 的Reverse Primer(5 μmol/L),0.4 μL的FastPfu Polymerase,0.2 μL的BSA,10 ng的Template DNA,补ddH2O至20 μL。利用QuantiFluorTM-ST微型荧光计进行PCR产物检测定量。测序数据经过barcode拆分后获得的有效序列信息统计,使用Qiime2软件中的DADA2插件对所有样品的全部原始序列进行质量控制、去噪、拼接并且去嵌合体,形成OTU。
1.3 土壤理化性质测定
土壤含水率的测定采用真空烘箱法;pH值的测定采用电位法;有机质含量的测定采用重铬酸钾滴定法;全氮含量的测定采用半微量开氏法;全磷含量的测定采用氢氧化钠碱融-钼锑抗比色法;全钾含量的测定则采用火焰光度法;硝态氮含量采用连续流动分析仪法进行测定;有效磷含量采用钼锑抗比色法进行测定,其中酸性土壤使用氟化铵-盐酸作为浸提剂,碱性土壤使用碳酸氢钠作为浸提剂;速效钾含量则使用乙酸铵浸提-火焰光度计测定,每个土壤样品测3次取平均值记录,用于后续试验数据的分析。
1.4 数据处理方法
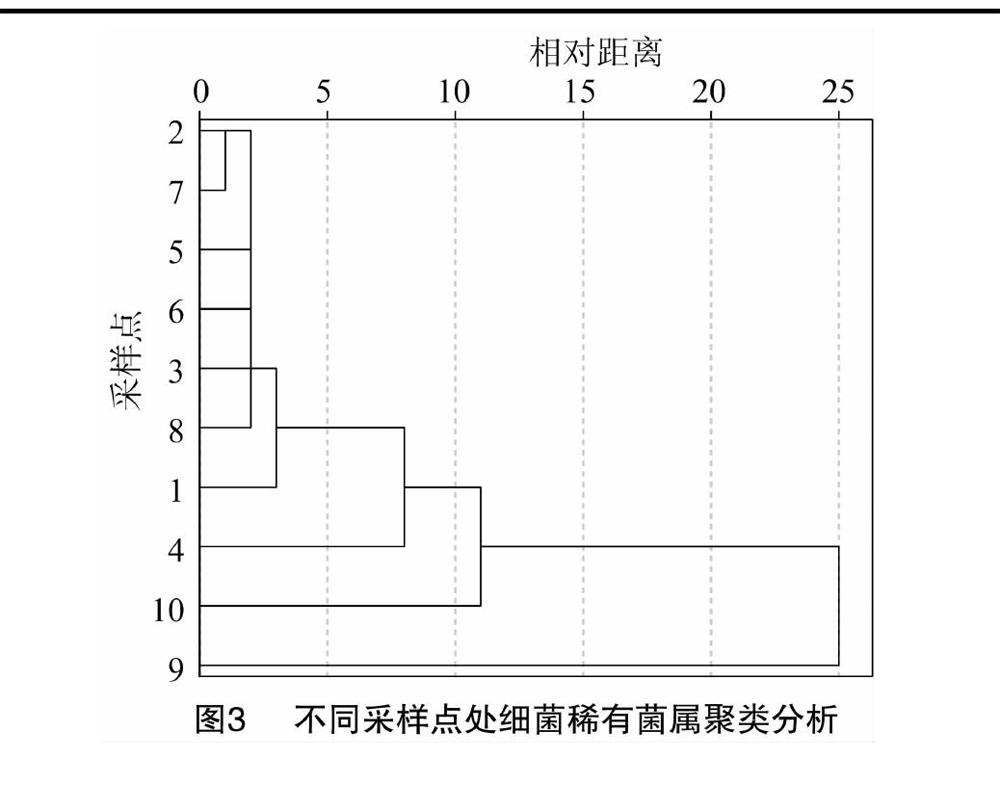
选取代表性OTU序列,与核糖体RNA数据库(Greengenes Database 13_8版本[按99%序列相似性聚類])进行比对获得物种注释信息。使用Excel 2010、Origin 8.0对数据进行处理以及作图分析,使用SPSS 19.0进行土壤理化性质和稀有细菌、真菌菌群的Pearson相关性分析以及各采样点的细菌、真菌聚类分析,本研究中细菌和真菌菌属稀有性的定义为小于0.01%的相对丰度[13]。
[4]Jousset A,Bienhold C,Chatzinotas A,et al. Where less may be more:how the rare biosphere pulls ecosystems strings[J]. ISME Journal,2017,11(4):853-862.
[5]Zhang Y,Dong S K,Gao Q Z,et al. “Rare biosphere” plays important roles in regulating soil available nitrogen and plant biomass in alpine grassland ecosystems under climate changes[J]. Agriculture Ecosystems & Environment,2019,279:187-193.
[6]Philippot L,Spor A,Hénault C,et al. Loss in microbial diversity affects nitrogen cycling in soil[J]. The ISME Journal,2013,7(8):1609-1619.
[7]Jiao C C,Zhao D Y,Huang R,et al. Abundant and rare bacterioplankton in freshwater lakes subjected to different levels of tourism disturbances[J]. Water,2018,10(8):1075.
[8]Wang Y Q,Hatt J K,Tsementzi D,et al. Quantifying the importance of the rare biosphere for microbial community response to organic pollutants in a freshwater ecosystem[J]. Applied and Environmental Microbiology,2017,83(8):e03321-16.
[9]Wei S T S,Wu Y W,Lee T H,et al. Microbial functional responses to cholesterol catabolism in denitrifying sludge[J]. mSystems,2018,3(5):e00113-e00118.
[10]Giebler J,Wick L Y,Chatzinotas A,et al. Alkane-degrading bacteria at the soil-litter interface:comparing isolates with T-RFLP-based community profiles[J]. FEMS Microbiology Ecology,2013,86(1):45-58.
[11]Vivant A L,Garmyn D,Maron P A,et al. Microbial diversity and structure are drivers of the biological barrier effect against Listeria monocytogenes in soil[J]. PLoS One,2013,8(10):e76991.
[12]Lynch M D J,Neufeld J D. Ecology and exploration of the rare biosphere[J]. Nature Reviews Microbiology,2015,13(4):217-229.
[13]Galand P E,Casamayor E O,Kirchman D L,et al. Ecology of the rare microbial biosphere of the Arctic Ocean[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(52):22427-22432.
[14]Musat N,Halm H,Winterholler B,et al. A single-cell view on the ecophysiology of anaerobic phototrophic bacteria[J]. Proceedings of the National Academy of Sciences of the United States of America,2008,105(46):17861-17866.
[15]Liu M,Xue Y Y,Yang J. Rare plankton subcommunities are far more affected by DNA extraction kits than abundant plankton[J]. Frontiers in Microbiology,2019,10:454.
[16]Hu B Y,Xu B X,Yun J L,et al. High-throughput single-cell cultivation reveals the underexplored rare biosphere in deep-sea sediments along the Southwest Indian Ridge[J]. Lab on a Chip,2020,20:363-372.
[17]Hamasaki K,Taniguchi A,Tada Y,et al. Active populations of rare microbes in oceanic environments as revealed by bromodeoxyuridine incorporation and 454 tag sequencing[J]. Gene,2016,576(2):650-656.
[18]Podar M,Abulencia C B,Walcher M,et al. Targeted access to the genomes of low-abundance organisms in complex microbial communities[J]. Applied and Environmental Microbiology,2007,73(10):3205-3214.
[19]Zhou Q,Zhang X M,He R J,et al. The composition and assembly of bacterial communities across the rhizosphere and phyllosphere compartments of Phragmites australis[J]. Diversity,2019,11(6):98.
[20]Ai D X C,Chu C J,Ellwood M D F,et al. Migration and niche partitioning simultaneously increase species richness and rarity[J]. Ecological Modelling,2013,258:33-39.
[21]Gaston K J. Biodiversity and extinction:the importance of being common[J]. Progress in Physical Geography,2008,32(1):73-79.
[22]Rodrigues J L,Pellizari V H,Mueller R,et al. Conversion of the Amazon rainforest to agriculture results in biotic homogenization of soil bacterial communities[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(3):988-993.
[23]Chambers L G,Guevara R,Boyer J N,et al. Effects of salinity and inundation on microbial community structure and function in a mangrove peat soil[J]. Wetlands,2016,36:361-371.
[24]Roesch L F W,Fulthorpe R R,Riva A,et al. Pyrosequencing enumerates and contrasts soil microbial diversity[J]. ISME Journal,2007,1(4):283-290.關添泽,于 萌,卢 刚,等. 基于分形维数的不同发育阶段胡杨对土壤理化性质的影响[J]. 江苏农业科学,2020,48(20):293-300.
