氟苯尼考的研究进展
2020-12-14孙继超陈晨张东辉
孙继超 陈晨 张东辉
摘要:氟苯尼考是氯霉素类广谱抗菌化学药物,主要用于敏感细菌所致的家禽、家畜和鱼的细菌性疾病,特别是对呼吸系统感染和肠道感染效果显著。主要从氟苯尼考的理化性质、临床药效、药物代谢动力学、检测方法等方面的研究进展进行综述,以期为氟苯尼考的开发应用和残留检测提供参考。
关键词:氟苯尼考;理化性质;临床药效;药物代谢动力学;检测方法
中图分类号: S859.1 文献标志码: A 文章編号:1002-1302(2020)20-0031-06
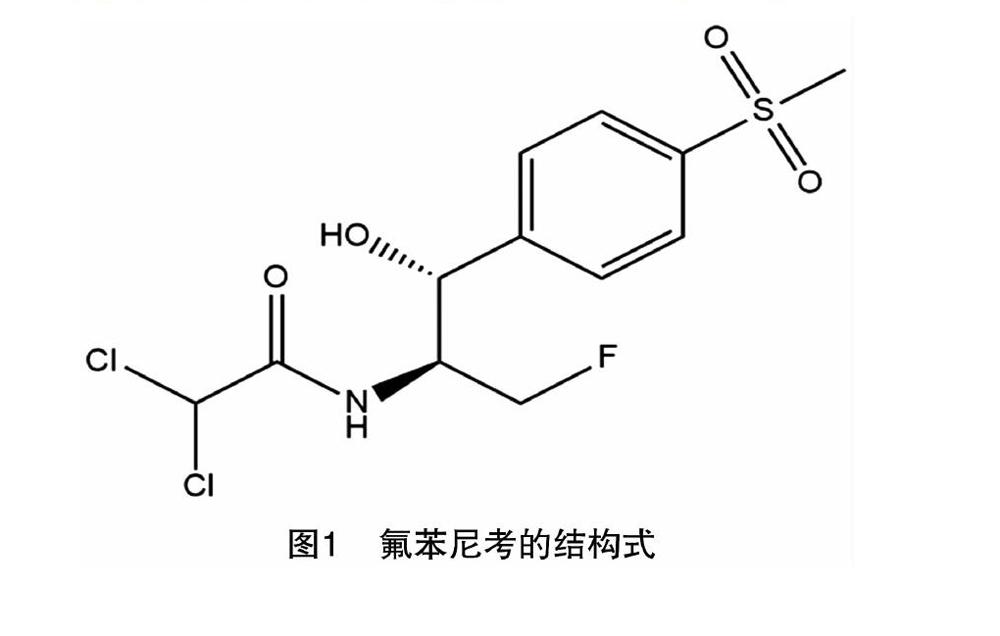
氟苯尼考(florfenicol)别称为氟甲砜霉素、氟洛芬、氟苯尼考,它的结构如图1所示,化学名称为2,2-二氯-N-{(1R,2S)-3-氟-1-羟基-1-[4-(甲基磺酰基)丙-2-基]乙基}乙酰胺,分子式为C12H14Cl2FNO4S,分子量为358.22。氟苯尼考为白色或类白色的结晶性粉末,无臭,在二甲基甲酰胺中极易溶解,在甲醇中可溶解,在冰醋酸中微溶,在水或三氯甲烷中极微溶解,其0.5%水溶液中的pH值为4.5~6.5[1]。氟苯尼考是甲砜霉素的3位氟衍生物,属新型酰胺醇类抗生素,其在动物中的代谢产物为氟苯尼考胺、氟苯尼考醇、氟苯尼考草酸铵和单氯氟苯尼考等,其中氟苯尼考胺为最主要的代谢产物,且大部分存在于动物肝脏中。
目前,氟苯尼考被广泛应用于兽医临床防治革兰氏阳性、革兰氏阴性以及甲砜霉素耐药性细菌病,因其抗菌谱广、吸收良好、体内分布广泛,特别是氟苯尼考不同于氯霉素和甲砜霉素,它不含硝基,不会造成剂量相关、可逆性骨髓抑制或不可逆转的再生障碍性贫血[2-3],也不会致畸、致癌、致突变。1988年,美国先灵葆雅公司成功研制出氟苯尼考,先后在日本、挪威、法国、英国、奥地利、墨西哥上市,用于猪、禽、鱼细菌性疾病的治疗。1999年氟苯尼考在我国获得批准为二类新兽药,被用于预防和治疗猪传染性胸膜肺炎、黄痢、白痢,以及巴氏杆菌引起的牛呼吸道感染,鸡大肠杆菌病、禽霍乱等细菌性疾病。
1 药效学
氟苯尼考是甲砜霉素的单氟衍生物,其作用机制及抗菌谱与甲砜霉素、氯霉素相同,能通过抑制细菌70S核糖体,与50S亚基结合,抑制肽酰基转移酶活性,从而抑制肽链的延伸,干扰细菌蛋白质的合成,因而对革兰氏阴性菌、革兰氏阳性菌均有抑制作用。甲砜霉素和氯霉素耐药菌通常会产生乙酰转移酶,该酶能够使甲砜霉素和氯霉素α-甲基位上的-OH乙酰化,从而失去药理活性。而氟苯尼考则因α-甲基上的-OH被-F取代,不会受乙酰转移酶的破坏,所以甲砜霉素和氯霉素具有耐药性的菌株仍会对氟苯尼考敏感。
2 抗菌作用
氟苯尼考和氯霉素一样,是一种广谱、抑菌的抗生素,对许多革兰氏阳性菌和阴性菌有效[4],虽然氟苯尼考与氯霉素、甲砜霉素的作用位置相同,但其药理成分使其对已失活的细菌具有更强的抵抗力。研究发现,氟苯尼考对耐氯霉素的大肠杆菌、肺炎克雷伯菌、普通变形杆菌、鼠伤寒沙门氏杆菌、金黄色葡萄球菌有效[5]。
Doublet等发现,氟苯尼考中的抗性基因floR是大肠杆菌转座子TnfloR 4284 bp中的一部分;floR是一种调节基因,TnfloR由floR基因组成;试验结果表明,转座子TnfloR具有潜在的迁移能力[6]。Kim等预测由1 122个由核苷酸组成的巴氏杆菌可转移R质粒衍生而来的氟苯尼考耐药基因(pp-flo)的氨基酸序列与非酶抗氯霉素基因(cml-A)的同源性为47.4%[7]。pp-flo基因位于可转移R质粒的磺酰胺抗性基因的下游区域。Keyes等于1999年检测到了鸡源的氟苯尼考耐药基因[8]。Cloeckaert等从家禽中分离出的沙门氏菌包含新的floR基因,其对氯霉素、氟苯尼考具有交叉耐药性[9]。
在哺乳动物中,氟苯尼考可用于治疗与溶血性巴氏杆菌、睡眠嗜血杆菌有关的牛呼吸道疾病。Shin等对氟苯尼考用于猪呼吸道病原的研究发现,氟苯尼考效果优于研究中使用的其他抗生素,在体外也显示出较高的抗菌活性,其最低抑菌浓度(MIC)为0.12~4.00 mg/mL[10]。除抗生素耐药性外,哺乳动物中一个与氟苯尼考有关的并发症是通过抑制吞噬作用或通过改变中性粒细胞形态减少氟苯尼考对免疫反应的影响。
3 药物代谢动力学研究
氟苯尼考给药后在机体内广泛分布,通常在大多数组织如脑脊液中浓度较高。关于氟苯尼考的药物代谢动力学研究已经在家畜、家禽、经济动物以及水产养殖生物上进行。
有大量的关于氟苯尼考在家畜中的药物代谢动力学研究,例如:程培培通过肌注复方氟苯尼考注射液,测定了其在猪体内的药物代谢动力学参数,显示达峰时间为(2.09±0.59) h,最大血药浓度为(8.42±1.85) μg/mL,清除率为(203.75±3139) mL/h,药时曲线下面积为(200.09±28.80) h·μg/mL[11]。黄仁美通过对仔猪肌注氟苯尼考注射液,测定药物代谢动力学参数,结果显示其分布半衰期为62.12 min,消除半衰期为28484 min,药时曲线下面积为 75 837 h·μg/mL,达峰时间为100.00 min,最大血药浓度为 118.96 mg/L[12]。Wilson等将氟苯尼考用于治疗牛乳房炎研究时发现,氟氯青霉素与氯青霉素相比无明显差异,对牛乳腺炎的疗效不佳[13]。Varma等通过单次静脉和口服给予小牛犊22 mg/kg氟苯尼考,结果显示静脉内给药后,消除半衰期为171.9 min,分配半衰期为5.9 min;体清除率和表观分布体积分别为 2.85 mL/(kg·min) 和0.78 L/kg;口服氟苯尼考,禁食12 h后的生物利用度为0.88,投喂后 5 min 的生物利用度为0.65;表明口服给予的小牛对氟苯尼考有吸收延迟的现象[14]。Park等在单次通过静脉内或口服给予6只健康狗20 mg/kg氟苯尼考后,进行了氟苯尼考的生物利用度和药物代谢动力学的研究[15]。通过高效液相色谱/质谱法测定血清中的氟苯尼考浓度,并分析静脉或口服施用后的血浆浓度-时间数据[15]。静脉、口服施用的全身清除率分别为103 L·h/kg和0.49 L·h/kg,稳态分布容积分别为1.45 L/kg和0.82 L/kg;氟苯尼考在静脉注射后迅速分布并消除,静脉、口服施用的消除半衰期分别为1.11 h和 0.94 h[15]。Koc等测定了静脉和肌肉注射氟苯尼考的新西兰白兔药物代谢动力学参数,结果显示回收率为 (85.00±633)%,测出限和定量限分别为0.03、010 μg/mL[16]。Park等单次静脉和口服给予家兔20 mg/kg氟苯尼考后,通过液相色谱-串联质谱(LC-MS/MS)法测定了氟苯尼考及其活性代谢物氟苯尼考胺的药物代谢动力学参数;静脉注射后,氟苯尼考的终末半衰期、稳态分布容积、全身清除率和平均停留时间分别为(0.90±0.20) h、(0.94±0.19) L/kg、(0.63±0.06) L/(h·kg)和(1.50±034) h;口服给药后,在(0.90±0.38) h时观察到氟苯尼考的峰浓度为(7.96±2.75) mg/mL;氟苯尼考的半衰期和生物利用度分别为(1.42±0.56) h和76.23%±12.02%;对兔子静脉注射、口服氟苯尼考,结果显示目标物静脉注射和口服的峰浓度分别为(5.06±1.79)、(3.38±0.97) mg/mL,达峰时间分别为(0.88±0.78)、(2.10±1.08) h,消除半衰期为(184±0.17)、(2.35±0.94) h[17]。Pentecost等通过给公羊驼静脉注射20 mg/kg氟苯尼考,测定静脉注射后的清除率和稳态体积分别为 5 mL/(min·kg) 和775 mL/kg,平均停留时间为28 h;给药后20 h,血清中的氟苯尼考浓度维持在1.0 μg/mL以上;发现血管外给药后氟苯尼考吸收速率和程度的差异可能影响血管外给药后对氟苯尼考的吸收[18]。
氟苯尼考在家禽中的药物代谢动力学研究亦有很多。Shen等单次肌肉注射和口服给予健康和被大肠杆菌感染的肉鸡30 mg/kg氟苯尼考发现,在患病肉鸡中,消除半衰期和表观分布容积均减少;在对感染鸡进行静脉注射和口服给药后,氟苯尼考的消除半衰期分别为129和104 min,肌肉注射和口服后生物利用度分别为87%和71%[19]。梅献等给鸭单剂量肌内注射30 mg/kg氟苯尼考,并测定鸭体内的药物代谢动力学参数;结果显示,健康鸭体内的峰浓度为(2288±3.11) μg/mL,表观分布容积为(2.39±0.81) L/kg,体清除率为(0.6±0.11) L/(h·kg),消除半衰期为(2.57±0.51) h,药时曲线下面积为 (47.28±7.87) h·μg/mL;在感染鸭体内的峰浓度为(19.77±1.82) μg/mL,表观分布容积为(2.44±0.46) L/kg,体清除率为(063±0.08) L/(h·kg),消除半衰期为(2.74±0.54) h,药时曲线下面积为(4811±6.62) h·μg/mL[20]。Switaa等在火鸡中通过非房室方法计算氟苯尼考的药物代谢动力学参数,结果显示静脉注射后 30 mg/kg 氟苯尼考、甲砜霉素、氯霉素的平均停留时分别为(3.37±0.63)、(2.43±0.29)和(2.12±0.21) h;口服后氟苯尼考、甲砜霉素、氯霉素的生物利用度分别为82%、69%、45%[21]。段新华等在麻鸭体内静脉注射氟苯尼考,结果显示表观分布容积为(8 388.45±850.43) mL/kg,消除半衰期为(6.61±0.83) h;肌内注射氟苯尼考峰浓度为(1.42±0.16) μg/mL,达峰时间为(1.60±0.19) h,绝对生物利用度为7159%;氟苯尼考在麻鸭体内具有良好的药物代谢动力学特征,分布迅速、广泛、消除较缓慢,肌内注射吸收迅速且吸收较完全;结合氟苯尼考对鸭疫里氏杆菌、沙门菌及大肠杆菌的MIC数据,计算得出对于上述3种细菌感染的治疗,氟苯尼考推荐剂量应该超过20 mg/kg[22]。
关于特种经济动物的研究,李云芝等发现,氟苯尼考在家蚕体内不同时间的血药浓度受环境温度影响,高温环境下蚕体对药物的吸收快,但消除也快,因此在夏秋蚕季高温环境下使用氟苯尼考防治家蚕细菌病,需要适当增加添食药物的浓度,该研究为不同养蚕季节的蚕病防治合理用药提供了科学依据[23]。
氟苯尼考在水产养殖中的药物代谢动力学及其对水生病原菌的作用已得到研究。大多数水生病原体是革兰氏阴性菌,这些微生物通常容易受到几种细菌的影响。氟苯尼考之所以被批准用于水产养殖,是因为它具有很好的适口性和耐受性,并且在淡水和盐水环境中用于治疗由易感细菌引起的鱼的疾病都是有效的。氟苯尼考具有较高的血浆和组织浓度,并在鱼体内被缓慢消除。Park等通过给韩国鲶鱼静脉注射和口服施用20 mg/kg氟苯尼考,研究氟苯尼考及其代谢物氟苯尼考胺的药物代谢动力学参数,静脉注射(推注)氟苯尼考后,終末半衰期、稳态分布容积、总体间隙分别为(11.12±1.06) h、(1.09±0.09) L/kg、(0.07±001) L/(h·kg);口服氟苯尼考后,半衰期、峰浓度、达峰时间、口服生物利用度分别为(15.69±259) h、(9.59±0.36) mg/mL、8 h、92.61%±101%,所有鱼类均检测到氟苯尼考胺[24]。Gaunt等在平均水温为25.4 ℃的淡水中,通过给斑点叉尾鱼静脉注射或口服给予单剂量10 mg/kg氟苯尼考后,通过高效液相色谱-串联质谱法(LC-MS/MS)检测分析研究氟苯尼考在血浆中的分布和体内浓度发现,静脉注射氟苯尼考后,终末半衰期、稳态分布容积、中心分布容积分别为8.25 h、0.9 L/kg、0381 L/kg;口服氟苯尼考后,末端半衰期、峰浓度、达峰时间、口服生物利用度分别为9.11 h、7.6 μg/mL、9.2 h、1.09%,口服给药时滞后吸收时间为1.67 h[25]。黄郁葱等以10 mg/kg单剂量腹注和口灌健康红笛鲷,腹注给药后,血浆、肝脏、肾脏和肌肉的峰浓度分别为10.62 μg/mL、8.36 μg/g、22.57 μg/g、476 μg/g,达峰时间分别为1.2、1.0、10、6.0 h,消除半衰期分别为29.76、17.84、17.23、19.48 h,口灌给药后血浆、肝脏、肾脏和肌肉的峰浓度分别为2355 μg/mL、145 μg/g、4.06 μg/g、1.73 μg/g,达峰时间分别为2.69、1.50、1.50、4.00 h[26]。黄聚杰等以20 mg/kg氟苯尼考混饲口灌花鲈,给药后血浆的药时曲线下面积为257.591 mg/(L·h),表观分布容积为 1.401 L/kg,平均滞留时间和消除半衰期分别为18505、12.508 h,达峰浓度和达峰时间分别为 18.356 μg/mL 和3 h[27]。药物代谢动力学参数在不同种属间的数据高度可变。
爬行动物体内的药物代谢动力学参数研究很少。朱丽敏等以30 mg/kg剂量分别单次肌注或灌服中华鳖,高效液相色谱法测定中华鳖血浆和肌肉药物残留浓度,肌注给药的药时曲线下面积为 76.45 μg/(mL·h),吸收半衰期为1.31 h,半衰期为4.48 h,最高血药浓度为7.09 μg/L;口服给药的药时曲线下面积为109.42 μg/(mL·h),吸收半衰期为1.73 h,半衰期为3.63 h,最高血药浓度为 10.64 μg/L;试验结果表明,氟苯尼考在口服情况下在中华鳖体内吸收快,血药浓度高,维持时间长,生物利用度高,药物在肌肉中消除缓慢[28]。
同时需要注意的是,水生病原菌对氯霉素、硫代氨基酚和氟苯尼考具有一定的交叉耐药性,而氟苯尼考的抗菌效果最高,并且耐药菌数量最少。水生病原体对氟苯尼考的耐药性不像氯霉素那样容易发生。
4 检测方法
4.1 高效液相色谱(HPLC)法
高效液相色谱法是分析氟苯尼考常用的方法,具有分离效率高、选择性好、重现性好、较宽的线性范围、操作自动化和应用范围广的特点,主要用于氟苯尼考的含量测定和残留量检测。Kowalski等用HPLC法测定血浆中的氟苯尼考含量,色谱柱为LiChrospher-100 Column C18,流动相为乙腈-水(体积比25 ∶ 75),所用磷酸调pH值为2.7,波长为 224 nm,检测限为0.03 μg/mL[29]。Hayes建立了HPLC法测定鱼饲料中氟苯尼考含量的检测方法,该方法的平均回收率为100.5%,检测限为 0.2 mg/kg,定量限为1.0 mg/kg[30]。戴华等采用反相液相色谱测定饲料中氯霉素、甲砜霉素和氟甲砜霉素含量,用梯度洗脱、双波长对3种组分同时进行分离测定,检测限为0.020 mg/kg,回收率大于70%,相对标准偏差(RSD)小于17.2%[31]。魏海涛等采用HPLC法测定氟苯尼考-β-环糊精包合物的溶解度和溶出度,结果显示氟苯尼考的HPLC保留时间为 4.6 min,峰形好,样品质量浓度为10~200 μg/mL,与峰面积呈良好的线性关系[32]。检测氟苯尼考常用的色谱柱是以十八烷基硅烷键合硅胶为填充剂,流动相主要是甲醇或乙腈与磷酸盐缓冲液、醋酸盐缓冲液或水,常用的检测器有紫外检测器,检测波长为223、224、225、254 nm;二极管阵列检测器,波长为225 nm;荧光检测器,激发波长为224 nm或225 nm,发射波长为280 nm或295 nm,其中紫外检测器最为常用。
4.2 液相色谱-质谱(LC-MS)法
液相色谱-质谱联用技术是选用LC与MS结合,通过探讨样品中各组分的质谱特征和裂解规律,从而确定各个组分,并进行定性和定量分析。陈国等建立了测定鸡蛋中氟苯尼考及氟苯尼考代谢物氟苯尼考胺残留量的LC-MS/MS快速分析方法,使用1.0%乙酸乙腈提取,后用PSA和C18凈化,采用XBridge C18色谱柱,以0.02%甲酸溶液和甲醇乙腈混合溶剂为流动相进行梯度洗脱,正负离子切换监测模式下进行监测,同位素内标法定量;当氟苯尼考浓度为0.10~20.00 μg/L,氟苯尼考胺浓度为0.5~100 μg/L时,两者具有较好的线性关系,氟苯尼考和氟苯尼考胺的检出限(LOD)分别为006、0.30 μg/kg,定量限(LOQ)分别为0.20、100 μg/kg;加标平均回收率为94.9%~102.0%,相对标准偏差范围为1.2%~4.9%[33]。李莹莹等建立了测定鱼肉中氟苯尼考和氟苯尼考胺的液质联用检测方法;采用碱性乙酸乙酯提取,正己烷脱脂,电喷雾离子源正负模式切换,多反应监测(MRM),内标法定量;检出限分别为氟苯尼考 1 μg/kg,氟苯尼考胺5 μg/kg;加标回收率在870%~110.4%之间,相对标准偏差均小于62%[34]。殷平等建立了采用液相色谱-质谱同位素稀释法同时测定水产品中氯霉素、氟苯尼考、甲砜霉素3种残留药物的方法。采用碱化乙酸乙酯提取,同位素内标法定量;氯霉素、氟苯尼考、甲砜霉素3种药物的定量限分别为0.05、0.50、0.70 ng/mL,并且在鱼肉中的回收率分别为 92.2%~125.5%、78.6%~102.7%、79.4%~1210%,在虾肉中的回收率分别为98.5%~1284%、735%~109.6%、87.7%~122.8%[35]。LC-MS 法大多采用电喷雾电离负离子源,通过MRN方式进行采集。LC-MS法常用的流动相为甲醇或乙腈的水溶液,流动相中加入少量的乙酸或乙酸铵等可以提高分析物的离子化效率,对峰型也有一定的改善作用。LC-MS法对不同基质的样品有时会出现基质抑制效应,因此,检测时可以使用间位氯霉素或氯霉素-D作内标,内标法定量或者采用基质匹配标准曲线法定量,以提高方法的准确度和精密度。
4.3 气相色谱(GC)法
由于氟苯尼考含有亚氨基、硫酰基等极性较强的基团,且不易挥发,因此在气相色谱法分析前,必须先对这些基团进行硅烷化或者酰化,生成热稳定和易挥发的衍生物。孙丰云等建立了一种同时检测虾肌肉中氯霉素、甲砜霉素、氟苯尼考及氟苯尼考胺残留的气相色谱-微电子捕获分析方法;样品经乙酸乙酯-氨水混合提取,正已烷脱脂,MCX固相萃取柱净化,氨水-甲醇(体积比为10 ∶ 90)洗脱,衍生化后采用气相色谱法进行检测,外标法定量;在虾肌肉组织中,氯霉素、甲砜霉素、氟苯尼考、氟苯尼考胺平均加样回收率范围分别为84.8%~88.8%、79.4%~92.1%、86.3%~1196%、89.0%~93.3%;虾肌肉中氯霉素、甲砜霉素、氟苯尼考、氟苯尼考胺的检测限分别为0.08、030、020、0.40 μg/kg[36]。气相色谱法需要对氟苯尼考进行衍生化,且衍生化反应过程中要避免水分,因为水的存在会导致衍生化效率降低和产物不稳定。
4.4 气相色谱-质谱(GC/MS)法
邵会等采用气相色谱质谱法建立基质加标标准曲线,对我国对虾、大菱鲆、鲫鱼、鳗鱼、蟹、甲鱼6种主要养殖水产品肌肉组织中注射氯霉素类药物:对氯霉素、甲砜霉素、氟苯尼考及其代谢物氟苯尼考胺的多残留同时进行检测[37]。结果显示,氯霉素浓度为 2~200 ng/mL 时,线性关系良好;甲砜霉素、氟苯尼考、氟苯尼考胺浓度为5~200 ng/mL时,线性关系良好,其R2均大于0.990,加标回收率为76.4%~94.3%,相对标准偏差为5.7%~13.9%;氯霉素、甲砜霉素、氟苯尼考及其代谢物氟苯尼考胺的检出限分别为0.2、1.0、1.0、1.0 μg/kg[37]。薛慧婷建立了淡水养殖用水中氟苯尼考残留量的 GC-MS/MS 分析方法,样品采用乙酸乙酯提取,浓缩后经甲醇溶解后,经氮气吹干后加入N,O-双(三甲基甲硅烷基)-三氟乙酰胺(BSTFA)衍生化试剂于70 ℃反应30 min,氮气吹干后正己烷定容待测;采用GC-MS/MS分析时,水样加标回收率均在85%以上,相对标准偏差在3.0%以内,在0.05~100 mg/L浓度范围内呈线性关系,R2大于0.999,检出限为 1.00 μg/kg[38]。GC/MS可以用于氟苯尼考残留的确证检测,灵敏度高。但是在进行GC-MS法分析时需氟苯尼考进行衍生化,因而限制了它的应用。
4.5 其他检测方法
胶束电动毛细管色谱(MECC)法是在缓冲液中加入十二烷基硫酸钠、三羟甲基胺基甲烷、十六烷基三甲基溴化铵等表面活性剂,形成带电荷的胶束,将色谱技术和电泳技术相结合,从而弥补了毛细管区带电泳无法分离中性粒子的缺陷,克服了HPLC法难以同时测定药物中极性与非极性成分的不足,可以在较短的时间内同时对复杂组分中共存的阳离子、阴离子及中性粒子进行分离测定。
酶联免疫吸附测定法(ELISA)以免疫抗体为基础的免疫检测技术。孙法良等制备了氟苯尼考的高亲和力特异性抗体,建立检测氟苯尼考的间接竞争ELISA新方法[39]。氟苯尼考分别与牛血清白蛋白和人血清白蛋白经混合酸酐法偶聯,得到免疫抗原和包被抗原,建立并优化了间接竞争ELISA检测方法;其R2=0.985 9,检测范围为0.18~500.00 μg/kg,检出限为0.18 μg/kg,低于国家标准中LC-MS测定肌肉中氟苯尼考的最低检测限度(LOD=1.0 μg/kg)。交叉反应试验中,抗血清与氟苯尼考结构相似的氯霉素和甲砜霉素交叉反应率分别为0.094%和0.098%,与其他药物交叉反应率均小于0.01%,表明该方法具有很强的特异性。氟苯尼考是一种半抗原,本身并不具备免疫原性,必须将其与载体蛋白偶联生成人工抗原才具有免疫原性。氟苯尼考分子结构上既无羧基也无氨基,不能直接与蛋白相联,必须先进行结构改造。ELISA法具有灵敏度高、准确度高、样品处理简单、速度快、成本较低且仪器设备简单的优点,适用于批量样本快速检测。
5 结论
氟苯尼考虽然早在1988年就被研制成功,但是目前在我国,兽药典收录的主要还是氟苯尼考预混剂、注射剂等老剂型,关于水产养殖和特种经济动物的药品未有收录。并且由于细菌耐药性问题日益突出,国家也越来越重视兽药的滥用问题。因此,开发适合我国国情的氟苯尼考新产品,建立方便、快捷、灵敏的氟苯尼考残留检测标准,对于氟苯尼考在我国的合理使用尤为重要。
参考文献:
[1]邱银生,吴 佳. 兽用广谱抗菌药物氟甲砜霉素[J]. 中国兽药杂志,1996,30(2):47-48.
[2]李秀波,石 波,梁 萍. 新型广谱抗菌药──氟苯尼考[J]. 国外畜牧科技,1999,26(3):50-52.
[3]Yunis A A. Chloramphenicol:relation of structure to activity and toxicity[J]. Annual Review of Pharmacology and Toxicology,1988,28(1):83-100.
[4]Plumb D C. Plumbs veterinary drug handbook[M]. New Jersey:Wiley-Blackwell,2008.
[5]Neu H C,Fu K P. In vitro activity of chloramphenicol and thiamphenicol analogs[J]. Antimicrobial Agents and Chemotherapy,1980,18(2):311-316.
[6]Doublet B,Schwarz S,Kehrenberg C,et al. Florfenicol resistance gene floR is part of a novel transposon[J]. Antimicrobial Agents and Chemotherapy,2005,49(5):2106-2108.
[7]Kim E,Aoki T. Sequence analysis of the florfenicol resistance gene encoded in the transferable R-plasmid of a fish pathogen,Pasteurella piscicida[J]. Microbiology and Immunology,1996,40(9):665-669.
[8]Keyes K,Hudson C,Maurer J J,et al. Detection of florfenicol resistance genes in Escherichia coli isolated from sick chickens[J]. Antimicrobial Agents and Chemotherapy,2000,44(2):421-424.
[9]Cloeckaert A,Boumedine K S,Flaujac G,et al. Occurrence of a Salmonella enterica serovar typhimurium DT104-like antibiotic resistance gene cluster including the floR gene in S. enterica serovar agona[J]. Antimicrobial Agents and Chemotherapy,2000,44(5):1359-1361.
[10]Shin S J,Kang S G,Nabin R,et al. Evaluation of the antimicrobial activity of florfenicol against bacteria isolated from bovine and porcine respiratory disease[J]. Veterinary Microbiology,2005,106(1/2):73-77.
[11]程培培. 新型复方氟苯尼考注射液的安全性评价、稳定性和在猪体内的药代动力学研究[D]. 兰州:甘肃农业大学,2014.
[12]黄仁美. 氟苯尼考在哺乳猪体内药代动力学研究[J]. 中国动物检疫,2009,26(10):42-44.
[13]Wilson D J,Sears P M,Gonzalez R N,et al. Efficacy of florfenicol for treatment of clinical and subclinical bovine mastitis[J]. American Journal of Veterinary Research,1996,57(4):526-528.
[14]Varma K J,Adams P E,Powers T E,et al. Pharmacokinetics of florfenicol in veal calves[J]. Journal of Veterinary Pharmacology and Therapeutics,1986,9(4):412-425.
[15]Park B K,Lim J H,Kim M S,et al. Pharmacokinetics of florfenicol and its metabolite,florfenicol amine,in dogs[J]. Research in Veterinary Science,2008,84(1):85-89.
[16]Koc F,Ozturk M,Kadioglu Y,et al. Pharmacokinetics of florfenicol after intravenous and intramuscular administration in New Zealand White rabbits[J]. Research in Veterinary Science,2009,87(1):102-105.
[17]Park B K,Lim J H,Kim M S,et al. Pharmacokinetics of florfenicol and its major metabolite,florfenicol amine,in rabbits[J]. Journal of Veterinary Pharmacology and Therapeutics,2007,30(1):32-36.
[18]Pentecost R L,Niehaus A J,Werle N,et al. Absorption and disposition of florfenicol after intravenous,intramuscular and subcutaneous dosing in alpacas[J]. Research in Veterinary Science,2015,99:199-203.
[19]Shen J Z,Wu X N,Hu D F,et al. Pharmacokinetics of florfenicol in healthy and Escherichia coli-infected broiler chickens[J]. Research in Veterinary Science,2002,73(2):137-140.
[20]梅 献,万 鹏,韩东东,等. 肌注氟苯尼考在鸭疫里氏杆菌感染鸭体内的药动学特征[J]. 中国农业科学,2017,50(20):4021-4027.
[21]Switaa M,Hrynyk R,Smutkiewicz A,et al. Pharmacokinetics of florfenicol,thiamphenicol,and chloramphenicol in turkeys[J]. Journal of Veterinary Pharmacology and Therapeutics,2007,30(2):145-150.
[22]段新华,杨 帆. 静脉和肌内注射后氟苯尼考在麻鸭体内药动学的初步研究[J]. 中国家禽,2016,38(4):19-22.
[23]李云芝,刘文光,刘惠芬,等. 不同温度条件下抗菌素氟苯尼考在家蚕体内的药代动力学特征[J]. 蚕业科学,2015,41(3):472-476.
[24]Park B K,Lim J H,Kim M S,et al. Pharmacokinetics of florfenicol and its metabolite,florfenicol amine,in the Korean catfish (Silurus asotus)[J]. Journal of Veterinary Pharmacology and Therapeutics,2006,29(1):37-40.
[25]Gaunt P S,Langston C,Wrzesinski C,et al. Single intravenous and oral dose pharmacokinetics of florfenicol in the channel catfish (Ictalurus punctatus)[J]. Journal of Veterinary Pharmacology and Therapeutics,2012,35(5):503-507.
[26]黃郁葱,汤菊芬,秦青英,等. 氟苯尼考在红笛鲷体内的药代动力学研究[J]. 中国兽药杂志,2016,50(11):58-64.
[27]黄聚杰,林 茂,鄢庆枇,等. 氟苯尼考在花鲈体内的代谢及残留消除规律[J]. 中国渔业质量与标准,2016,6(3):6-13.
[28]朱丽敏,杨先乐,林启存,等. 肌注和口服氟苯尼考在中华鳖体内残留分析及药代动力学[J]. 水产学报,2006,30(4):515-519.
[29]Kowalski P,Konieczna L,Chmielewska A,et al. Comparative evaluation between capillary electrophoresis and high-performance liquid chromatography for the analysis of florfenicol in plasma[J]. Journal of Pharmaceutical and Biomedical Analysis,2005,39(5):983-989.
[30]Hayes J M. Determination of florfenicol in fish feed by liquid chromatography[J]. Journal of AOAC International,2005,88(6):1777-1783.
[31]戴 华,王美玲,李拥军,等. 饲料中氯霉素、甲砜霉素和氟甲砜霉素含量的HPLC测定方法[J]. 光谱实验室,2006,23(6):1208-1212.
[32]魏海涛,宋 敏,李亮华,等. 氟苯尼考-β-环糊精包合物的研制[J]. 华南农业大学学报,2009,30(4):94-97.
[33]陈 国,王全胜,吴银良. 液相色谱-串联质谱法快速测定鸡蛋中金刚烷胺、氟苯尼考和氟苯尼考胺残留量[J]. 食品安全质量检测学报,2019,10(10):3042-3048.
[34]李莹莹,宋永青,赵 榕,等. 液质联用检测鱼肉中氟苯尼考和氟苯尼考胺的残留量[J]. 食品科学,2010,31(12):219-222.
[35]殷 平,陈舜胜,邓晓军,等. 液质联用检测水产品中氯霉素、氟苯尼考和甲砜氯霉素的残留量[J]. 现代食品科技,2007,23(10):83-87.
[36]孙丰云,张素霞,沈建忠,等. 气相色谱法同时检测虾中氯霉素、甲砜霉素、氟苯尼考及氟苯尼考胺残留量[C]//中国畜牧兽医学会兽医药理毒理学分会.中国畜牧兽医学会兽医药理毒理学分会第九次学术讨论会论文与摘要集.广州:中国畜牧兽医学会兽医药理毒理学分会,2006:208-213.
[37]邵 會,冷凯良,周明莹,等. 水产品中氯霉素、甲砜霉素、氟苯尼考、氟苯尼考胺多残留的同时测定——GC/MS法[J]. 渔业科学进展,2015,36(3):137-141.
[38]薛慧婷. 气相色谱-串联质谱技术检测水中氟苯尼考残留量[J]. 新疆水利,2017(1):36-40.
[39]孙法良,刁有祥,孙 宁,等. 鸡肉中氟苯尼考ELISA检测方法的建立及应用[J]. 中国农业科学,2009,42(5):1813-1819.潘佳昕,杨 恒,时海波,等. 畜禽副产物明胶的研究进展[J]. 江苏农业科学,2020,48(20):37-43.
