摆位误差对肝癌立体定向放射治疗剂量学的影响
2020-12-12陆世培陈昱汐盘茵琳黄思娟杨鑫
陆世培,陈昱汐,2,盘茵琳,2,3,黄思娟,杨鑫
1.中山大学肿瘤防治中心/华南肿瘤学国家重点实验室/肿瘤医学协同创新中心/广东省鼻咽癌诊治研究重点实验室,广东广州510060;2.中山大学新华学院,广东广州510520;3.广州医科大学附属肿瘤医院,广东广州510095
前言
原发性肝癌是我国最常见的恶性肿瘤之一,在我国和全球发病率中分别位居第3 和第5,死亡率位居第2 和第3[1-2],其中约50%的新发和死亡病例发生在中国[3]。放射治疗技术为不可切除的晚期肝癌患者提供潜在的治愈性切除或移植的可能性,对患者的病情起适当的缓解作用[4-7]。相对于传统的放疗,立体定向放射治疗(Stereotactic Body Radiation Therapy, SBRT)技术利用放射治疗设备使射线聚焦到肿瘤,使肿瘤之外的剂量梯度下降快,使肿瘤产生局灶性破坏,而将正常组织受到的损伤降至最低程度[8]。并且相对于传统分次治疗,SBRT 的分次数量更少,分次剂量更大。图像引导调强放射治疗(Image Guided Radiation Therapy, IGRT)是在患者进行治疗前、治疗中或治疗后利用各种影像设备获取患者相关影像资料,对肿瘤、正常组织器官或患者体表轮廓进行定位,能根据其位置变化进行调整,以达到靶区精确放疗、减少正常组织受照体积和减少患者毒副反应的效果并取得了良好的疗效[9-10]。临床研究显示,肝癌的放疗剂量与患者的生存率、缓解率呈显著正相关[11-12]。因此对于SBRT,靶区的精确定位对整个放射治疗计划的执行有至关重要的作用,须在放射治疗前利用影像设备采集肿瘤以及对周围正常组织的图像进行引导,进行个体化的图像校正[13-15]。在原发性肝癌SBRT 放射治疗中,SBRT 技术不同程度地解决了原发性肝癌放疗的3大难题:①正常肝脏和邻近危及器官(OARs)的受量限制;②需要高剂量;③肿瘤体积大[16]。
本研究对肝癌SBRT 放疗患者每次放疗前扫描CBCT 图像,将所得图像与计划图像进行灰度配准并将配准所得移床数值输入计划系统进行计算剂量分布,与原始计划剂量进行对比分析,并分析靶区PTV、OAR 剂量和靶区均匀性指数(HomogeneityIndex, HI)、靶区覆盖指数(Coverage Index, CI)等一系列剂量学参数,为临床实践提供参考。
1 材料与方法
1.1 一般材料
随机选取中山大学肿瘤防治中心应用SBRT放射治疗的肝癌患者13例,均为男性。年龄28~81岁,中位数56 岁。选取标准:处方剂量3 900 cGy(650 cGy×6次)。每例患者均进行6次CBCT扫描,共行78次。本文所使用的病历资料、临床数据与实验结果,均上传至RDD(Reserch DataDeposit,www.reserchdata.org.cn)平台进行审核(RDDA2020001692)。
1.2 靶区定位及计划设计
患者均采用真空袋进行体位固定,仰卧位,双手抱肘置于额前。每次治疗由同一位或者熟练度相近的两位放射治疗技师在患者平静呼吸状态下进行共同摆位操作。
在平静呼吸状态下采用荷兰Philips CT 模拟机(85 cm 孔径模拟CT)进行扫描定位。参考《原发性肝癌诊疗规范(2011年版)》处方剂量和靶区勾画[17]。临床肿瘤体积(Clinical Target Volume, CTV)为肿瘤区(Gross Traget Volume, GTV)外扩5~10 mm。在未采用主动呼吸控制技术(ABC 系统)的条件下,计划体积(Planning Target Volume, PTV)为在CTV 基础上,左右方向外扩6~9 mm,前后方向外扩9~12 mm,向上外扩10 mm,向下外扩19~21 mm。在PTV 满足95%处方剂量的前提下进行计划设计,将获得的定位CT 图像上传至Monaco 放疗计划系统。同时上传至X 线容积成像(X-Ray Volume Imaging, XVI)系统用于放射治疗前的图像配准。
1.3 图像获取、匹配以及校正
采用Verse HD 医用直线加速器(配备有kVCBCT 和XVI),在治疗前扫描CBCT 获取靶区和重要器官的图像数据,并进行在线校正误差,实现基于kV-CBCT 的IGRT。在本研究中,肝癌患者扫描CBCT 旋转角度从181°开始至179°,在患者每次治疗前摆位后进行扫描,获取一组X 线容积图像。利用XVI系统获取数据,并分析重建,获得横断面、矢状面及冠状面CT 图像;用软件自带的自动配准功能,采用灰度配准方式进行匹配对比,获取与治疗前靶区位置对比产生的移床参数:X、Y、Z 方向,记录并进行移床校正,然后对患者进行治疗。
1.4 计划评价
靶区和OAR 剂量参数包括最大剂量Dmax、最小剂量Dmin、平均剂量Dmean和覆盖率等。比较靶区的均匀性指数(Homogeneity Index, HI)和适形度指数(Conformity Index,CI),以评价摆位误差对靶区剂量分布的影响。
HI98、HI95的范围为≥1,等于1 时,剂量分布均匀性最好,值越大,剂量分布均匀性越差;CI的范围为0~1,越靠近于1,靶区适形度越好,等于0时靶区适形度最差[18]。
1.5 移床参数的剂量模拟
研究表明将分次摆位误差带入TPS,给出相应分次权重制作融合计划的方式模拟摆位误差对剂量分布的影响更接近真实的治疗剂量分布情况[19]。在Monaco计划系统中,保持原计划的射野参数不变,手动改变其射野等中心点的坐标,使其等于移床参数值并利用欧氏距离进行距离计算。其中放疗计划射野等中心的坐标平移值为CBCT匹配后X、Y、Z 3个方向上的移床参数值。为研究X、Y、Z 3个方向上移床参数值共同对原计划剂量造成的影响,本研究中采用欧氏距离将X、Y、Z 3个方向上移床参数值进行合并。
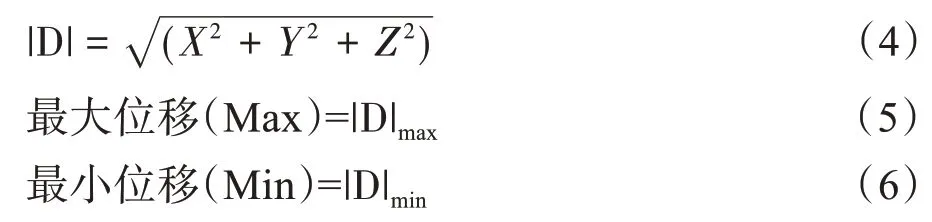
最大位移的剂量分布为对应欧氏距离的最大模拟剂量分布,最小位移的剂量分布为对应欧氏距离的最小模拟剂量分布。
1.6 统计学方法
应用SPSS 24.0统计软件对摆位误差所造成的剂量学变化资料进行统计学分析。符合正态分布的数据用配对t检验,否则用非参数秩和检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 摆位误差统计
如图1 所示,78 次摆位误差X 轴、Z 轴方向次数大致呈均匀分布[20],Y 轴方向上,头方向的次数明显大于脚方向。X-Y图显示,总体摆位误差集中分布于一、二象限,X 方向次数大致呈均匀分布,Y 方向上,头方向的次数明显大于脚方向。Y-Z 图显示,总体摆位误差集中分布于一、四象限,Y 方向分布与X-Y 图类似,Z 方向次数大致呈均匀分布。X-Z 图显示,总体摆位误差分布较为集中,均匀分布于四个象限。
由图2可知,总体上,X、Y、Z正方向上的平均位移绝对值大于负方向的平均位移绝对值。X和Z方向在正负方向的病例数分布均匀,而Y方向上的病例数分布不均,13例病人头方向的平均位移多于脚方向。
图3 显示Y 方向相较于另外两个方向,位移范围较大,最大可达11 mm,最小可至-12 mm。X、Z 方向的正、负方向分布较为均匀,但Y方向的正、负方向分布不均,图像动度大。
如图4所示,Y方向放疗前的位移偏差波动较大,且头方向的位移次数远高于脚方向的位移次数。X、Z方向上左、右方向和前、后方向的位移次数无明显差异。
图1 所有患者78次摆位误差坐标分布Fig.1 Coordinate distribution of 78 setup errors for all patients
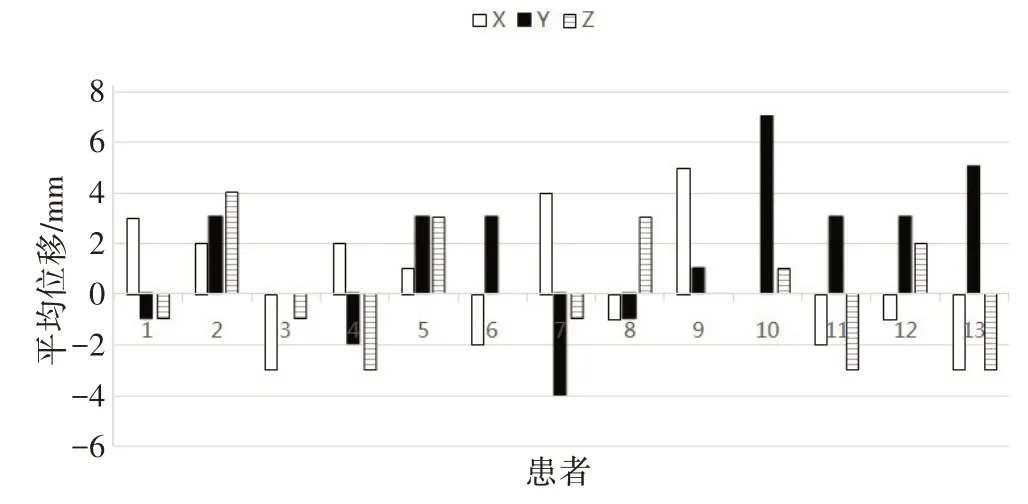
图2 13例病人在X、Y、Z方向上的平均误差Fig.2 Mean error of 13 patients in X,Y,and Z directions
表1 显示,X、Y、Z 方向的误差分布区间分别为-7~8 mm、-12~11 mm、-6~6 mm。X、Z 方向的系统误差在1 mm 以下,说明设备精度高[24],但Y 方向上的系统误差略高于1 mm。随机误差均<5 mm,但大于1 mm,这表明重复性差,随机误差是导致摆位误差的主要因素。X、Y方向上的摆位误差分布不对称,且Y方向上的误差偏差大。
2.2 摆位误差对靶区PTV的剂量学影响
13例病人中,最大位移均≥3 mm,其中12例病人的最大位移>5 mm;最小位移均<5 mm,其中9例病人最小位移≤3 mm。
图3 13例病人在X、Y、Z方向上的分次位移Fig.3 Fractional displacement of 13 patients in X,Y,and Z directions
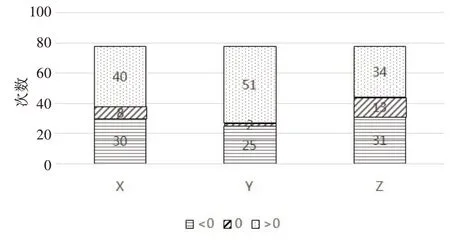
图4 摆位误差在X、Y、Z方向上的移床次数Fig.4 Number of bed shifts with setup error in X,Y,and Z directions
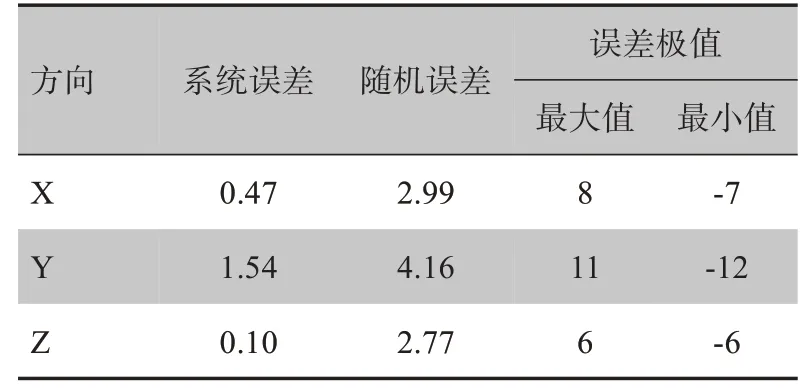
表1 所有患者的摆位误差(mm)Tab.1 Setup error for all patients(mm)
表2 表明最大移床和最小移床对Dmax均无统计学意义,摆位误差对靶区Dmax无明显影响。最大移床对Dmin有显著影响。但对整个靶区的Dmean来说,大于>5 mm的摆位误差对靶区剂量有显著影响,≤3 mm的摆位误差对靶区剂量影响相对较小。>5 mm 的移床值,对Dmin、Dmean、覆盖率均有明显影响;≤3 mm的移床值,只对Dmin和覆盖率有明显影响,对Dmean无影响。
2.3 摆位误差对靶区适形度和均匀性的影响
由表3可知,摆位误差对最大移床和最小移床的剂量分布均匀性和适形度均有显著影响,原始计划的剂量分布均匀性和适形度明显比最大移床和最小移床好。最大移床的HI98、HI95、CI与原计划相比分别增加了40.1%、24.5%和减少了31.6%;最小移床的HI98、HI95、CI与原计划相比分别增加了4.4%、2.5%和减少了6.2%。
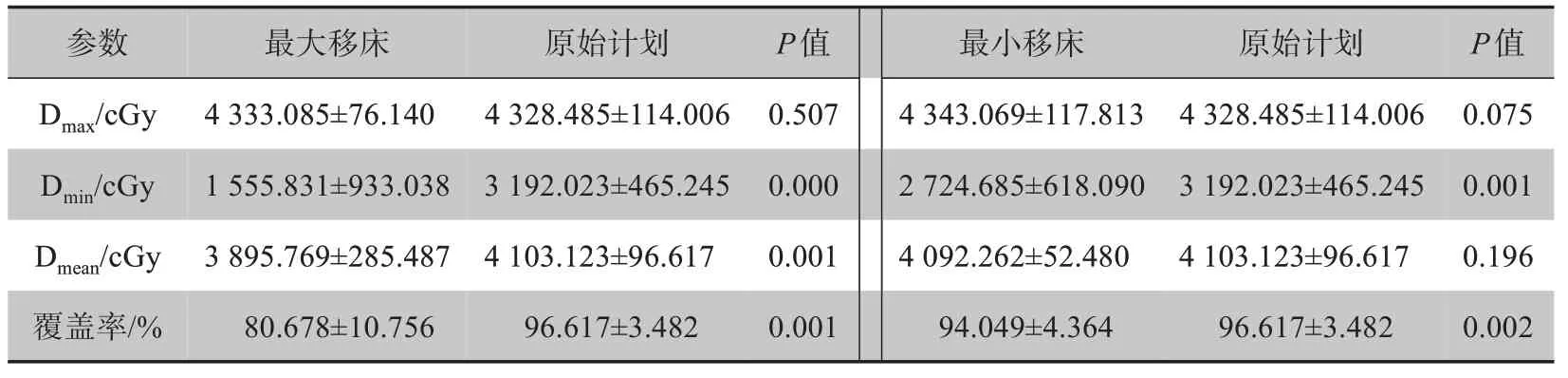
表2 靶区PTV剂量参数的统计分析Tab.2 Statistical analysis of PTV dose parameters for target areas
2.4 摆位误差对OAR的剂量学影响
对于OAR,与原始计划相比,左肾、小肠最大移床值剂量分布在Dmean、Dmax上具有统计学意义,右肾最小移床值剂量分布在Dmean上具有统计学意义(表4)。
3 讨论
近年来,随着3DCRT、IMRT、IGRT、SBRT等放射治疗技术的逐渐发展及应用,放射治疗对不可手术的肝癌起到重要作用。图像引导下SBRT已在原发性或转移性肝癌方面显示了满意的疗效和良好的安全性[21]。IGRT提高了靶区的控制率及放射治疗的精确性,这有利于降低周围正常组织受到的不必要辐射。Yoon等[22]研究发现,与3DCRT相比,图像引导的调强放疗增加了肝癌患者的生存获益,并且没有增加肝脏放疗毒性[23]。在IGRT基础上的放射治疗已经普及,射线照射靶区的精确度明显提高,逐渐将原来常规分割模式(2 Gy/次)提高到≥3 Gy/次,甚至高达20 Gy/次的大分割放疗[24]。立体定向大分割放疗能够精确地将高剂量集中在肿瘤靶区,而靶区以外的剂量直线下降,这能够使肿瘤周围的正常组织受很小的照射剂量甚至免受辐射,从而达到保留部分正常肝组织不受照射的效果[23]。姚文燕等[25]研究指出TOMO的图像引导中,胸腹部肿瘤和盆腔肿瘤放射治疗时,可考虑前5次扫描或每周1次扫描的方式来代替每天1次扫描,减少患者受到的额外辐射剂量。但SBRT分割次数少,单次剂量高,对摆位精度有更高的要求,故本研究采用每次放疗前都进行图像引导扫描。摆位精度受多方面因素的影响,其中包括体位固定装置、加速器型号、激光灯的准确性以及治疗师的操作熟练程度等。摆位重复性是现代精确放疗的必要条件[26]。本研究中患者由同一位治疗师或者操作熟练度相近的两位治疗师进行摆位和利用CBCT在每次患者治疗前对其进行移床校正。在放射治疗过程中,若每次治疗时存在摆位误差而未用IGRT进行校正,有可能会造成靶区漏照以及使OAR受到高剂量照射,造成严重的并发症或后遗症[27]。
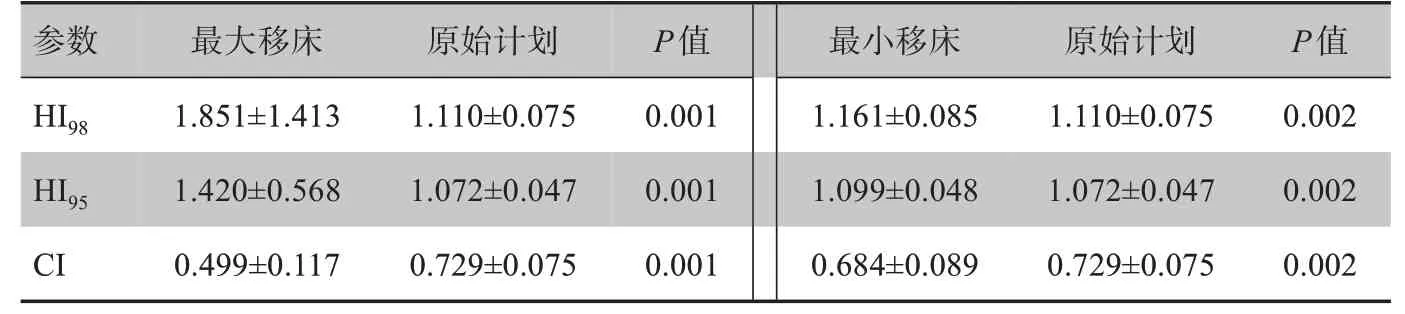
表3 摆位误差对HI和CI的剂量学影响Tab.3 Dosimetric effect of setup error on HI and CI
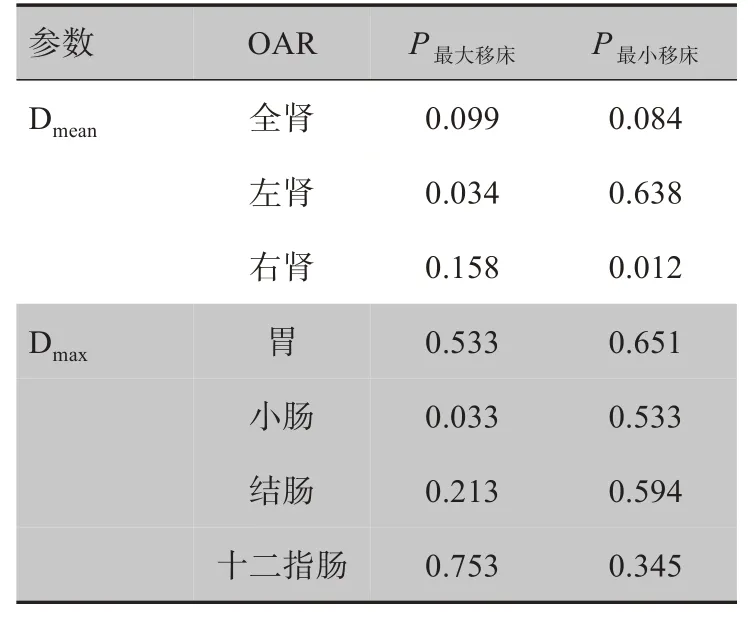
表4 OAR剂量参数的统计分析Tab.4 Statistical analysis of OAR dose parameters
尹文晶等[28]研究指出静态IMRT 由于治疗时间长会使病人的不自主运动增多,且摆位误差随着治疗时间逐渐增大。有研究发现VMAT 的治疗时间显著缩短[29-32]。
本研究结果显示,X方向上误差(0.47±2.00)mm,误差分布区间为-7~8 mm,Y方向上误差(1.54±4.16)mm,误差分布区间为-12~11mm,Z方向上误差(0.10±2.77)mm,误差分布区间为-6~6 mm。由于使用真空袋可能存在漏气,患者体位变动、抱头姿势变化等原因,会产生一定范围的位置移动。ICRU 24 号报告指出,靶区照射剂量偏离5%就有可能使原发灶失控或并发症增加[33]。彭倩等[34]报道宫颈癌靶区中心复位后用CBCT 配准距离X、Y、Z方向误差分布区间分别为-7.6~4.0 mm、-5.7~7.3 mm、-4.3~4.6 mm。丘敏敏等[35]的研究中,放疗前3 个方向的摆位误差分别为X 轴(-0.03±2.06)mm、Y轴(0.16±2.69)mm、Z轴(0.18±2.28)mm。在本研究中,Y方向上摆位误差较大且波动也较大,导致这种误差较大的原因可能是未使用体罩等除真空垫以外的其他固定装置,使患者体位在头脚方向上变化较大。这些在临床精确放疗的实践中必须予以重视,尤其是在SBRT少次、大剂量分割放疗技术中,摆位精确、靶区精确显得尤为重要。李晓林等[36]利用真空垫+立体定位架结合腹压板和真空垫+大体罩固定摆位,能有效减少患者头脚方向的摆位误差,并在一定程度上使患者的体位更加舒适、稳定,且重复性好。
Liu 等[37]对鼻咽癌的研究中,摆位误差对平均剂量影响大体上无统计学意义,对GTV 最小剂量影响显著,>3 mm 的误差对GTV 最小剂量均有影响,>5 mm 的误差对GTV、CTV 最小剂量均有明显影响,说明>5 mm 的误差对GTV 的影响较大。本研究结果显示无论位移范围是否≤3 mm 对靶区最小剂量和覆盖率均有明显影响。对于平均剂量,>5 mm 的误差对靶区剂量有明显影响,而≤3 mm 的误差对靶区剂量影响小。造成这种差异可能是由于本研究使用了PTV 作为目标区域,而Liu 等[37]使用的是GTV和CTV 作为目标区域。大体上一致得出的结论为≤3 mm 的摆位误差对靶区剂量的影响比>5 mm 的影响小,但对于最小剂量和覆盖率仍然有明显影响,所以应该尽可能减小摆位误差,以实现精确放疗。
本研究中摆位误差对最大移床和最小移床的剂量分布均匀性和适形度差异均有统计学意义,最大移床的HI98、HI95、CI与原计划相比分别增加了40.1%、24.5%和减少了31.6%;最小移床的HI98、HI95、CI与原计划相比分别增加了4.4%、2.5%和减少了6.2%。说明HI98与HI95结果相似,摆位误差对HI、CI影响显著,且最大移床对原计划的影响较大。胡杰等[18]研究表明,如果摆位误差在3 个方向均到达5 mm情况下,PTV剂量均匀性和适形度显著降低,低剂量的存在可能导致治疗的失败。本研究病例中有92.3%的病人的最大位移>5 mm,本研究结果与胡杰等[18]研究结果类似,均表明摆位误差>5 mm对原计划影响显著。靶区位移>5 mm可能导致高剂量区出现剂量冷点,低剂量区出现剂量热点,从而影响靶区均度性和适形度。
有文献显示在线校正移床参数对降低OAR的剂量具有一定的意义,证明IGRT对于放疗中OAR的保护具有积极作用[38-40]。本研究结果显示移床参数值对放疗中的OAR 指标大部分并无统计学意义,但与原始计划相比,左肾、小肠最大移床值的剂量分布在Dmean、Dmax上具有统计学意义,右肾最小移床值的剂量分布在Dmean上具有统计学意义。其原因可能为患者病灶位置不同,以及勾画的OAR 数量的不一致性导致样本量少,并不具有方差齐性。
王艳阳等[38]研究显示单纯调整平移摆位误差前、后旋转误差无变化。Cao 等[41]研究显示SBRT 中肝脏肿瘤的实际旋转误差幅度相对较小,不太可能显著影响GTV 覆盖,因此可以通过优化平移校正进而补偿旋转误差。但有研究表明为保证食管肿瘤放疗的精确性,当平移误差大于1 mm,旋转误差大于0.5°时要重新纠正6D 误差[42]。本研究中仅对平移方向的移床参数进行了校正,未对治疗中产生的旋转运动进行纠正,但在实际治疗中平移误差和旋转误差是同时存在的并对患者产生影响。
本研究所选案例较少、未使用除真空垫以外的其他固定装置,导致位移偏差较大,故具有一定的局限性。赵漫等[43]研究中推荐的CI以多个参数的形式,对靶区剂量的适合度、正常组织中高低剂量分布情况、OAR受量以及计划中剂量跌落情况进行定量评估,结合DVH显示信息使计划设计达到更优。而本研究的CI仅使用了ICTU 83号报告[44]提出的CI计算方法,故本研究具有一定的局限性,可进一步改善。但通过这13例病例证明了校正摆位误差对SBRT的必要性。利用IGRT对摆位误差进行校正,有利于提高靶区均匀性、适形度和靶区覆盖率等,实现精确放射治疗。建议使用发泡胶+腹压板或体膜联合呼吸门控进行体位固定,减少头脚方向上的位移偏差和由于呼吸运动造成的位移偏差,将位移误差尽可能控制在3 mm以内。
