模板剂对MnOx催化剂微观形貌的调控及其催化氧化甲苯性能
2020-12-11项文杰张学军
项文杰, 刘 威, 赵 恒, 张学军
(1.沈阳化工大学 环境与安全工程学院, 辽宁 沈阳 110142; 2.沈阳化工大学 理学院, 辽宁 沈阳 110142)
挥发性有机物(volatile organic compounds,简称VOCs)作为生成O3及PM2.5的前驱体,且由于其对人类健康以及环境的巨大危害而备受关注[1].催化燃烧法去除VOCs被认为是废气治理行业最可行的方法之一[2],而催化剂作为该技术的核心得到了广泛研究.常见的催化剂可分为贵金属催化剂、过渡金属氧化物催化剂等.贵金属型催化剂在降低VOCs方面表现出优异的性能,但由于其价格昂贵且易中毒失活,所以其应用一直受到限制[3].而过渡金属凭借来源丰富、价格低廉、稳定性好等优点引起了相关学者的广泛关注.以锰氧化物为基础的催化剂也是催化氧化VOCs合适的候选者[4].
高秀坤等[5]以P123为模板剂制备了SBA-15/MnO2吸附剂,发现其具有良好的吸附效果.Piumetti等[6]采用溶液燃烧法制备了3种锰氧化物MnxOy(Mn3O4和MnO2的混合物)、Mn2O3和Mn3O4,考察其对甲苯的催化活性时发现3种催化剂活性呈如下顺序:Mn3O4>Mn2O3>MnxOy,文章表明更多的吸附氧和结构缺陷以及良好的氧化还原性能是Mn3O4催化活性较高的主要原因.Kim等[7]也得到了类似的结论.Cellier等[8]通过一系列表征手段证明了γ-MnO2在催化氧化正己烷和三甲胺时遵循MVK机理,较强的氧移动性能是其活性好的主要原因.Wang等[9]通过调变合成条件制备了棒状、线状、花状等不同形貌的锰氧化物,研究发现微观形貌对其催化活性具有明显影响.宋灿[10]制备了一系列晶型、形貌不同的锰氧化物并考察其对于氯苯的催化活性.结果表明Mn—O键的强弱会影响其催化活性,同时进一步证明了晶相及微观形貌的不同是影响其催化活性的一个重要因素,氧物种和污染物在空心结构的Mn2O3中更易流动,利于活性的提高.影响MnOx催化氧化活性的因素有很多,例如:催化剂中不同种类活性氧物种的含量、锰元素的平均氧化价态、催化剂的氧化还原性能、催化剂的微观结构、比表面积等.但是,关于这些影响因素所起到的作用却众说纷纭.Kim等[11]指出丰富的Mn3+是导致良好催化活性的重要因素.相反的,Liao等[12]认为Mn4+在反应过程中起到了不可忽视的作用.不仅如此,对于氧物种的作用也并没有统一的定论.Sun等[13]通过水热法制备OMS-2催化剂并对氧物种在催化氧化甲苯中的作用进行了讨论,表征结果表明更多的晶格氧会提高催化剂的选择性以及对甲苯的氧化能力.但是Tang等[14]人通过柠檬酸法制备了Mn-Ce二元复合氧化物,研究表明在催化氧化VOCs过程中,丰富的表面吸附氧对其催化活性的提高起重要作用.
规整有序的介孔结构对催化剂性能的影响也一直是研究者们研究的重点.Bai等[15]将Mn负载于KIT-6上,使锰氧化物的微观结构更加有序,且孔径分布更多样化,从而提高催化剂表面晶格氧以及Mn3+的含量,改善了其低温还原性能和催化活性.Dai等[16]利用KIT-6为硬模板,负载Cr为活性组分并对甲苯和乙酸乙酯进行了催化燃烧实验,结果发现与普通的CrOx相比,具有规整有序介孔结构的样品表现出较好的催化性能.但采用硬模板法制备催化剂时,在刻蚀过程中会导致反应活性金属的流失以及结构的不均匀坍塌,而软模板法则是利用模板剂为催化剂提供结构支撑,起到结构导向作用,最终利用焙烧方式将模板剂去除.
因此,为了进一步研究催化剂微观结构与其催化性能的内在联系,本文采用软模板法制备了一系列MnOx催化剂,通过添加不同的模板剂对催化剂微观形貌进行调变,同时利用XRD、SEM、H2-TPR等表征探究催化剂微观形貌与其催化活性之间存在的关系.
1 实验部分
1.1 试剂
CTAB,Biotopped化学试剂公司;P123,玛雅试剂公司;硝酸锰[Mn(NO)3],AR,国药集团化学试剂公司;碳酸铵[(NH4)2CO3],AR,国药集团化学试剂公司;无水乙醇(C2H5OH),AR,国药集团化学试剂公司;去离子水,自制.
1.2 催化剂的制备
分别称取0.2 g的CTAB和P123于2个烧杯,加入20 mL去离子水并搅拌至完全溶解,之后分别加入0.023 mol硝酸锰,同时在一个空烧杯中加入0.023 mol硝酸锰以及20 mL去离子水作为对照组,在搅拌条件下向3个烧杯中滴加碳酸铵饱和溶液至溶液pH=9.在室温条件下继续搅拌5 h后静置一夜,用循环水真空泵抽滤,并用去离子水和无水乙醇交替洗涤至溶液pH=7.然后置于烘箱中105 ℃干燥.将干燥的催化剂放入马弗炉中于550 ℃焙烧5 h,升温速率为3 ℃/min.并将得到的催化剂筛分至40~60目,根据使用模板剂的不同,催化剂分别被标记为:Mn(无模板剂)、Mn-C(CTAB)和Mn-P(P123).
1.3 催化剂的表征
XRD的测定:采用BRUKER D8 ADVANCE型X射线衍射仪进行测定.Cu-Kα作为射线源,测试范围10°~70°,扫描速度为0.05°/步,步时为3 s.
SEM的测定:采用日立SU8010(Hitachi,日本)高分辨冷场发射扫描电子显微镜进行测试.
H2-TPR的测定:在PCA-1200型化学吸附仪(北京彼奥德电子技术公司)上进行H2-TPR测定.将20 mg样品放置在U型石英管中,在高纯N2气流中将温度上升到300 ℃,速度为10 ℃/min,持续1 h,然后冷却到100 ℃.此后,以30 mL/min的流速通入H2/Ar[φ(H)=5 %]混合气,同时,温度逐渐升高到900 ℃,其中氢气的消耗量由热导检测器进行记录,并以如下方法对耗氢速率进行计算.
(1)
(2)
Xi=Ai×f.
(3)
(4)
如公式(1)所示,热导检测器所检测到的瞬时面积(ai)可根据瞬时信号强度(Ii)以及检测时间间隔(Δt)计算所得.此后再由指定时间内瞬时面积(ai)根据公式(2)加和得到该时间段出峰总面积(Ai).其中峰面积与H2消耗量之间的系数(f)可由脉冲循环中H2的量与平均信号面积之间的关系确定,因此根据公式(3)可得到该时间段所消耗的H2的量(Xi),同时H2消耗速率(ri)也可根据公式(4)计算得到.为避免其他因素的影响,在计算过程中只选取H2消耗量小于20 %(体积分数)时的数据.
O2-TPD的测定:在PCA-1200化学吸附仪(北京彼奥德电子技术公司)上进行测定.在U形管式反应器中,将200 mg样品在He中(30 mL/min)于200 ℃脱气1 h.冷却至50 ℃后,样品预先吸附O2/He[30 mL/min,φ(O2)=20 %]1 h.然后,将反应器在He气氛(30 mL/min)中从50 ℃(10 ℃/min)加热到900 ℃,并通过TCD记录脱附氧的信号.催化剂的氧气脱附量(Xo)计算公式为
Xo=S×f′.
(5)
式中:S为催化剂氧脱附峰面积;f′为通过已知浓度的氧气进行脉冲测试,计算出峰面积与氧气脱附量之间的关系系数.
BET的测定:催化剂孔结构的N2吸脱附曲线在SSA-6000(北京Builder电子技术公司)仪器上于-196 ℃条件下测试.采用Brunauer-Emmett-Teller(BET)模型中的线性部分确定每个样品的比表面积(SBET),并通过Barrett-Joyner-Halenda(BJH)公式,使用等温线的解吸分支得出孔体积(Vg)和孔径分布.所有样品在测试之前均在真空环境下于250 ℃脱气3 h.
1.4 催化剂活性评价
催化氧化活性评价在常压固定床反应器中进行.其中甲苯由N2通入鼓泡器中带出,经过内径为8 mm的石英管后进入气相色谱对其浓度进行检测.催化剂床层由K型热电偶进行温度检测,反应温度范围为100~400 ℃.将粒径为40~60目的0.1 g催化剂装入石英管中后通入反应气,反应气氛为:甲苯(体积分数0.5 %)、O2/N2[φ(O2)=20 %]作为平衡气,气体总流速为100 mL/min,即空速为60 L/(g·h).
甲苯转化率=[(甲苯进口浓度-甲苯出口浓度)/甲苯进口浓度]×100 % .
(6)
CO2产生率=(CO2出口浓度/甲苯完全转化时CO2出口浓度)×100 %.
(7)
标准化初始反应速率[r,mol/(g·s)]为
(8)
式中:F为气体总流速,m3/s;m为催化剂质量,g;p为大气压,Pa,R为理想气体常数(8.314 J·mol-1·K-1);T为实时温度,K;X为甲苯去除率;c甲苯为甲苯入口浓度,mol/L.
2 结果与讨论
2.1 X射线衍射(XRD)结果分析
图1为样品Mn、Mn-P和Mn-C的XRD表征结果.
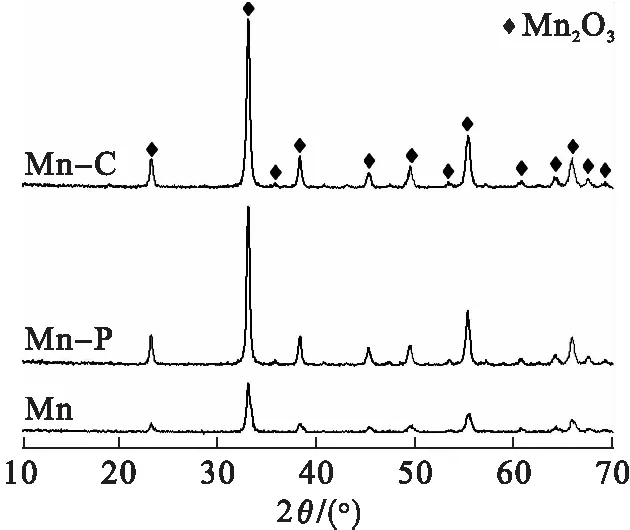
图1 Mn、Mn-P和Mn-C的XRD谱图
由图1可知:所有样品均以Mn2O3晶相为主要存在形式[6],模板剂的添加并没有改变催化剂晶相的存在形式.但值得注意的是,添加模板剂后样品Mn-P和Mn-C均展现出更强的XRD特征衍射峰强度,表明其结晶程度更高,是催化剂结构长程有序堆积所致.通过谢乐公式计算得到Mn的平均粒径为1.49 nm,Mn-C的平均粒径为2.53 nm,Mn-P的平均粒径为2.67 nm.通过MDI Jade计算得到各催化剂的晶格常数分别为:Mn(9.406×9.406×9.406,90°);Mn-P(9.409 1×9.409 1×9.409 1,90°);Mn-C(9.414 6×9.414 6×9.414 6,90°).上述数据都是催化剂微观结构规整有序,暴露晶面更为完整的表现.所以,模板剂的添加不仅增强了催化剂的结晶度,而且有助于晶胞的生长,为催化剂微观结构的规整有序创造了有利条件,上述结论与SEM图像共同证明了模板剂的添加确实引导了催化剂微观形貌的改善.
2.2 比表面积(BET)结果分析
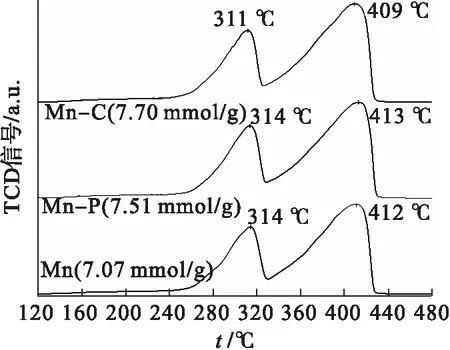
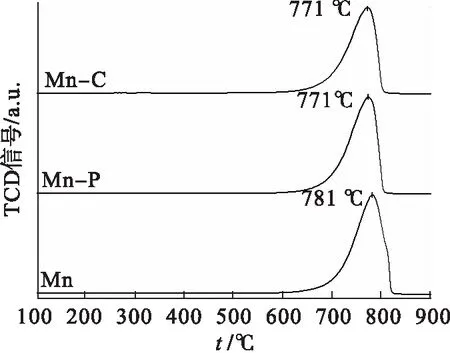
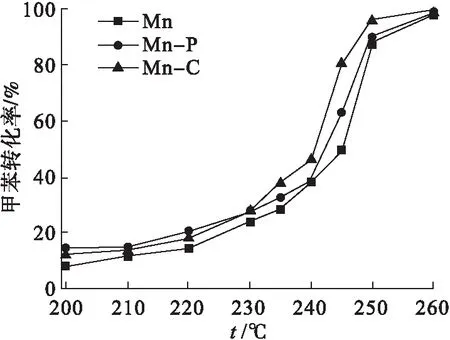
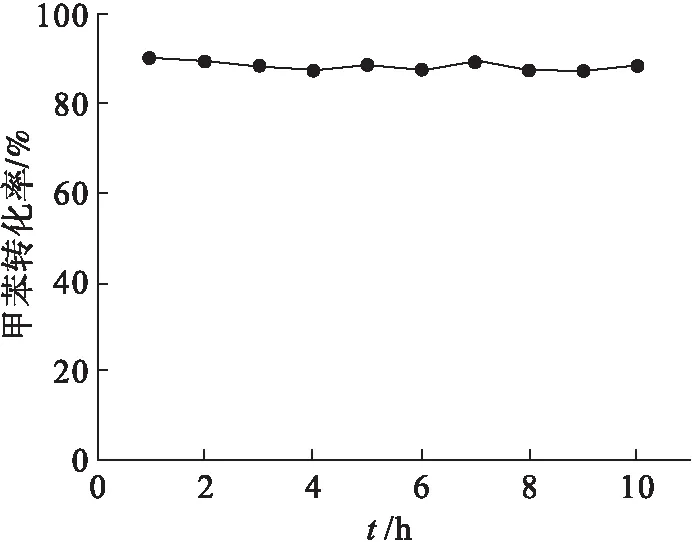
图2显示了催化剂的N2吸脱附等温线及孔径分布曲线.由图2可知:所有催化剂的等温线均属于Ⅳ型等温线[17],而且迟滞回环均属于H3型,代表不规则的裂隙状介孔的存在[18].利用Barrett-Joyner-Halenda(BJH)方法计算孔径的分布后可以发现: 样品Mn-C的孔径分布范围主要集中在21 nm,而Mn-P和Mn的孔径分布则主要集中在25 nm,表明CTAB的添加会缩小催化剂的介孔和微孔直径,为催化剂微观形貌的改善创造有利条件;而Mn-C(38 m2/g)的比表面积较之Mn-P(34 m2/g)和Mn(32 m2/g)更大.由催化氧化甲苯的活性图(图6)可知各催化剂的t50顺序为Mn-C(240 ℃) 图2 Mn-C、Mn-P和Mn的N2吸脱附曲线及孔径分布 图3为 3种催化剂Mn、Mn-P和Mn-C的扫描电镜结果.3种催化剂均以由短杆状的颗粒组成的微球形式存在. 图3 Mn、Mn-P和Mn-C的扫描电镜照片 比较3种催化剂可以发现,虽然整体形貌相似但是存在一定的差别.样品Mn[图3(a)]中有很多微球结构并不完整且球体表面较为粗糙,此外该样品中的微球粘连较为紧密,形成了较大的不规则团块.而样品Mn-P[图3(c)]和Mn-C[图3(e)]结构较为规整有序,大多数微球结构完整且表面光滑.由于添加模板剂的不同,Mn-P[图3(d)]中组成微球的短杆状颗粒尺寸较大且粘连程度小,呈现为分散的小团簇.相比而言,Mn-C[图3(f)]中组成微球的短杆状颗粒排列紧密且颗粒尺寸小,整体呈现形状类似蜂窝状,且周围的微球有整合趋势,更偏向于以纳米球的形式存在,这也是该样品微球表面光滑的主要原因.因此,不同模板剂的添加会影响催化剂内部的粘连程度和微球结合导向,从而使催化剂的微观形貌发生改变. 通过H2-TPR研究了微观形貌的改变对3种催化剂氧化还原性能的影响,结果如图4所示. 图4 Mn、Mn-P和Mn-C的H2-TPR谱图 由图4可以看出:3种催化剂的还原峰位置和形状并没有明显差别,均在311 ℃和410 ℃左右的位置拥有两个主要的还原峰,分别对应MnO2到Mn2O3的还原(低温)和Mn2O3到MnO的还原(中高温)[19],即催化剂表面氧物种的还原;相较于催化剂Mn,Mn-C的还原峰温度稍低,而样品Mn-P并没有明显变化.因此可以推测:CTAB的添加降低了氧空位的形成能,从而进一步加快了催化剂活性位点的活化.通常来讲,除还原峰温度外,总H2消耗量也是描述催化剂还原性能的又一重要指标.对催化剂总耗氢量进行计算发现样品Mn的耗氢量为7.07 mmol/g,明显低于具有有序介孔结构的另外两个催化剂,而这两个催化剂中,Mn-C(7.70 mmol/g)的耗氢量稍大于Mn-P(7.51 mmol/g).因此,可以得出结论:规整的微观形貌能够增加催化剂表面的氧空位或加快氧物种的迁移转化速率从而增强其催化氧化性能. 通过O2-TPD可以确定催化中的氧物种及其含量.而根据MVK机理可知,催化剂中的氧物种对目标气体的反应和吸附都具有重要作用.因此采用O2-TPD对3个样品中氧移动能力等性能进行检测.如图5所示,3种催化剂都只在780 ℃左右的位置出现一个氧的脱附峰,这个位置的峰通常归为体相晶格氧的脱附峰[20].不难看出,添加模板剂后催化剂Mn-C和Mn-P的氧脱附温度发生明显的向低温偏移的趋势,代表在这两个样品中晶格氧的可利用性更强,即其氧移动性能更优秀[21].从而可以说明催化剂微观形貌的改善有助于加快晶格氧的迁移转化以及增强表面氧物种的活性和吸附性,即改善微观形貌后的催化剂表面的氧空位再生速度得到提升. 图5 Mn、Mn-P和Mn-C的O2-TPD谱图 在反应条件为甲苯初始体积分数0.05 %,氧气体积分数20 %,空速60 000 h-1时,3种催化剂对甲苯的催化氧化性能如图6所示.添加模板剂后,MnOx催化剂的催化性能有明显提升,如表1所示. 图6 Mn、Mn-P和Mn-C的催化氧化甲苯活性 表1 Mn、Mn-P和Mn-C的活性信息 3个样品的t50顺序为:Mn-C(240 ℃) 图7 Mn、Mn-P和Mn-C的CO2选择性 曾有研究报道,控制或改变催化剂的微观形貌能够促进催化剂活性位点的暴露,从而改善催化剂的催化活性[22-23].实验中采用添加模板剂的方法改善MnOx的微观形貌,通过XRD和SEM可知,样品Mn-C和Mn-P具有更为规整有序的微观形貌和介孔结构.Mei等[24]曾采用硬模板法制备了一系列CoOx催化剂,结果表明有序的介孔结构有助于催化剂氧化还原性能的提升.Pan等[25]制备了一种球状MnOx催化剂,掺杂Fe后破坏其原本结构.与结构有序的MnOx进行对比发现,有序的介孔结构有利于催化剂活性位点的展露、氧化还原性能的提升以及氧移动能力的改善.与上文相似,本实验通过添加模板剂改善催化剂的微观形貌后,发现规整有序的孔结构降低了催化剂的氢气还原温度、增大了其氢气消耗量,同时降低了催化剂晶格氧脱附温度,即增强了催化剂的氧化还原性能和氧移动能力.而且很多研究表明,催化剂氧化还原能力和氧移动能力的提升是改善其催化活性的重要因素[26-27].因此,与样品Mn相比,具有更为规整有序介孔结构的Mn-C和Mn-P拥有更出色的催化活性,同时在催化氧化甲苯过程中展现出更优秀的CO2选择性. 实验对Mn-C进行了稳定性实验,实验结果见图8.在甲苯初始体积分数0.05 %,氧气体积分数20 %,空速60 000 h-1的条件下保持在247 ℃连续运转10 h.在整个测试期间,甲苯的去除率均维持在87 %以上,证明Mn-C催化剂具有良好的稳定性. 图8 Mn-C的稳定性测试 综上所述,模板剂(CTAB和P123)的添加会使Mn基催化剂的微观结构更为规整有序,其中添加CTAB的催化剂的介孔和微孔更小,比表面积更大.而扫描电镜和活性结果也证实了催化剂微观形貌确实对催化活性有重大影响:排列紧密且孔径尺寸更小的Mn-C催化剂具有最优秀的催化活性(t90=247 ℃);其良好的催化活性归因于规整有序的结构降低了催化剂的氢气还原温度、增大了其氢气消耗量,同时降低了催化剂晶格氧脱附温度,从而增强了催化剂的氧化还原性能和氧移动能力.以后希望就催化剂表面的电子转移做进一步研究.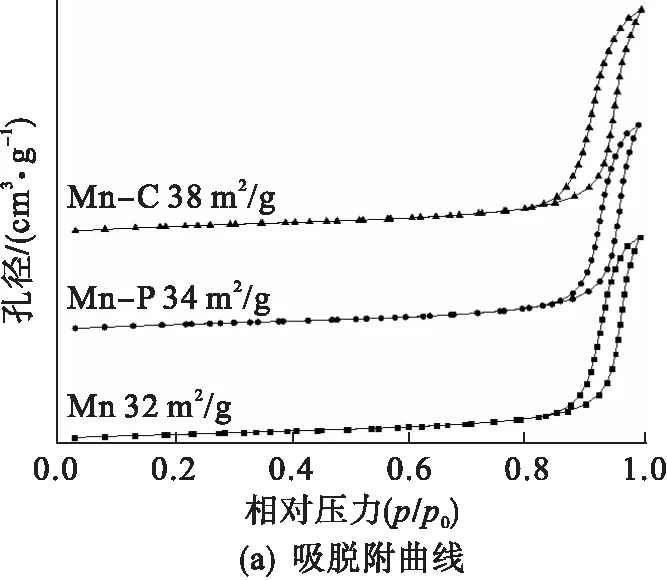

2.3 扫描电镜(SEM)结果分析

2.4 氢气程序升温还原(H2-TPR)结果分析
2.5 氧气程序升温脱附(O2-TPD)结果分析
2.6 催化氧化甲苯活性及稳定性结果分析


3 结 论
