干燥方法对印度块菌(Tuber indicum)品质的影响
2020-12-10赵立艳郑惠华胡秋辉
马 宁,仲 磊,,赵立艳,郑惠华,3,胡秋辉
(1.南京财经大学食品科学与工程学院,农业农村部食用菌加工重点实验室,江苏南京 210023;2.南京农业大学食品科学技术学院,江苏南京 210095;3.江苏安惠生物科技有限公司,江苏南通 226009)
印度块菌(TuberindicumCooke & Massee,T.indicum)是与树木共生的药食两用真菌,主要分布在我国的四川和云南两省,是我国分布最广、产量最大的块菌品种[1]。20世纪90年代以来,块菌作为我国野生食用菌最主要的贸易品种出口到欧洲市场[2]。由于印度块菌的营养丰富、香气独特,具有抗病毒、抗菌保肝、抗突变和抗炎等多种生物活性,受到了越来越多的美食和科学研究的关注[3-6]。但是印度块菌属于典型的地下外生菌根真菌,其特殊的生长环境造就了成熟块菌子囊果含有复杂而大量的微生物,未经处理的新鲜印度块菌平均保质期为10~15 d,储运过程极易失去其营养价值和商品价值[7]。所以解决好印度块菌的采后深加工问题,延长其运输和贮藏期,是我国块菌产业化发展的必由之路。
脱水干燥是一种有效延长食用菌货架期的处理手段,已经广泛应用于香菇[8]、草菇[9]、牛肝菌[10]、杏鲍菇[11]等食用菌脱水加工中。但在干燥过程中,不可避免发生营养物质的损失和食品结构的变形。因此,选择合适干燥方法对提高食用菌干制品质量至关重要。目前,自然晒干、热风干燥和真空冷冻干燥是印度块菌最常用的干燥方法[12-13]。由于不同干燥方法的干燥特性不同,对食品的质构、营养成分等指标的影响存在显著差异。自然晾干加工时间长,且产品质量差。热风干燥可以显著降低干制品品质下降风险,并促进特殊风味的生成,是延长采后食用菌货架期最常用的加工方法之一[14]。但热风干燥会引起产品营养和风味的损失,复水性能下降等问题,影响产品品质[15]。真空冷冻干燥是近年来食用菌干燥方法之一,由于干燥温度低且没有液态水,而生物活性化合物对热降解高度敏感,因此可以较好保持干燥产品生物活性[16-17]。李亚欢等[13]比较热风干燥、真空干燥和真空冷冻干燥对银耳质构品质和相关理化指标的影响,证明真空冷冻干燥的银耳质构和营养成分最佳,其次是真空干燥,热风干燥的银耳品质最差。Wu等[18]发现干燥方法对白玉蕈非挥发性风味物质有影响。但是目前针对印度块菌干燥加工方法研究极少,针对不同干燥方法对印度块菌营养成分、复水能力、质地、微观结构影响进行系统研究及方法优劣的比较也未见报道。
本研究对比热风干燥和真空冷冻干燥对印度块菌营养保留、色泽、质构、复水比和复水速率的影响,并比较两种干燥过程对印度块菌内部水分的迁移及微观结构影响,以确定适宜印度块菌加工的干燥方法,为提高印度块菌干制品加工品质提供参考。
1 材料与方法
1.1 材料与仪器
新鲜印度块菌 昆明当地市场,在4 ℃冰箱冷藏;盐酸、硫酸铜、亚甲蓝、酒石酸钾钠、氢氧化钠、乙酸锌、冰乙酸、亚铁氰化钾、硫酸钾、硼酸、乙醇、氯化铝、乙酸、乙酸钠 均为分析纯,芦丁北京索莱宝科技有限公司.
12 L真空冷冻干燥机 美国Labconco公司;101-3A电热鼓风干燥机 上海苏进仪器设备有限公司;GYX515便携式色差仪 上海嘉标测试仪器有限公司;TA XT2i质构仪 英国SMS公司;Hitachi TM3000微观扫描电镜 日本日立公司;NMI20-analyst型核磁共振分析仪 苏州(上海)纽迈电子科技有限公司。
1.2 实验方法
1.2.1 干燥方法 挑选形状规则无损伤的新鲜样品,在流水中清洗印度块菌表面的泥土,切成5 mm厚薄片,然后单层平铺装盘采用不同的方法干燥至水分达到5%(干重)以下,采用烘箱干燥法进行样品水分含量测定。装入密封袋后放入干燥器皿中保存备用。热风干燥:新鲜印度块菌片均匀单层放在电动鼓风干燥箱,60 ℃。真空冷冻干燥:新鲜印度块菌片在-24±2 ℃冻结24 h后,冻干,加热板温度40 ℃,真空压力100 Pa,冷阱温度-83±1 ℃。
1.2.2 色泽的测定 通过GYX515(便携式色差仪)对干燥样品色泽进行测定。印度块菌表面带有白色的大理石花纹,所以在测定时,不选择样品白色花纹部分,选择颜色统一的深色部分表面5个点分别进行记录,每组实验重复5次,结果通过L*(亮度/暗度)、a*(红度/绿度)、b*(蓝度/黄度)表示。
1.2.3 质构的测定 使用TA XT2i质构仪,采用Laguna等[19]方法对印度块菌干片的质构特性进行测定,其中测试参数为:触发力5 g,前速度和测试速度为1 mm/s,后速度为10 mm/s。在测试过程中,其中硬度(g)为样品破碎时上支架所需的最大的力,脆性(mm)为样品达到破碎点时上支架所移动的距离,距离越小表示样品脆性越大。每组试验重复测定8次。
1.2.4 复水特性的测定 复水比(RR)采用Doymaz等[20]的方法进行测定,称取干燥后的印度块菌样品,在70 ℃的恒温条件下复水,分别在2、5、10 min后,抽真空30 s,称重。每组试验重复3次。复水比的计算公式如下:
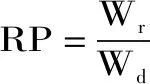
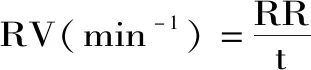
式中:Wr:样品复水后的质量(g);Wd:为样品复水前质量(g);t:复水时间(min)。

表1 不同干燥方法对印度块菌色泽和质构的影响
1.2.5 总蛋白、维生素C、还原糖及总黄酮的测定 总蛋白含量用凯氏定氮法进行测定;维生素C使用南京建成生物工程研究所生产的维生素C试剂盒测定;还原糖的测定依照菲林试剂法(GB/T 5009.7-2016)进行测量;总黄酮含量用三氯化铝比色法进行测定。所有营养成分测定结果用mg/g表示。每组试验重复3次。
1.2.6 矿物质含量的测定
1.2.7 低场核磁共振测定 低场核磁共振可用于研究干燥对样品中水分子运动性和分布的影响[21]。采用低场核磁共振仪测量干燥过程中印度块菌水分状态的变化。将大约1 g的印度块菌放置于15 mm的核磁共振检测管中,采用Carr-Purcell-Meiboom-Gill(CPMG)方法计算质子横向弛豫时间,检测参数:测量温度32 ℃,主频(SF)19 MHz,谱宽(SW)200 kHz,等待时间(TW)4000 ms,扫描次数(NS)4,90°(P1)13 μs,180°(P2)24 μs,延时时间(RFD)0.500 ms,模拟增幅(RG1)20 db,数字增幅(DRG1)3。
1.2.8 超微结构的测定 采用扫描电镜(Hitachi TM3000)观察样品超微结构。首先制备鲜样干片:新鲜的印度块菌切片置于含3%戊二醛,4 ℃,12 h。用0.1 mol/L磷酸盐缓冲液(pH7.2)洗三次,再用四氧化锇(1 g/100 g水)的磷酸盐缓冲液固定,然后用30%、50%、70%、90%和100%的乙醇梯度洗脱,每次15 min,真空冷冻干燥,待用。再将鲜样干片及两种干燥处理的印度块菌片用刀片将其切成约5 mm×5 mm×1 mm印度块菌片,取其正面和横截面分别进行离子溅射喷金,对印度块菌片表面和横截面于放大500倍和1000倍观察。
1.3 数据处理与分析
实验数据用ANOVA程序进行方差分析,当P<0.05时平均值间有显著性差异,最小显著差异法(LSD)用于数据多重比较分析。试验结果用平均值±标准差的形式表示。
2 结果与分析
2.1 不同干燥方法对印度块菌色泽和质构的影响
色泽是衡量干燥产品品质的重要参数,2种干燥处理的印度块菌色泽和质构如表1所示。从表1可以看出,热风干燥与冷冻干燥印度块菌片的色泽存在显著差异(P<0.05)。热风干燥样品,a*、b*显著高于冷冻干燥样品(P<0.05),L*显著低于冷冻干燥样品(P<0.05),说明热风干燥样品更红、更黄且更暗。与冷冻干燥比,热风干燥过程温度高,且氧气充足,更容易发生美拉德褐变反应,产品呈现更暗、更黄且更红的趋势,这与Gulsah等[22]得出了相似的结论。冷冻干燥过程氧气含量低且温度低,抑制了美拉德反应,可以更好的维持产品色泽。
质构也是评价干燥加工产品的重要的质量标准[23]。冷冻干燥产品硬度显著低于热风干燥产品(P<0.05),脆性显著高于热风干燥产品。这与Huang等[24]冷冻干燥的草莓干硬度小、脆性高的结论是一致的。这是因为在整个冷冻干燥过程中保持了多孔结构,细胞结构变化小,收缩程度低。热风干燥样品硬度高,可能与热风干燥过程中样品内部出现严重收缩和结构塌陷有关。
2.2 不同干燥方法对印度块菌复水特性影响
图1是不同干燥方法对印度块菌干制品的复水比和复水速率的影响。复水能力是评价干制品的重要指标,由图1可以看出,复水2、5、10 min后,冷冻干燥产品的复水比及复水速率显著高于热风干燥(P<0.05);并且随着复水时间的延长,复水速率降低[25]。干燥10 min后,冷冻干燥复水比为3.00,显著高于热风干燥的2.26(P<0.05),冷冻干燥复水速率0.30 min-1显著高于热风干燥0.22 min-1(P<0.05)。干燥处理使印度块菌内部发生皱缩,干燥后产品孔隙大小差异影响复水比及复水速率。冷冻干燥过程冰晶形成时对鲜印度块菌内部结构造成一定程度的破坏,所以空隙比新鲜样品大,升华干燥阶段,冰晶直接升华扩散排出,保持了多孔结构,所以冷冻干燥复水比及复水速率更高。热风干燥时,物料会失水发生收缩,并黏在一起,失水越多,造成产品表面皱缩越严重,且内部结构发生塌陷,所以降低干制品的复水能力。

图1 不同干燥方法对印度块菌复水比和复水速率的影响
2.3 不同干燥方法对印度块菌营养成分的影响
表2是新鲜印度块菌与不同干燥方法的印度块菌片营养成分分析结果。与新鲜样品比,热风干燥和冷冻干燥处理后印度块菌的总蛋白含量无显著差异(P>0.05),维生素C、还原糖和总黄酮含量显著降低(P<0.05)。鲜印度块菌的还原糖含量为9.01±1.09 mg/g DW,经干燥处理后,还原糖含量显著降低(P<0.05)。热风干燥样品及冷冻干燥样品的还原糖保留率分别为19.76%和33.85%,热风干燥样品的还原糖损失比冷冻干燥样品更多。热风干燥温度高,干燥过程发生美拉德反应及局部焦糖化等反应程度比冷冻干燥更严重,导致还原糖损失高于冷冻干燥。维生素C含量是优化脱水产品加工条件的重要指标。未处理鲜印度块菌维生素C含量为4.22±0.16 mg/g DW,冷冻干燥样品维生素C保留率比热风干燥高17.30%。可能是由于冷冻干燥过程中温度低及真空环境,而热干燥过程中,印度块菌发生了多次理化变化,导致维生素C含量显著下降(P<0.05)。鲜印度块菌的总黄酮含量为19.21±0.38 mg/g DW,经过干燥处理后,总黄酮含量显著降低(P<0.05)。热风干燥样品的总黄酮的损失率为43.94%,冷冻干燥后总黄酮损失率为20.09%,热风干燥总黄酮含量显著低于真空冷冻干燥样品(P<0.05),其原因可能是干燥过程中黄酮类化合物的流失受干燥温度和时间的影响。冷冻干燥对印度块菌营养成分保留优于热风干燥,这与Raga等[26]的研究结论一致。

表2 不同干燥方法对印度块菌片总蛋白、维生素C、还原糖及总黄酮含量(mg/g干重)的影响
2.4 不同干燥方法对印度块菌水分流动和分布的影响
水分子的迁移和分配与干燥产品质量密切相关[27]。通过低场核磁中横向弛豫时间(T2)可以反映干燥过程中样品水分迁移以及水分分布的变化[28]。图2是热风干燥与真空冷冻干燥过程中样品T2弛豫时间的变化。根据横向弛豫时间的大小,可以将横向弛豫时间分为T21、T22、T23,分别代表结合水、半结合水和自由水[29-30]。其中,新鲜样品中T22与T23的水分占了总含量97%~98%,所以干燥过程中水分状态变化主要发生在结合水和半结合水。可以从图2中看出,干燥处理会导致印度块菌弛豫时间缩短,这是因为随着干燥进行,水分减少,从而造成弛豫时间变短。同时T23中水分的信号强度随着干燥过程的进行而减少,这可能与干燥过程中自由水水分流失以及与干燥过程样品脱水收缩有关。
与热风干燥组相比,冷冻干燥处理对印度块菌的弛豫时间和水分状态影响的差异明显。从图2可以看出,冷冻干燥组T23水分信号强度衰减速率高于热风干燥组,说明印度块菌的冷冻干燥效率高于热风干燥。
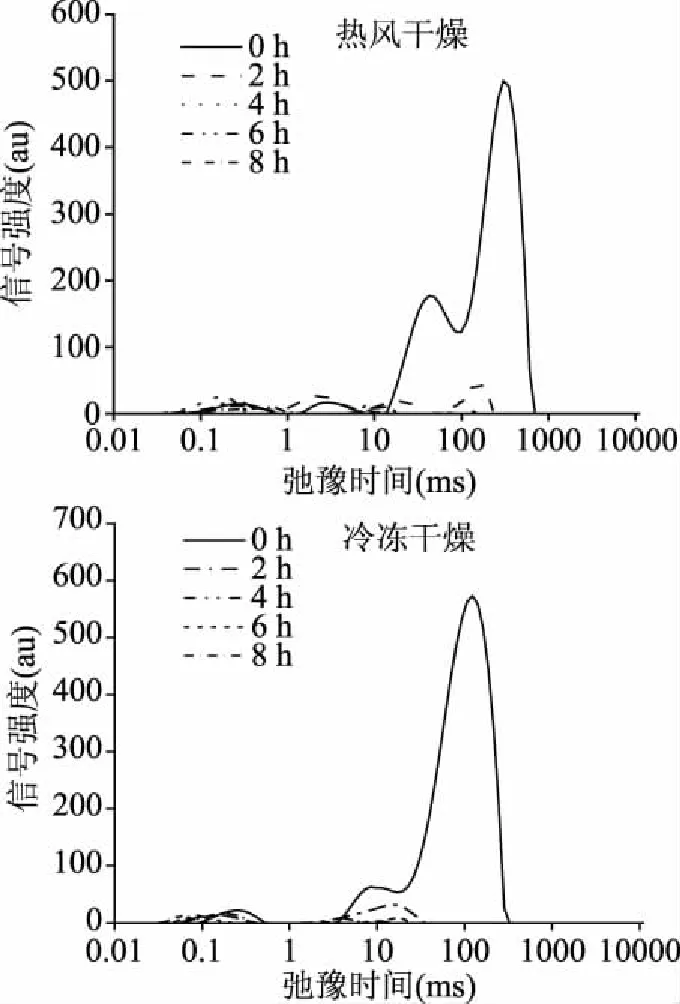
图2 不同干燥方法处理印度块菌低场核磁图谱
2.5 不同干燥方法对印度块菌微观结构的影响
为了研究不同干燥方法对印度块菌微观结构带来的变化,对新鲜印度块菌、热风干燥和冷冻干燥处理后的样品内部结构进行了扫描电镜观察,如图3所示。比较3个样品的微观结构,发现其内部构造的差异显著。新鲜印度块菌(图3a、d)内部组织结构饱满,冷冻干燥样品(图3c、f)相较于新鲜印度块菌呈多孔、蜂窝状外观,说明冷冻干燥可以更好保持多孔细胞结构。而热风干燥样品(图3b、c)比冷冻干燥有更多的细胞组织收缩和塌陷且结构很致密。冷冻干燥过程,内部组织保持较好并出现较大的空隙,这也是冷冻干燥产品具有硬度小、脆性高,并具有最高复水比及复水速率的主要原因。而热风干燥过程水分蒸发较快,且外表面温度高,造成表面硬化,这与热风干燥样品硬度高,脆性小且复水比小的结论相一致[25]。
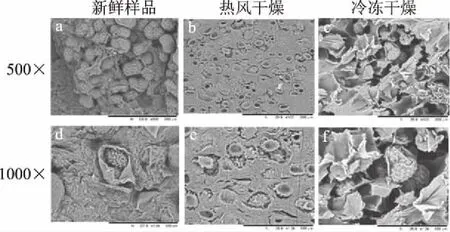
图3 新鲜印度块菌及不同干燥方法 处理印度块菌片微观结构扫描图
3 结论
研究发现,两种方法干燥印度块菌片在色泽、复水比、质构和微观结构均有明显差异。与冷冻干燥比,热风干燥组产品颜色更暗,复水比和复水速率低,硬度高且脆度低,微观组织结构破坏严重,皱缩坍塌,质构特性较差。热风干燥产品维生素C、还原糖、总黄酮保留量显著低于冷冻干燥产品(P<0.05)。综合分析,冷冻干燥可加工出外观好、营养保留量高的印度块菌干品,是适合印度块菌脱水加工的干燥方式。
