干旱胁迫下野生大豆bHLH家族转录组分析
2020-12-09俎天娇乔潇张小芳张锴乔亚科李桂兰
俎天娇 乔潇 张小芳 张锴 乔亚科 李桂兰


摘要:为获取干旱胁迫状态下的bHLH家族相关基因,以30 d苗龄的野生大豆为试验材料,浇灌20% PEG-6000模拟干旱胁迫,分别在干旱处理后0、6、12、24、48 h取样提取叶片RNA并进行转录组测序。以基因本体论数据库(GO)、京都基因与基因组百科全书数据库(KEGG)、NCRI蛋白数据库(NR)注释的结果为基础,以bHLH转录因子为关键词进行筛选,再综合转录因子分析中提供的相关数据,共获得177条相关序列,包括64个bHLH家族成员。通过蛋白网络互作分析确定了4个干旱相关基因。为进一步研究野生大豆干旱胁迫下bHLH家族抗旱基因提供了理论基础。
关键词:野生大豆;转录组;干旱胁迫;bHLH;显著差异表达基因;转录因子
中图分类号:S565.101 文献标志码: A
文章编号:1002-1302(2020)19-0024-06
收稿日期:2019-11-29
基金项目:河北省自然科学基金(编号:C2019407006);国家转基因重大专项(编号:2014ZX0800404B)。
作者简介:俎天娇(1997—),女,河北邯郸人,硕士研究生,主要从事植物遗传资源及植物分子生物学研究。E-mail:947119850@qq.com。
通信作者:李桂兰,博士,教授,主要研究方向为作物遗传资源及作物基因工程。E-mail:lgl63@126.com。
干旱胁迫是植物普遍存在的非生物胁迫之一[1],栽培大豆是豆类作物中对缺水最敏感的一种,缺水对栽培大豆产量和品质会产生巨大影响[2]。野生大豆在抗逆性方面要优于栽培大豆,较栽培大豆具有更多的抗逆基因[3-4],为栽培大豆抗旱育种提供了重要的种质资源。
bHLH转录因子家族是真核生物中广泛存在的转录因子家族之一,对真核生物的生长发育、新陈代谢和逆境胁迫等方面均有作用[5]。该家族基因成员较多,多数研究都是针对整个家族进行开展的[6],目前除熟知的模式生物和作物[6-9]外,在黄芩[10]、沙冬青[11]、樱桃[12]中也有研究,但在豆科植物中的研究[13]尤其是逆境胁迫下的bHLH转录因子家族的报道较少。
随着高通量测序技术的发展,通过转录组测序来获取差异表达基因已成为一种新的研究方法[14-17],目前,已从不同研究角度对大豆或野生大豆基因进行了挖掘与分析[18-19]。本研究以30 d苗龄的野生大豆为材料,对全转录组进行测序,以bHLH转录因子为关键词进行筛选,并结合测序公司的转录因子分析结果,从功能注释、蛋白进化和互作等角度对序列进行分析,探讨bHLH转录因子与干旱之间的关系。
1 材料与方法
1.1 试验材料
供试野生大豆的种子采自河北省东部沿海地区昌黎县,试验所用材料为野生大豆永46的30 d苗龄幼苗;聚乙二醇(PEG6000)购自天津博美科生物技术有限公司。
1.2 轉录组测序
在野生大豆苗龄达30 d时,取未处理(0 h)及加入20% PEG-6000处理后6、12、24、48 h的同一个叶位复叶,并提取叶片总RNA。所得RNA经琼脂糖凝胶电泳检测合格后送至深圳华大基因科技有限公司进行测序,具体步骤参考张小芳等的方法[20]。
1.3 功能注释及ABC转运蛋白关键词搜索
将测序结果通过BLAST比对到公共数据库,包括NCBI蛋白数据库(NR)、基因本体论数据库(GO)、京都基因与基因组百科全书数据库(KEGG),之后以bHLH转录因子为关键词进行筛选,综合转录因子分析中提供的数据,最终获得bHLH转录因子家族的相关序列信息。
1.4 蛋白互作网络构建
String(https://string-db.org/)是研究蛋白-蛋白作用的在线生物网站。将表达差异基因导入该网站,获得蛋白互作数据,再通过Cytoscape对结果进行可视化分析。
2 结果与分析
2.1 bHLH转录因子家族基因簇注释信息
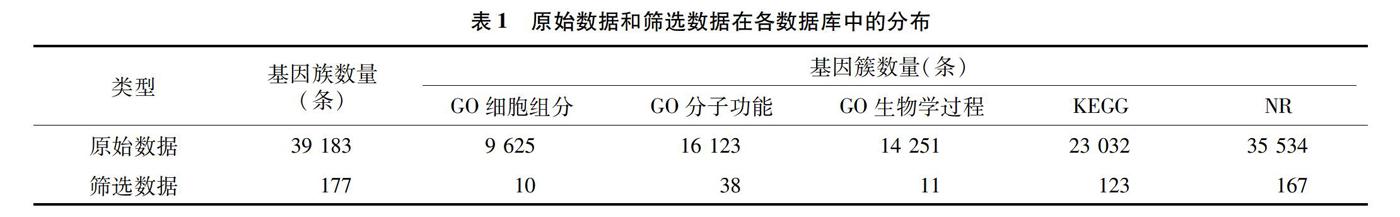
以bHLH转录因子为关键词对获得的转录组原始数据进行搜索,结合转录因子分析中提供的数据,共获得了177条基因簇。这些基因簇的表达量FPKM值介于0~143.6之间,表达量在0~1 282.31之间。具体注释情况见表1。这些被注释的基因簇中,在GO中,被注释到细胞组分、分子功能和生物学过程中的分别有10、38、11条;在与NR比对时,只有10条基因簇无注释。
2.2 bHLH转录因子显著差异表达基因统计分析
通过显著差异表达基因(differentially expressed genes,DEGs)的上调表达及下调表达情况可以了解样本间的差异概况。对获取的基因簇信息进行差异表达基因筛选,这些差异表达基因在不同处理时间点的两两对比情况见表2。以未处理材料作为参照,上/下调基因随处理的时间延长而减少。
2.3 bHLH转录因子显著差异表达基因功能分析
2.3.1 GO功能分析
GO富集分析可将差异表达基因分为3类。由图1可知,差异表达基因分属于2个细胞组分、7个分子功能和16个生物学过程中,主要富集于胞内带膜细胞器(9个)、结合蛋白活性上(30个)。生物学过程的注释项目最多,且各注释项目分布较离散,富集因子在3个以上的仅有细胞形态建成、转录、激素响应、红光和远红光响应以及分生组织分化。
2.3.2 KEGG富集分析
KEGG可以把从已经完整测序的基因组中得到的基因目录与更高级别的细胞、物种和生态系统水平的系统功能关联起来。
基于KEGG富集分析,共建成了4条通路,分别为K10798(poly[ADP-核糖]聚合酶)、K10863(aprataxin,APTX)、K12126(光敏色素作用因子3)和K13422(转录因子MYC2),各通路包含的差异基因数量分别为1、22、45、73个。包含注释基因最多的K13422同时参与了植物激素信号转导途径(图2)和丝分裂原活化蛋白激酶途径(图3),主要参与了单萜类生物合成、吲哚生物碱的生物合成、衰老、防御反应、伤害刺激和根部生长等过程。
2.3.3 NR聚类分析
NR即非冗余蛋白库,在该数据库中有注释差异表达基因可以获得对应的蛋白序列数据。通过对蛋白序列进行汇总,可以按该数据库有注释的差异表达基因将蛋白分为64个bHLH转录因子家族成员。用邻接法对差异表达基因进行分析,可将具有蛋白序列注释的基因分为64个分类(图4)。在这些分类中,自成1类的包括BEE3、bHLH35、bHLH149、bHLH90、bHLH128,除此之外,还有15个bHLH转录因子家族成员的注释为1个,但未单独分类;bHLH25和bHLH18的注释超过10个,但由于蛋白存在不同的亚型,并非所有的同一家族成员都聚在一类中;bHLH36与MYC2聚在一类;bHLH47与bHLH66、bHLH82聚在一类;bHLH67和bHLH70聚在一类;bHLH84与bHLH71聚在一类;bHLH91与CBF3聚在一类;bHLH111与bHLH130聚在一类;bHLH120与bHLH131聚在一类;bHLH126与bHLH18聚在一类;bHLH143与bHLH086聚在一类;bHLH144与bHLH13聚在一类;bHLH147与bHLH140聚在一类;bHLH148与bHLH106聚在一类;其他参与注释的bHLH转录因子家族成员还包括bHLH3、bHLH122、bHLH30、bHLH135、bHLH93、bHLH87、bHLH68等。
2.4 bHLH轉录因子差异基因蛋白互作分析
为了进一步从蛋白水平对bHLH转录因子家族差异表达基因的生物学功能和调控作用进行研究,构建蛋白互作网络图(图5)。在众多差异表达基因中,有15个存在蛋白互作关系,根据互作网络的作用关系,从中选出了GLYMA01G23230.1(FAMA)、GLYMA08G36590.1(bHLH71)、GLYMA09G33730.2(MYC2)、GLYMA17G10740.1(bHLH47)这4个蛋白,可将其对应的基因作为干旱胁迫的候选基因。
3 讨论与结论
bHLH转录因子家族是植物第二大类转录因子家族[21],具有典型的碱性螺旋-环-螺旋结构域,不仅参与了植物体内气孔发育[22]和激素信号传导[23]等过程,而且在植物响应干旱[24]、高盐[25]、脱落酸(ABA)[26]、缺铁[27]和低温[28]等非生物胁迫过程中也发挥着重要作用。如AtbHLH122显著受干旱的诱导[29],AtbHLH68参与拟南芥体内ABA的合成[30];Ghb HLH130在逆境胁迫条件下,显著受干旱和ABA胁迫的诱导[31],OsbHLH148[32]、PebHLH35[33]的过表达增加了植物的耐旱性。
FAMA是气孔发育的关键转录因子,调控气孔母细胞的分裂。FAMA突变体会产生不成熟的气孔,进而影响气孔的闭合,对水分的控制能力减弱[33];在对干旱条件下的bHLH转录因子家族进行分析时发现,FAMA可以同时与bHLH71、bHLH93互作,bHLH71和bHLH93之间也有互作;目前对bHLH71尚未见报道,推测bHLH93与甾醇合成有关[9],具体功能机制还有待进一步研究。
MYC2是MYC类转录因子中研究最深的,在植物受到环境胁迫时,一方面,可以启动JA基因的表达,另一方面,有研究表明,MYC2转录因子对于植物抗氧化能力发挥重要的正调控作用[34-35]。在本研究中,注释到的MYC类转录因子在模拟干旱处理12 h时表达量变化倍数最多的可达7倍以上,最少的也可达2倍,且MYC类转录因子间存在相互作用。
另外1组存在蛋白互作的转录因子是bHLH47与bHLH104。在蛋白序列聚类分析时,bHLH47与bHLH66、bHLH82聚在一类,目前关于bHLH47的报道尚不多见,Bruex等对拟南芥根表皮细胞进行转录组分析时,同时注释到了bHLH66和bHLH82,发现它们对根毛伸长有重要作用[36]。对bHLH104的研究报道主要集中在金属镉胁迫[37]和调控铁平衡[38]方面,关于其干旱胁迫响应功能尚未见报道。
野生大豆永46在干旱胁迫下差异表达的bHLH转录因子家族基因丰富,本研究共获得177条相关序列,包括64个bHLH家族成员。在处理 6 h 时,注释的差异表达基因最多,且差异在5倍以上基因最多;在GO分析中,生物学过程注释最为丰富;通过进一步的蛋白进化树和蛋白网络互作分析最终得到4个候选基因。
参考文献:
[1]徐立明,张振葆,梁晓玲,等. 植物抗旱基因工程研究进展[J]. 草业学报,2014,23(6):293-303.
[2]曹秀清,蒋尚明. 干旱胁迫对大豆品质及产量的影响[J]. 现代农业科技,2017(16):3-4,7.
[3]Kim M Y,Lee S,Van K,et al. Whole-genome sequencing and intensive analysis of the undomesticated soybean (Glycine soja Sieb. and Zucc.) genome[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(51):22032-22037.
[4]Lam H M,Xu X,Liu X,et al. Resequencing of 31 wild and cultivated soybean genomes identifies patterns of genetic diversity and selection[J]. Nature Genetics,2010,42(12):1053-1059.
[5]王 翠,兰海燕. 植物bHLH转录因子在非生物胁迫中的功能研究进展[J]. 生命科学研究,2016,20(4):358-364.
[6]刘文文,李文学. 植物bHLH转录因子研究进展[J]. 生物技术进展,2013,3(1):7-11.
[7]刘文婷. 转录因子OsbHLH35在水稻抗褐飛虱中的功能研究[D]. 福州:福建农林大学,2018.
[8]赵小波,闫彩霞,张 浩,等. 干旱胁迫下花生差异表达转录因子家族分析[J]. 农业生物技术学报,2018,26(7):1143-1154.
[9]武明珠,李 锋,王 燃,等. 烟草转录因子bHLH93基因的克隆及表达分析[J]. 烟草科技,2015,48(3):1-7.
[10]陈媞颖,刘 娟,袁 媛,等. 黄芩bHLH转录因子基因家族生物信息学及表达分析[J]. 中草药,2018,49(3):671-677.
[11]金 曼,苏彦华. 沙冬青响应非生物胁迫的转录因子基因鉴定与分析[J]. 植物资源与环境学报,2018,27(1):1-10.
[12]应炎标,朱友银,郭卫东,等. 樱桃bHLH转录因子家族基因鉴定及表达分析[J]. 分子植物育种,2018,16(14):4559-4568.
[13]陈红霖,胡亮亮,王丽侠,等. 绿豆bHLH转录因子家族的鉴定与生物信息学分析[J]. 植物遗传资源学报,2017,18(6):1159-1167.
[14]马 进,郑 钢. 利用转录组测序技术鉴定紫花苜蓿根系盐胁迫应答基因[J]. 核农学报,2016,30(8):1470-1479.
[15]苏稚喆,王雪华,杨 华,等. 镉胁迫下麻疯树转录组测序分析[J]. 中国生物工程杂志,2016,36(4):69-77.
[16]王 洋. NaHCO3模拟盐碱混合胁迫下野生大豆转录组研究[D]. 哈尔滨:东北农业大学,2014.
[17]Zhang J L,Wang J X,Jiang W,et al. Identification and analysis of NaHCO3 stress responsive genes in wild soybean (Glycine soja) roots by RNA-seq[J]. Frontiers in Plant Science,2016,7(106):1842.
[18]Yuan S,Li R,Chen S L,et al. RNA-Seq analysis of differential gene expression responding to different rhizobium strains in soybean (Glycine max) roots[J]. Frontiers in Plant Science,2016,7:721.
[19]Shi G X,Huang F Gong Y,et al. RNA-Seq analysis reveals that multiple phytohormone biosynthesis and signal transduction pathways are reprogrammed in curled-cotyledons mutant of soybean[Glycine max (L.) Merr.][J]. BMC Genomics,2014,15(1):510.
[20]张小芳,王冰冰,徐 燕,等. PEG模拟干旱胁迫下野生大豆转录组分析[J]. 大豆科学,2018,37(5):681-689.
[21]Xu W,Dubos C,Lepiniec L. Transcriptional control of flavonoid biosynthesis by MYB-bHLH-WDR complexes[J]. Trends in Plant Science,2015,20(3):176-185.
[22]Bhave N S,Veley K M,Nadeau J A,et al. Too many mouths promotes cell fate progression in stomatal development of Arabidopsis stems[J]. Planta,2009,229(2):357-367.
[23]Zhang L Y,Bai M Y,Wu J X,et al. Antagonistic HLH/bHLH transcription factors mediate brassinosteroid regulation of cell elongation and plant development in rice and Arabidopsis[J]. The Plant Cell,2009,21(12):3767-3780.
[24]Seo J S,Joo J,Kim M J,et al. OsbHLH148,a basic helix-loop-helix protein,interacts with OsJAZ proteins in a jasmonate signaling pathway leading to drought tolerance in rice[J]. Plant Journal,2011,65(6):907-921.
[25]陈李淼,沙爱华,张婵娟,等. 一个大豆脱水胁迫响应的bHLH类转录因子的克隆及功能分析[J]. 中国油料作物学报,2013,35(6):630-636.
[26]Abe H,Urao T,Ito T,et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2 (MYB) function as transcriptional activators in abscisic acid signaling[J]. The Plant Cell,2003,15(1):63-78.
[27]Li X L,Zhang H M,Ai Q,et al. Two bHLH transcription factors,bHLH34 and bHLH104,regulate Iron homeostasis in Arabidopsis thaliana[J]. Plant Physiology,2016,170(4):2478-2493.
[28]Chinnusamy V,Ohta M,Kanrar S,et al. ICE1:a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes & Development,2003,17(8):1043-1054.
[29]Liu W W,Tai H H,Li S S,et al. bHLH122 is important for drought and osmotic stress resistance in Arabidopsis and in the repression of ABA catabolism[J]. New Phytologist,2014,201(4):1192-1204.
[30]Hir R L,Castelain M,Chakraborti D A,et al. AtbHLH68 transcription factor contributes to the regulation of ABA homeostasis and drought stress tolerance in Arabidopsis thaliana[J]. Physiologia Plantarum,2017,160(3):312-327.
[31]光杨其,宋桂成,张金凤,等. 1个新棉花bHLH类基因GhbHLH130的克隆及表达分析[J]. 棉花学报,2014,26(4):363-370.
[32]Chung Y G,Koo L Y,Kim Y,et al. Methyl jasmonate reduces grain yield by mediating stress signals to alter spikelet development in rice.[J]. Plant Physiology,2009,149(4):1751-1760.
[33]Ohashi-Ito K,Bergmann D C. Arabidopsis FAMA controls the final proliferation/differentiation switch during stomatal development[J]. The Plant Cell,2006,18(10):2493-2505.
[34]韩 笑. 茉莉酸信号途径调控拟南芥子叶下表皮气孔发育的研究[D]. 昆明:云南大学,2015.
[35]沈 乾,陆 续,张 凌,等. 植物中MYC2轉录因子功能研究进展[J]. 上海交通大学学报(农业科学版),2012,30(6):51-57.
[36]Bruex A,Kainkaryam R M,Wieckowski Y,et al. A gene regulatory network for root epidermis cell differentiation in Arabidopsis[J]. PLoS Genetics,2012,8(1):e1002446.
[37]Yao X N,Cai Y R,Yu D Q et al. bHLH104 confers tolerance to cadmium stress in Arabidopsis thaliana[J]. Journal of Integrative Plant Biology,2018,60(8):691-702.
[38]李晓丽. 拟南芥转录因子bHLH34和bHLH104调控铁平衡[D]. 合肥:中国科学技术大学,2016.
