芦蒿总黄酮的提取工艺优化及抗炎活性研究
2020-12-09吴雨龙江海涛张艺鏻汪振炯王仁雷
吴雨龙,江海涛,张艺鏻,汪振炯,王仁雷,华 春,*
(1.南京晓庄学院食品科学学院,江苏南京 211171;2.江苏省高校“特殊生物质废弃物资源化利用”重点建设实验室,江苏南京 211171;3.江苏第二师范学院,江苏南京 210013)
芦蒿(ArtemisiaselengensisTurcz.)为菊科蒿属植物,又名藜蒿、蒌蒿等,在中国南方被大面积种植,是一种比较流行的蔬菜[1-2]。芦蒿不但营养丰富,而且还常被用来制作饮料、茶和发酵酸奶[3]。现代研究发现,芦蒿富含黄酮、多糖等多种生物活性物质[4-6],在抗氧化、抗肥胖、抗炎、抗肿瘤和免疫调节等方面都表现出了较好的生物活性[7-9],其综合开发利用变得十分有意义。
炎症是机体对有害刺激的防御反应,是去除外源刺激和组织损伤的重要过程[10],与许多疾病密切相关,如糖尿病、皮炎、关节炎、肥胖以及肿瘤[11-13]。抑制炎症可以极大的抑制相关疾病的进展,也是治疗炎症及相关疾病的早期手段,筛选新型抗炎药物对防治炎症及相关疾病具有十分重要的意义[14]。目前,有关芦蒿总黄酮提取工艺的研究多采用传统的醇提工艺,提取效率不高[15-18],且有关芦蒿总黄酮提取物抗炎活性的研究尚未见报道。本试验利用复合酶协同超声波法,采用响应曲面分析法中的CCD法优化芦蒿总黄酮的提取工艺条件,并研究芦蒿总黄酮提取物对LPS诱导的RAW264.7巨噬细胞NO分泌的影响,为综合开发利用芦蒿,提高其附加值以及临床应用提供可靠的理论依据。
1 材料与方法
1.1 材料与仪器
芦蒿 购自南京八卦洲芦蒿种植基地,烘干后粉碎备用;小鼠巨噬细胞RAW 264.7 上海生命科学研究院提供;芦丁标准品(≥99%) 上海源叶生物有限公司;纤维素酶(酶比活力400 U/mg)、果胶酶(酶比活力500 U/mg) 南京晶格生物科技有限公司;脂多糖(LPS) Sigma公司;二甲基亚砜(DMSO) 国药集团化学试剂有限公司;高糖DMEM培养液、胎牛血清 赛默飞世尔生物化学制品有限公司;一氧化氮试剂盒 南京建成生物工程研究所;其它试剂 均为分析纯。
KQ.250B超声波清洗仪 江苏省昆山市超声仪器有限公司;RE-3000旋转蒸发器、SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;FreeZone2.5台式冷冻干燥机 美国Labconco公司;ST40R高速冷冻离心机 美国热电公司;JA3003N型电子天平 上海精密科学仪器有限公司;T6紫外可见分光光度计 北京普析通用仪器有限责任公司;CKS53荧光倒置显微镜 日本OLYMPUS公司;HERAcell150i细胞培养箱 美国Thermo公司;B2型生物安全柜 新加坡ESCO科技有限公司;SYNERGY/HTX全波段酶标仪 美国BioTek公司。
1.2 实验方法
1.2.1 芦丁标准曲线的绘制 参考文献[19]方法并做适当调整:精密称取干燥恒重的芦丁标准品10 mg溶于体积分数70%的乙醇溶液中,定容至100 mL,混匀,得0.1 mg/mL的芦丁标准溶液。依次取0、1.0、2.0、3.0、4.0、5.0 mL芦丁标准品溶液,分别置于10 mL容量瓶中。先向各容量瓶中加入5%的亚硝酸钠溶液0.6 mL,摇匀,静置6 min;再分别加入10%的硝酸铝溶液0.6 mL,摇匀,静置6 min;接着分别加入4%的氢氧化钠4 mL,摇匀,静置15 min;最后分别加入70%的乙醇定容至10 mL,静置15 min。以空白作为对照,在510 nm处测定各吸光度。以芦丁质量浓度为横坐标,吸光度为纵坐标绘制标曲,得回归方程为:Y=13.1000X-0.0063,R2=0.9996。
1.2.2 芦蒿总黄酮的提取及得率测定 一定量的芦蒿置于50 ℃恒温干燥箱中烘干至恒重,经粉碎机粉碎,过60目筛,得芦蒿粉末,准确称取芦蒿粉末10.00 g,加一定体积分数和体积的乙醇溶液,再加一定量的复合酶,调节pH至4.5,酶解一段时间,90 ℃灭酶10 min,一定温度下超声处理一段时间,再回流提取一定时间后,提取液离心(4500 r/min,10 min)取上清,上清置于4 ℃冰箱保存,取1.00 mL上清液按1.2.1方法测定吸光度并计算芦蒿总黄酮(ATTF)得率,计算公式如下:
式中:C为芦蒿总黄酮提取液的质量浓度(mg/mL);V为样品定容体积(mL);N为测定时样液的稀释倍数;M为芦蒿粉末的质量(g)。
1.2.3 单因素实验 以乙醇为提取溶剂,固定乙醇体积分数为70%、复合酶(纤维素酶:果胶酶)配比为1∶1 (g/g)、复合酶用量为1.5%、液料比为40∶1 (mL/g)、酶解时间为1.5 h、超声时间为30 min、超声功率为50 W、超声温度40 ℃、提取时间为1.5 h时,分别考察不同超声温度(20、30、40、50、60、70 ℃)、酶解时间(0.5、1.0、1.5、2.0、2.5、3.0 h)、复合酶用量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、液料比(10∶1、20∶1、30∶1、40∶1、50∶1、60∶1 (mL/g))、超声时间(10、20、30、40、50、60 min)、复合酶配比(3∶2、3∶1、1∶1、2∶3、1∶3 (g/g))、超声功率(40、50、60、70、80、90 W)、乙醇体积分数(40%、50%、60%、70%、80%、90%)和提取时间(0.5、1.0、1.5、2.0、2.5、3.0 h)对ATTF得率的影响,各实验重复三次。
1.2.4 响应面法优化提取工艺设计 在单因素实验结果的基础上,采用CCD设计方法[5],以超声温度、复合酶用量、乙醇体积分数和液料比为自变量,以ATTF得率为响应值设计试验,并采用响应面分析法来分析各因素之间的交互作用,以确定最佳的工艺条件。试验因素和水平见表1。
1.2.5 小鼠RAW 264.7巨噬细胞的培养 小鼠RAW264. 7巨噬细胞按常规方法[20]复苏,培养于含10%胎牛血清的高糖DMEM培养液中,置37 ℃细胞培养箱中培养。当细胞贴壁率达到90%左右开始传代,取对数生长期的细胞用于试验。
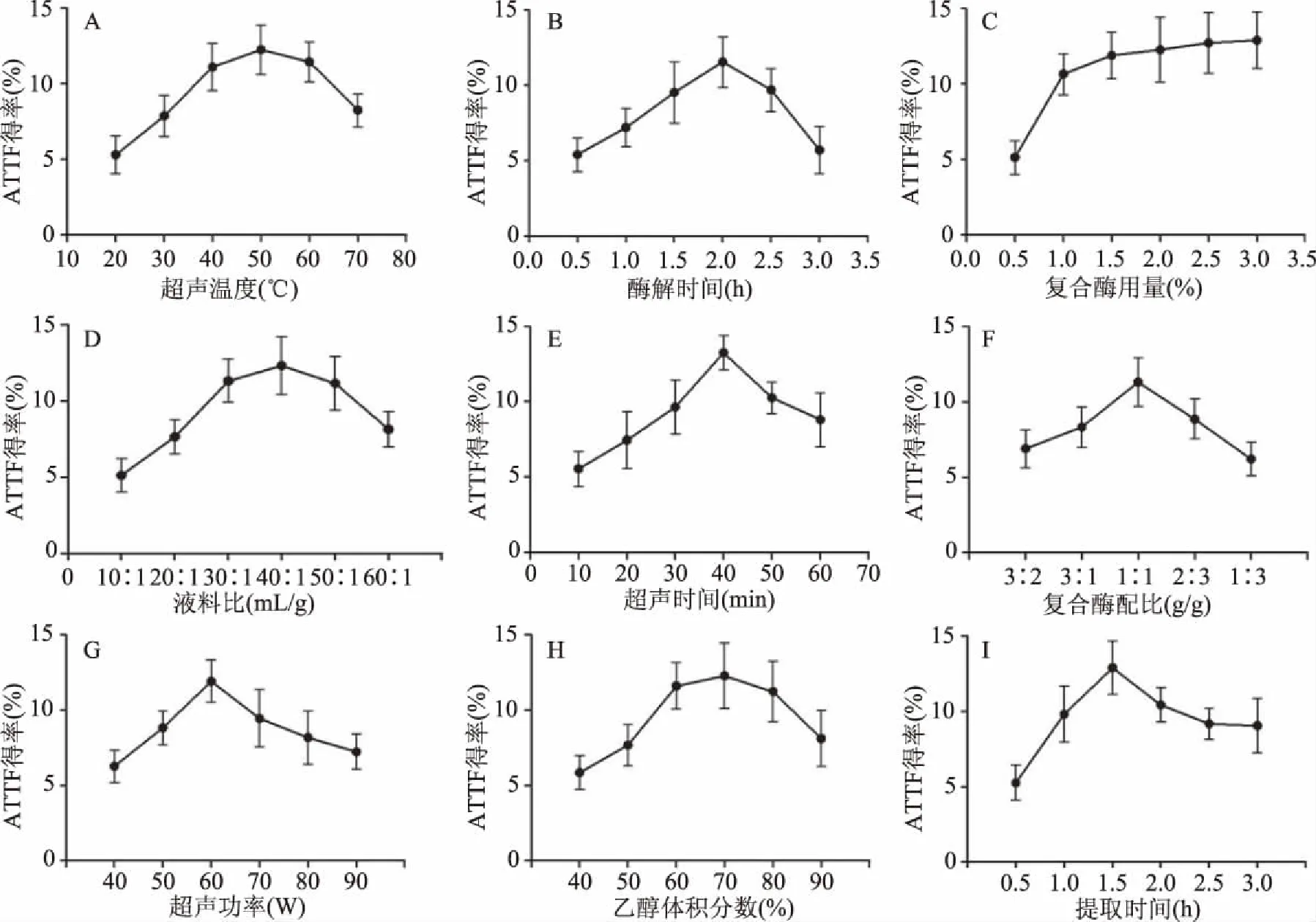
图1 不同因素对ATTE得率的影响
1.2.6 ATTF对LPS诱导的RAW264. 7巨噬细胞分泌NO的影响 用胰蛋白酶消化对数生长期的RAW264. 7巨噬细胞后,用细胞培养液稀释细胞浓度至2×105个/mL,接种到96孔培养板,每孔200 μL,分成空白组、模型组和ATTF低、中、高5个组。空白组不加ATTF预处理,也不加LPS进行诱导;模型组不加ATTF预处理,但加LPS进行诱导;ATTF低、中、高3个剂量组加ATTF预处理,使得ATTF的终浓度分别为50、100、200 μg/mL,预处理2 h后,相应各组加入LPS(1 μg/mL),置于37 ℃细胞培养箱中培养24 h,各组重复5孔。24 h后取各组细胞培养上清液,按NO试剂盒使用说明操作,在540 nm处测定OD值,计算样品中NO的含量。
1.3 数据处理
采用Graphpad prism 6.0对数据进行处理和分析,并采用Design-Expert 8.0软件对响应面试验结果进行分析,根据F值考察二次回归模型及因素的显著性(P<0.05)。采用SPSS1010 软件进行分析,试验结果以均值±标准误差表示,并进行t 检验,显著性水准为α=0.05。
2 结果与分析
2.1 单因素实验结果
由图1A可知,ATTF得率随着超声温度的升高先上升后缓慢下降。究其原因,可能是随着超声温度的升高,分子热运动加快,提取液中的微小气泡增多,空化作用增强,芦蒿细胞破裂加速,但当超声温度过高时,气泡中的蒸气压太高,响应声场的作用变得缓和,空化作用减弱[21]。当温度为50℃时ATTF得率达到最高。
由图1B可知,ATTF得率一开始随着酶解时间的延长先提高后开始下降。分析原因,可能是刚开始酶的底物比较充足,但当底物不断减少直至酶解反应结束,酶解时间继续延长,其它因素对黄酮类化合物造成影响[22]。当酶解时间为2.0 h时,ATTF得率达最高。
由图1C可知,ATTF得率随着添加的复合酶量的增加而不断提高。原因可能是由于芦蒿细胞的细胞壁含大量纤维素和果胶,经复合酶酶解后导致细胞壁被破坏,从而使得黄酮类化合物快速溶出;由于底物的量是一定的,当加酶过多时由于没有反应底物,从而使得ATTF得率维持在稳定的水平[23]。当加酶量超过2.0%后,随着加酶量的增加,ATTF得率的增加趋于平缓。
由图1D可知,ATTF得率随着液料比的增加先提高后下降。究其原因,可能是液料比越大,即溶剂用量越大,越有利于ATTF的溶出,但当液料比超过一定值后,随着溶剂用量的增加,会造成单位提取液中ATTF浓度的降低,也会造成试剂的浪费和能耗的增加[24]。当液料比达40∶1时,ATTF得率达最大值。
由图1E可知,ATTF得率随超声处理时间的延长先上升后下降,原因可能是在提取初期超声波波的空化作用使得芦蒿细胞大量破裂,ATTF持续溶出,提取率随时间增加而上升;40 min后,由于长时间超声波处理,持续的空化和机械振动使得体系中颗粒溶出量增多,部分黄酮类化合物被吸附[25]。因此,在超声时间为40 min时,ATTF得率最高。
由图1F可知,ATTF得率随复合酶(纤维素酶/果胶酶)的配比的变化先上升后下降。可能是由于芦蒿细胞壁中纤维素和果胶含量比较接近,相同配比的两种酶有利于更好的破壁。结果在复合酶配比为1∶1时ATTF得率为最高。
由图1G可知,ATTF得率随超声功率的增大先提高后降低。原因可能是超声波与介质相互作用的程度和提取物的性质相关。ATTF得率在超声功率达60 W时达最高。
由图1H可知,ATTF得率随乙醇体积分数的增加先提高后缓慢降低。可能是乙醇体积分数增大,醇溶性杂质增加,影响提取物有效含量;也可能是乙醇体积分数过高,沸点下降,挥发过大,脂溶性成份与黄酮类化合物竞争与乙醇结合[19]。乙醇体积分数为70%时ATTF得率达最高。
由图1I可知,ATTF得率随提取时间的延长快速升高后缓慢降低。究其原因,可能是由于提取时间过长,提取溶剂中其他因素的改变,影响了ATTF的稳定性,甚至造成结构破坏[19]。ATTF得率在提取时间为1.5 h时达最高。
根据单因素试验结果,确定ATTF提取的酶解时间为2.0 h、超声时间为40 min、复合酶配比为1∶1 (g/g)、超声功率为60 W、提取时间为1.5 h,对于无法明显判定最优得率的超声温度、复合酶用量、乙醇体积分数和液料比四种因素进行响应面分析。
2.2 响应面试验结果分析
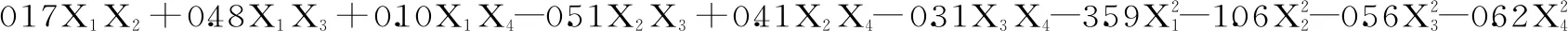

表2 响应面试验设计与结果

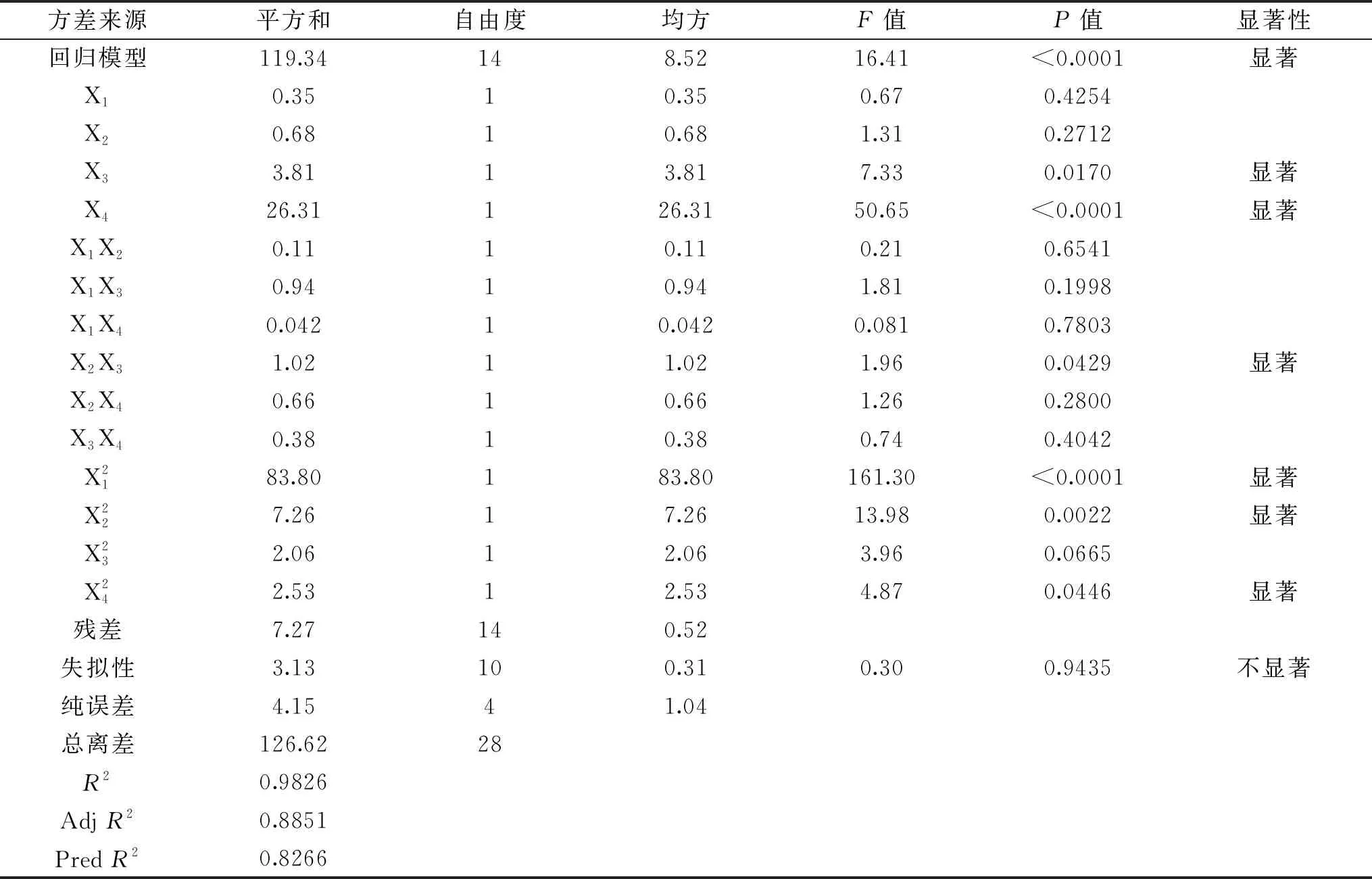
表3 芦蒿多糖得率回归模型方差分析表
2.2.2 ATTF得率响应面两因素交互作用分析 由图2A可知,当超声温度一定时,ATTF得率随乙醇体积分数的升高呈先上升后下降的趋势;当乙醇体积分数一定时,ATTF得率随超声温度的升高同样呈先上升后下降的趋势,且二者有明显的交互作用。由图2B可知,当复合酶用量一定时,ATTF得率随乙醇体积分数的升高呈先上升后下降的趋势;当乙醇体积分数一定时,ATTF得率随复合酶量的增加而上升。由图2C可知,当液料比一定时,ATTF得率随乙醇体积分数的升高呈先上升后下降的趋势;当乙醇体积分数一定时,ATTF得率随液料比的增加而上升。由图2D可知,当复合酶用量一定时,ATTF得率随超声温度的升高而降低;当超声温度一定时,ATTF得率随复合酶用量的增加而上升。由图2E可知,当液料比一定时,ATTF得率随超声温度的升高先上升后下降;当超声温度一定,ATTF得率随液料比的增大而上升。由图2F可知,当复合酶用量一定时,ATTF得率随液料比的增加而上升;当液料比一定时,ATTF得率随复合酶用量的增加而上升。

图2 ATTF得率两因素交互影响的响应面图
2.2.3 ATTF最佳提取工艺条件的确定和验证 根据二项回归模型的预测,得出ATTF最佳提取工艺条件为超声温度49.78 ℃、复合酶用量1.54%、乙醇体积分数70.49%、液料比40.56∶1 (mL/g)。考虑到实际操作的便利性,修正ATTF最佳提取工艺条件为超声温度50 ℃、复合酶用量1.5%、乙醇体积分数70%、液料比40∶1 (mL/g),加上在单因素实验中确定的条件:酶解时间为2.0 h、超声时间为40 min、复合酶配比为1∶1 (g/g)、超声功率为60 W、提取时间为1.5 h,综合上述条件下,ATTF的实际得率为13.09%±2.13%,与预测得率13.16%接近,表明该模型与实际情况拟合较好,可以用来预测试验结果,可以作为ATTF提取工艺的回归分析和参数优化。
2.3 ATTF提取物对LPS诱导的RAW264. 7巨噬细胞分泌NO的影响
由图3可知,模型组与空白组相比,差异极显著(P<0.01),模型组NO的含量显著(P<0.05)增加,说明由LPS诱导RAW264.7巨噬细胞建立的炎症细胞模型成功;ATTF提取物低剂量组NO的含量与模型组相比无显著性差异,说明ATTF提取物低剂量组不能抑制由LPS诱导RAW264.7巨噬细胞NO的分泌,说明ATTF提取物低剂量组不具备抗炎活性;而ATTF提取物中、高剂量组NO的含量与模型组相比有显著性差异(P<0.05),且呈一定的剂量效应关系,这说明ATTF提取物中、高剂量组具有较好的抗炎活性,且表现出一定的浓度依赖性。

图3 ATTF提取物对LPS诱导的RAW264.7巨噬细胞分泌NO的影响
3 讨论
目前,有关于芦蒿总黄酮提取工艺的研究有如下几种:赵伯涛等[15]以乙醇浓度、热回流温度、pH与提取时间作为考察的四个因素,采用正交试验从芦蒿花中提取总黄酮,最终总黄酮得率约1%;王毓宁等[17]发现,在传统醇提的基础上加上超声波辅助,芦蒿总黄酮的得率提高了15.38%;扶庆权等[18]采用响应曲面法研究发现,在乙醇溶液体积分数为70%、提取温度为80 ℃、料液比为1∶100 (g/mL)、提取时间为180 min的条件下芦蒿叶总黄酮得率为6.58%。上述提取方法主要还是利用传统的溶剂提取方法。芦蒿总黄酮由于具有复杂性和多样性的特性,通常情况下,单一的提取技术不能很好的从植物中将黄酮类物质尽可能多的提取出来。植物细胞壁是存在植物细胞外围的一层厚壁,主要有纤维素、果胶、半纤维等物质构成,而黄酮类物质通常被包裹在细胞壁内,因此,提取植物中的黄酮类物质需要克服细胞壁及细胞间质的双重阻力。纤维素酶和果胶酶可以破坏植物细胞的细胞壁,而使黄酮类物质溶出。另外,超声波的空化作用可以加快植物细胞的破碎,可以加速黄酮类物质的溶出。本研究采用超声波-酶法两种技术联合提取芦蒿总黄酮,加之响应面CCD法优化,最终芦蒿总黄酮得率达13.09%,较传统工艺提取法得率大为提高。
巨噬细胞具有多向性的生物学功能,包括调节炎症[26]。巨噬细胞活化在多种炎症性疾病的发病机制中起着重要的作用。LPS是一种可以激活不同炎症信号的病原体[27]。巨噬细胞一旦被激活,就会直接产生NO等炎症因子,诱导其他免疫细胞释放细胞因子,参与免疫反应[28-29]。LPS刺激RAW264.7巨噬细胞释放NO已被广泛用作体外抗炎药物筛选的经典模型[30]。在本研究中,ATTF提取物可以明显抑制由LPS诱导的RAW264.7巨噬细胞NO的释放,表明ATTF提取物具有抗炎活性。
4 结论
综上所述,芦蒿总黄酮的最佳提取工艺条件为:超声温度50 ℃、复合酶用量1.5%、乙醇体积分数70%、液料比40∶1 (mL/g)、酶解时间为2.0 h、超声时间为40 min、复合酶配比为1∶1 (g/g)、超声功率为60 W、提取时间为1.5 h,在此条件下,ATTF得率达13.09%±2.13%。此外,ATTF提取物还具有一定的抗炎活性。
