马尾松胚性细胞团诱导体系优化
2020-12-08杨模华郑力尉李朋乐陈国敏王舒祺单易婷
王 杰,杨模华,郑力尉,李朋乐,陈国敏,王舒祺,单易婷
(中南林业科技大学 林学院,湖南 长沙 410004)
马尾松Pinus massoniana为松科Pinaceae 松属Pinus常绿乔木,具有耐干旱瘠薄、适应性强、生长迅速的特点,广泛分布于我国亚热带地区17 个省(区、市),是我国南方主要的造林树种之一,兼有用材、采脂、松花粉药用等多种经济价值,又是绿化荒山的先锋造林树种,在我国南方林业经济发展和生态环境保护中发挥着重要作用[1]。马尾松高效林业的发展急需大量的良种壮苗,可马尾松种子园种子产量低、无性繁殖困难,扦插繁殖又具有年龄效应,这些严重地制约着马尾松良种的扩繁应用。林木体细胞胚胎发生(Somatic embryogenesis SE)被认为是当前国际上林木良种基因型高效快繁的最佳途径,其利用植物细胞全能性进行植株再生,对优良材料进行扩繁利用,可不受季节和场地的限制,在短期内获得大量再生植株。针叶树体细胞胚胎发生良种快繁在高效人工林培育中已得到普遍地关注[2]。自1985年国际上首次在挪威云杉Picea abies中获得体细胞胚胎发生(体胚发生)植株再生成功以来[3],林木体胚发生已在冷杉属、云杉属、松属、落叶松属、栎属等20 多个属中获得再生植株,并已应用于北美乔松P.strobus、辐射松P.radiata、湿地松P.ellittii等无性系林业种苗生产和造林实践,促进了国际上高效无性系林业的发展[2]。
自1995年黄健秋等[4]首次开展马尾松体细胞胚胎发生研究并得到再生植株以来,马尾松体细胞胚胎发生研究取得了可喜的进展,如,杨模华等[5]于2011年建立了马尾松幼胚体细胞胚胎发生体系;2019年陈婷婷等[6]以抗松材线虫病马尾松幼胚为实验材料,优化构建了马尾松体胚发生再生体系。但胚性细胞团诱导率低一直是限制马尾松体胚发生体系实践应用的瓶颈问题[5-7]。类似的问题也是其他针叶树种体胚发生商业化应用的瓶颈,如何提高胚性细胞团诱导率也正是当前针叶树种体胚发生研究所重点关注的问题[2,8]。
研究表明,植物体细胞胚胎发育是在体外培养环境条件下诱导体细胞向胚性细胞转化并重演类似合子胚发育的进程[9]。因此,参照合子胚发育所需的雌配子体营养环境特征,并在体外培养体系中提供类似的培养环境,是优化针叶树体细胞胚胎发生体系的首选[10-11]。Pullman 等[12]对火炬松Pinus taeda合子胚不同发育阶段幼胚及其雌配子体中的营养元素、激素类型及含量、有机酸、糖类等成分组成进行了系列研究,把研究成果用于指导火炬松体胚发生体系的优化,取得了显著的效果。松属树种体细胞胚胎发生研究表明,未成熟幼胚最易于诱导出胚性细胞团,且只有处于特定发育阶段(合子胚发育阶段的2~4 阶段[9])的幼胚才能诱导出胚性细胞团,即幼胚的胚性细胞团诱导存在诱导敏感的“窗口期”[13-14];同时,胚性细胞团诱导的难易还受较强地母树基因型遗传控制[10-14]。Pullman 等[10]对32 个火炬松家系胚性细胞团诱导的研究发现,不同家系诱导率变动在0~53.4%之间,有些属于诱导敏感型家系,而另一些则属于诱导顽拗型家系;类似的受家系基因型遗传控制的诱导差异效应也在班克松P.banksiana、北美乔松、海岸松P.pinaster和欧洲赤松P.sylvestris的胚性细胞团诱导中发生,且这种受家系基因型遗传控制的差异诱导效应在不同年份中也表现一致[13]。外源生长调节剂也是针叶树体胚发生诱导的关键影响因子,最常用的植物生长调节剂及浓度水平组合通常是2,4-D(1.0~2.0 mg/L)和6-BA(0.5~1.0 mg/L)[12-14]。此外,培养基中的碳源、氮源类型及其浓度水平,不仅为培养基提供C、N 大量元素营养供应,也调控体胚发生的环境,对胚性细胞团的诱导产生重要的影响。不断积累的研究数据表明,培养基中的糖类不仅仅是组培体系中重要的碳源及能量来源,同时还在组培体系中发挥着培养基渗透压调节、环境胁迫因子和信号分子等多种作用[15-18]。针叶树体胚发生中,采用1%~3%的蔗糖均得到了较好的诱导效果[8,14],也有研究在培养基中采用葡萄糖或麦芽糖为碳源,如Salajova 等[19]在黑松Pinus nigra胚性细胞团诱导中发现,添加2%的麦芽糖处理优于添加2%蔗糖处理的效果。培养基中多种形式的氮素营养供应平衡,对针叶树胚性细胞团的诱导极其有利。Bozhkov 等[20]在挪威云杉体胚发生研究中发现,在含有机氮谷氨酰胺的培养基中调整无机氮中的氨硝比(离子浓度比值)在0.2 左右,有助于挪威云杉体胚发生的顺利进行;Laukkanen 等[21]的研究也表明,氨态氮(NH4+)与硝态氮()两种离子形式之间的平衡极大地影响着欧洲赤松愈伤组织细胞的生理代谢水平和组织细胞活力。因此,调整松属树种体胚发生培养基中的和的用量及其氨硝比、氮素平衡对优化松属树种胚性细胞团诱导具有重要作用。
马尾松胚性细胞团诱导率一直较低,这严重地限制了马尾松体胚发生的实践应用。为提高马尾松胚性细胞团诱导率,优化胚性细胞团诱导体系,本研究以马尾松未成熟合子胚为外植体材料,探讨母树基因型、激素组合、碳源类型(麦芽糖、蔗糖、葡萄糖)与质量浓度(10、20、30 g/L)、氮源(浓度、浓度,及其氨硝比离子浓度比值)对马尾松胚性细胞团诱导的影响,以期获得一套成熟稳定的胚性细胞团诱导体系,提高胚性细胞团诱导率,为马尾松体胚发生植株再生体系的商业化应用提供研究参考和关键技术支撑。
1 材料与方法
1.1 植物材料来源及其灭菌方法
供试材料马尾松未成熟球果于2018年7月12日采于湖南省桂阳县林业局苗圃马尾松种子园,低温保存带回实验室,置于4 ℃冰箱中保存备用。接种前,将马尾松球果从冰箱内取出,使用软毛刷蘸洗涤剂把球果表面刷洗干净,流水下冲洗2 h,然后将球果快速放入已灭菌的烧杯中,置于超净工作台上,75%酒精消毒30 s,无菌水冲洗3 次;再用0.1% HgCl2溶液灭菌20 min,无菌水冲洗3 次;随后用经75%酒精浸泡消毒过的枝剪将球果剥开,用无菌镊子取出种子,置于带湿润灭菌滤纸的培养皿中,用灭菌解剖针剥除种子的外种皮和内种皮,取出完整雌配子体置于诱导培养基中,23 ℃暗培养。
本实验以LP 为基本培养基,除碳源实验中需改变培养基中的碳源外,其它培养基均添加10.0 g/L 蔗糖,8.5 g/L 琼脂粉,0.1 g/L 肌醇,0.45 g/L谷氨酰胺(待培养基高压灭菌完成后,以过滤灭菌方式灭菌后加入),0.5 g/L 水解酪蛋白。植物生长调节剂组合依实验设计加入,配制的培养基在高压灭菌前调节pH 值为5.8 左右。
1.2 家系基因型对胚性细胞团诱导的影响
本试验分别对10 株母树自由授粉家系未成熟合子胚(10 个家系基因型)进行不同诱导处理试验,每处理3 次重复,每重复3~6 皿,每皿接种8~10颗,23 ℃暗培养,45 d 后统计不同家系各处理下获得胚性细胞团个数,计算胚性细胞团诱导率及褐化率。
1.3 植物生长调节剂水平组合对胚性细胞团诱导的影响
基于前期诱导试验研究结果筛选出最适宜的3组植物生长调节剂组合(表1),配制3 个诱导培养基,探讨不同植物生长调节剂组合对胚性细胞团诱导的影响;3 个处理随机接种4 个家系,每皿接种8~10 颗,每处理3~5 皿,23 ℃暗培养,45 d 后统计诱导率,观察拍照、记录胚性细胞团的生长状况。
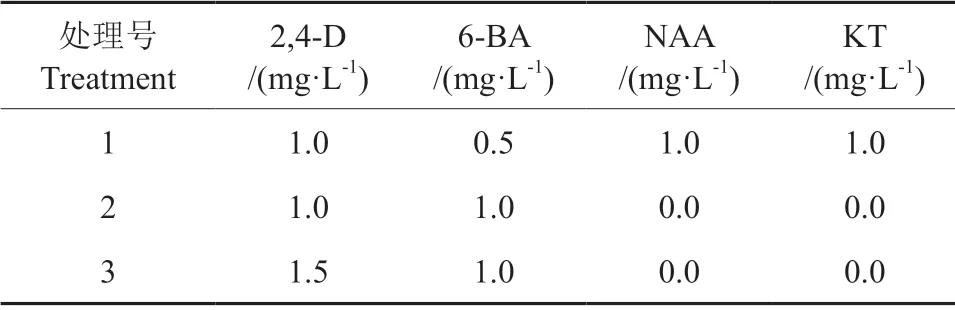
表1 3 组植物生长调节剂组合类型Table 1 Three types of plant growth regulator combination
1.4 碳源种类及浓度对胚性细胞团诱导的影响
本试验选取2018年7月采集的4 个家系(k1、k2、k3、k4)未成熟合子胚为材料,探讨碳源类型及浓度对马尾松胚性细胞团诱导的影响。以LP 为基本培养基,附加1.0 mg/L 2.4-D+0.5 mg/L 6-BA+1.0 mg/L NAA+1.0 mg/L KT,碳源包括3 种类型(蔗糖、葡萄糖、麦芽糖),分别设置3 种质量浓度水平(10.0、20.0、30.0 g/L),4 个家系分别接种9组碳源处理,每处理6~8皿,每皿5~6个幼胚;23 ℃暗培养,45 d 后统计胚性细胞团诱导率,观察拍照、记录胚性细胞团的生长状况。
1.5 氮源对胚性细胞团诱导的影响
本实验以LP 培养基中原有的氮素浓度为对照组,使用不同用量的NH4NO3和KNO3调整各自的浓度,在实验1.5.1 与1.5.2 的基础上,将氨硝比()划分为5 个水平(0、0.2~0.4、0.4~0.6、0.6~0.8、1.0),探讨诱导培养基中不同的氨硝比()对胚性细胞团诱导的影响。
1.6 数据记录与数据处理
所有实验处理的诱导情况均定期观察、拍照记录,统计实验数据,采用Excel 2010 软件进行数据统计与分析、制图,SPSS 2018 软件进行单因素方差分析和显著性检验,LSD 多重比较。并随实验的进行,使用照相机和体式显微镜观察、拍照记录幼胚胚性细胞团诱导过程中的反应和表现,典型样品取样压片,光学显微镜观察拍照,保存胚性细胞团内部细胞结构发育图像。
胚性细胞团诱导率(%)=诱导出的胚性细胞团/接种幼胚总数×100%。
褐化率(%)=种子褐化个数/ 接种幼胚总数×100%。
2 结果与分析
2.1 马尾松胚性细胞团诱导过程观察
将包含未成熟胚的雌配子外植体置于诱导培养基,诱导处理的1~7 周内定期观察培养物的诱导表现和反应状况、形态变化。定期观察记录的结果表明,胚性培养物呈挤出状从幼胚珠孔端吐出或喷出,并随培养时间的增加,诱导出的细胞团增殖其体积逐渐增大形成团簇状,其发生过程如图1A-D 和图1a-d 所示。将外植体置于诱导培养基初期(图1a),23 ℃暗培养7~14 d 后,部分外植体开始出现反应,外观颜色变微黄,体积略微膨大,有的外植体可见胚性细胞团从珠孔吐出,呈透明气泡状或丝状(图1b),随后粘性半透明的胚性细胞团于珠孔处吐丝成团状物并分裂增生(图1c)或聚集状增殖(图1d),21~28 d后,胚性细胞团增殖生长,体积不断增大,外观表现为白色,蓬松,有粘性,结构松软,表面有丝状突起且透明发亮(图1e),细胞团培养至直径约为1.0 cm 后,挑取诱导出的细胞团,转入增殖培养基进行增殖培养。
在诱导过程中能观察到呈现不同诱导反应的外植体,诱导处理30 d 后,对其进行内外形态结构观察,依内外形态结构差异,大体上可分为以下3 种类型(图2)。第Ⅰ类为无反应的外植体,该类雌配子体外观表现为胚乳透明、不饱满(图2A),沿脊线剖开在其内部解剖面上观察不到成形可辨的合子胚,只有一道浅沟槽发育(图2A1);第Ⅱ类为可诱导出正常胚性细胞团的外植体(图2),该类雌配子体外部颜色略发黄,胚乳不透明,沿脊线剖开在其内部可观察到未成熟合子胚雏形,具有区别明显可辨识的胚头细胞团和胚性胚柄细胞团两级结构。远离珠孔的一端是呈“子弹头”状排列较规则的胚头细胞,细胞呈圆形,其核质浓厚,排列紧密;而近珠孔端则为稀薄松散的长条形液泡明显的胚性胚柄细胞团状物,从胚头一端一直向珠孔外部延伸,突出珠孔后表现为胚性细胞团诱导成功。该胚性细胞团内的细胞团结构具有明显的极性结构,由聚在一起的圆形细胞组成胚头状细胞,连接着以一定松散状有序、富含液泡的长条形细胞,整体上形成具有极性结构的胚性细胞团。对照针叶树种合子胚发育阶段的划分[9],处于此状态的合子胚应处于合子胚发育的多胚卵裂后期至子叶前期(图2B1),该时期是胚性细胞团诱导最适宜的合子胚发育时期,称其为诱导的“窗口期”阶段;第Ⅲ类外植体在诱导培养基上未成熟合子胚胚轴直接伸长突出珠孔,无胚性细胞团发生(图2C),该类雌配子体外观呈黄绿色,内部解剖观察发现,其合子胚已发育成完整的子叶胚,胚根末端缺乏胚性胚柄细胞团类结构(图2C1)。对以上胚性细胞团诱导不同反应的外植体解剖观察的结果表明,幼胚合子胚的不同发育状态对胚性细胞团的诱导有重要影响,当雌配子体内的合子胚尚未成形或已发育成子叶胚时,均未能诱导出胚性细胞团,而可诱导出胚性细胞团的外植体,内部解剖后发现,雌配子体内可见呈子弹头状的合子胚头,并有一定量的透明长条状的胚性胚柄细胞团与其相连,此阶段的合子胚,是易于诱导出胚性细胞团的合子胚发育阶段,且诱导出的胚性细胞团,与雌配子体内的胚性胚柄细胞团结构性同源。因此,做胚性细胞团诱导实验,应及时检测未成熟球果内合子胚的发育状态,挑选已发育到有适量胚性胚柄细胞团出现的合子胚发育阶段进行采种诱导,对提升马尾松胚性细胞团诱导反应具有重要作用。
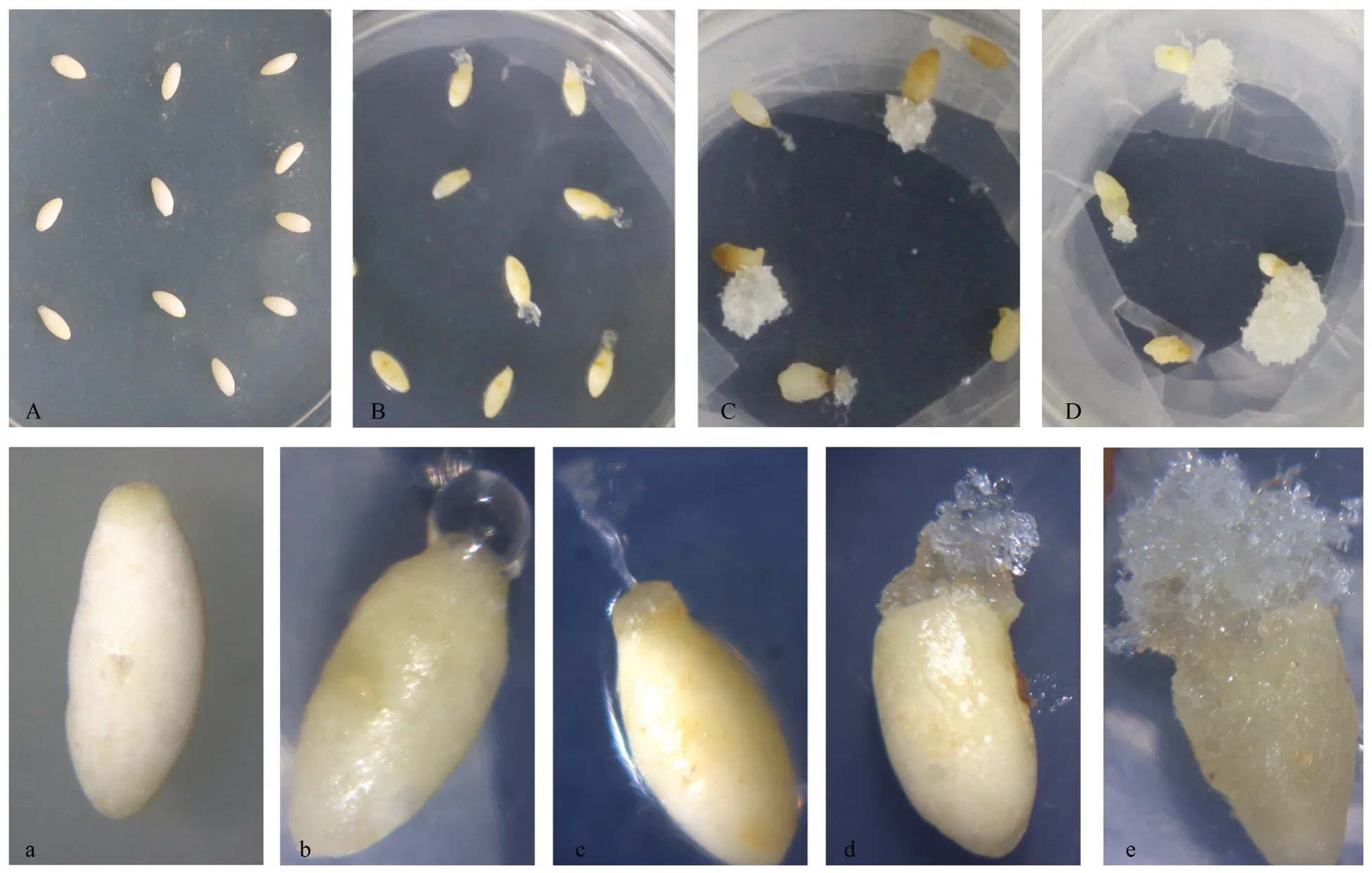
图1 马尾松胚性细胞团诱导过程Fig.1 Initiation of embryogenic masses of Pinus massoniana
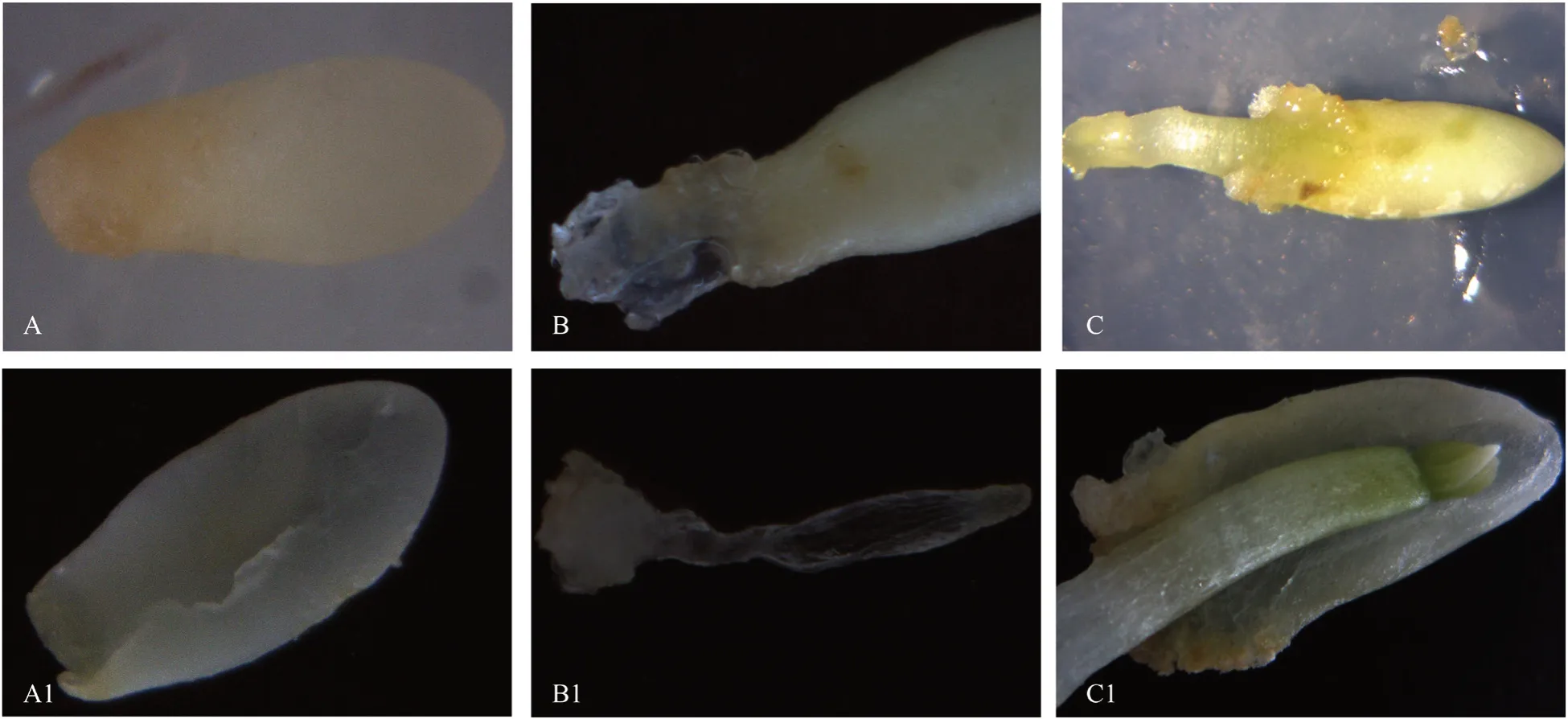
图2 不同诱导反应的外植体内外部状态Fig.2 The performance of outer and inside structure on the different initiation responses of induced explant
2.2 家系基因型对胚性细胞团诱导的影响
表2是10 个马尾松家系胚性细胞团诱导的实验结果。由表2可知,家系基因型对胚性细胞团诱导有显著影响(P<0.05)。所采集的10 个自由授粉家系中,家系内平均诱导率最高可达17.5%,最低为0。其中3 号家系与7 号家系胚性细胞团诱导状态最好,诱导率较高,分别为17.50%、15.83%,在诱导前期(<30 d)与后期(30~60 d)均陆续产生胚性细胞团,其褐化率显著低于其它组,仅分别为13.36%、35.36%,所产生的胚性细胞团结构蓬松,增殖生长较快,细胞团表面有突起,能稳定增殖,鉴定为正常的胚性细胞团,是后期增殖培养的良好胚性细胞团材料。而其它家系胚性细胞团诱导率均低于10.00%,且褐化率高,褐化率幅度分布在44.85%~89.92%之间,同时,这些胚性细胞团在后期的增殖培养中也容易水滞化或发生发黄、发黑,直至死亡消失的现象,仅有少数细胞系能够正常增殖。本实验中成功筛选到2 个胚性细胞团诱导敏感型母树基因型,诱导率超过15%。
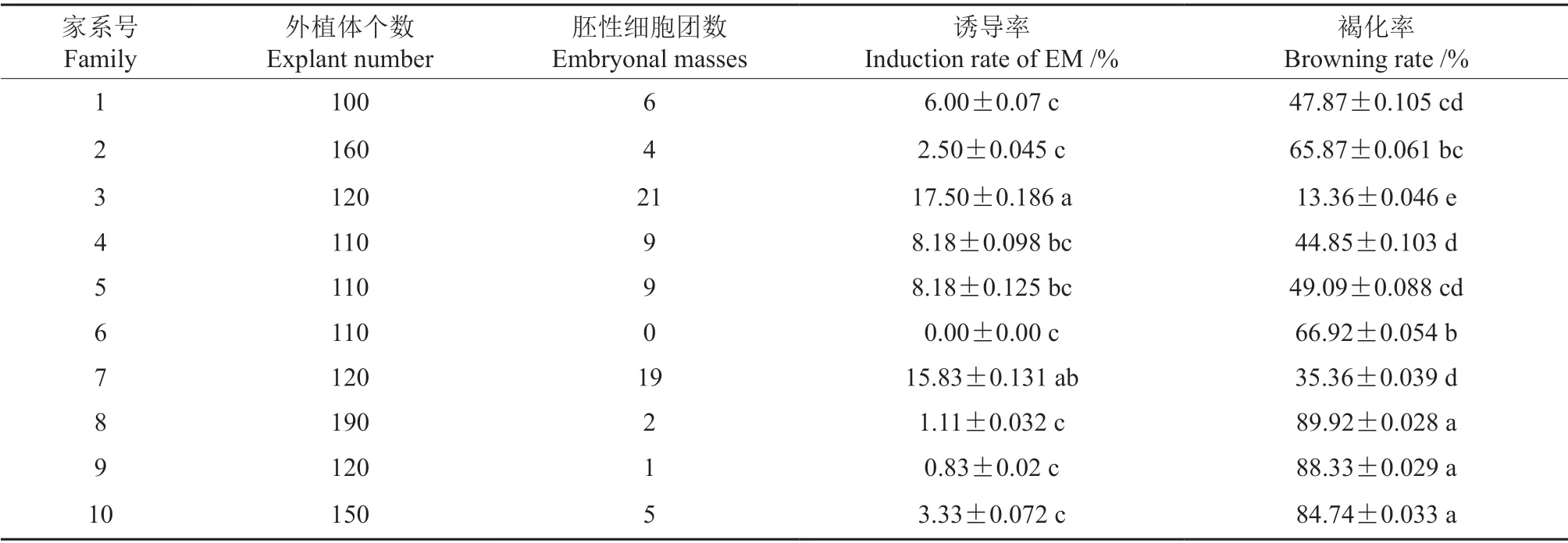
表2 不同家系基因型对马尾松胚性细胞团诱导的影响†Table 2 Effects of different family genotypes on the initiation of EM on Pinus massoniana
2.3 植物生长调节剂水平组合对胚性细胞团诱导的影响
生长素和细胞分裂素广泛地参与植物细胞分裂与分化。在植物体胚发生过程中,选择适宜的植物生长调节剂水平组合有利于胚性细胞团诱导。基于前期研究结果已筛选到3 组较佳的植物生长调节剂组合,本实验对这3 组植物生长调节剂处理的实验结果分析表明,胚性细胞团诱导率在这3 组处理间无显著差异(P>0.05)。在3 号处理上,使用1.5 mg/L 2.4-D+1.0 mg/L 6-BA)的培养基上其诱导率稍高,达到14.85%,且诱导出来的胚性细胞团白色蓬松,表面有丝状突起,胚性细胞团的极性结构发育,是良好的增殖培养材料。故3 号处理组合可作为今后马尾松胚性细胞团诱导推荐使用的植物生长调节剂组合(表3)。

表3 植物生长调节剂水平组合对马尾松胚性细胞团诱导的影响Table 3 Effect of plant growth regulator combinations on the initiation of EM on Pinus massoniana
2.4 碳源类型及浓度对胚性细胞团诱导的影响
图3为4 个家系在不同碳源类型及浓度处理下的研究结果,实验结果表明,调整碳源及其浓度水平可以在一定程度上提高胚性细胞团诱导率,但家系基因型与碳源类型及浓度水平之间存在交互作用,不同家系对碳源处理的反应具有家系的特异性,综合评价后,推荐较适宜的碳源为30.0 g/L的蔗糖。由图3可知,3 种碳源(麦芽糖、蔗糖、葡萄糖)下均可以诱导出胚性细胞团,但不同家系其最适合的碳源类型及浓度水平各不相同。k1家系在30.0 g/L 的蔗糖处理中,获得最高诱导率,为40.0%,显著高于其它处理组,而同样地k1 家系在其他处理中诱导率有差异,最低的仅为5.0%;k2 家系在20.0 g/L 的麦芽糖处理中,获得最高诱导率,为22.86%,其与同家系的其它处理组之间有差异但差异不显著,k2 家系中甚至有诱导率为0 的现象;k3 家系在30.0 g/L 的葡萄糖处理下,获得最高诱导率,为23.33%,该家系的其他处理中也出现了0 诱导率;在k4 家系中,方差分析显示碳源对胚性细胞团诱导的影响差异不显著(P>0.05),但30.0 g/L 葡萄糖处理下获得最高诱导率(15.74%),在10.0 g/L 蔗糖处理下其胚性细胞团诱导率为0。
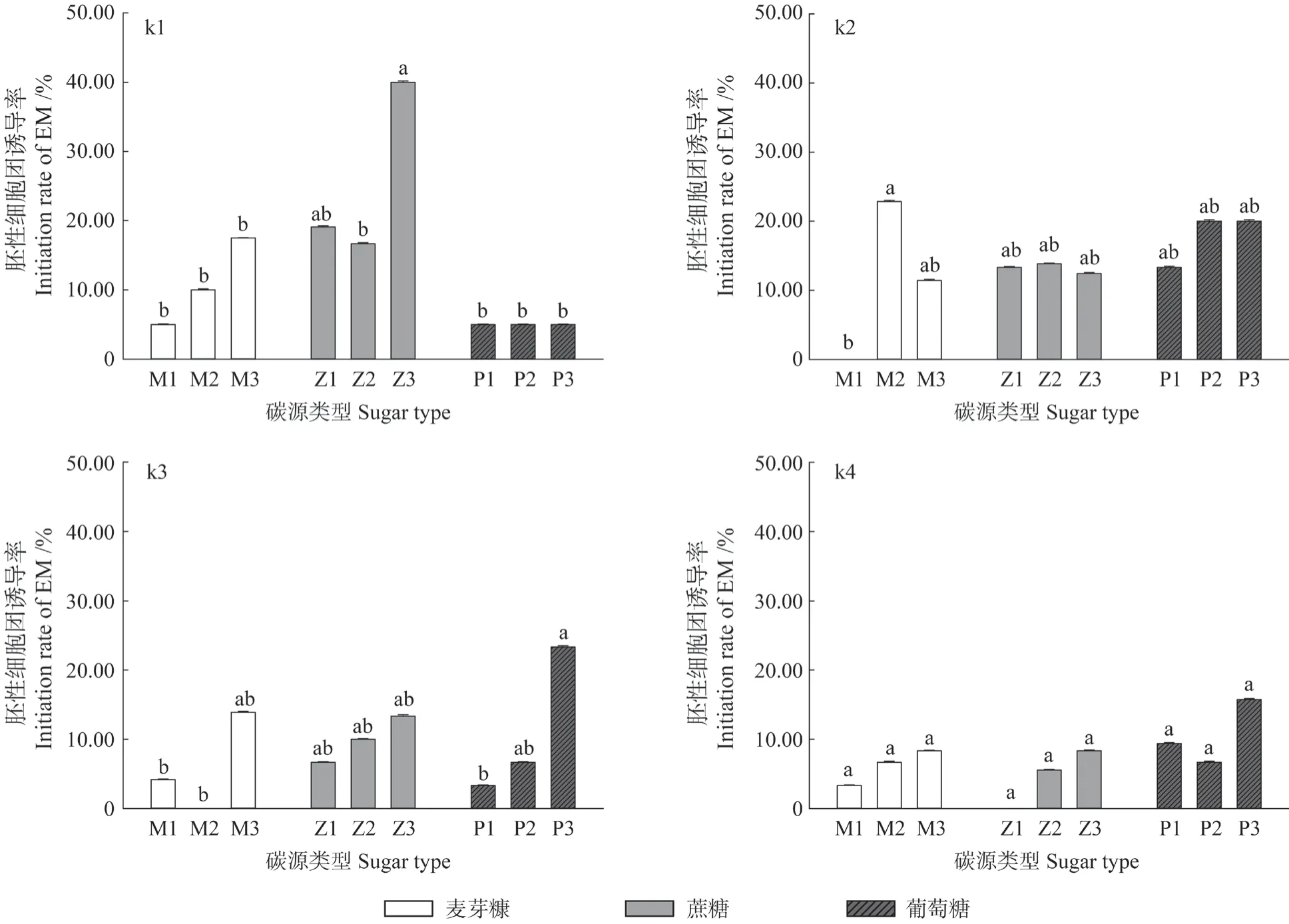
图3 碳源对4 个马尾松家系胚性细胞团诱导的影响Fig.3 Effect of different sugar sources on the initiation of EM on four Pinus massoniana families
对以上4 个家系在不同碳源水平处理下的诱导数据混合,仅按不同类型碳源及其浓度水平做统计分析,发现各类碳源水平下的诱导率随碳源浓度的增加而升高(图4),使用30 g/L 蔗糖的处理其平均诱导率最高,达到18.51%,因此,30 g/L的蔗糖为今后推荐使用的诱导培养基中的糖源。如在不同碳源的低(10.0 g/L)、中(20.0 g/L)、高(30.0 g/L)3 种浓度水平处理下,蔗糖各水平得到的平均诱导率分别为9.77%、11.51%、18.51%,葡萄糖各水平得到的平均诱导率分别为7.76%、9.58%、16.01%,而麦芽糖各水平下的平均诱导率分别为3.12%、9.88%、12.78%。由此可见,高浓度30.0 g/L 的蔗糖是诱导培养基的首选碳源,获得最高平均诱导率(18.51%),且在同一浓度水平下,蔗糖处理的诱导率均高于葡萄糖、麦芽糖处理的诱导率;随碳源浓度水平增加其诱导率升高的现象,还值得进一步探讨。
在实验观察中还发现,不同类型碳源下诱导出的胚性细胞团在外观形态表现上有差异。当碳源为蔗糖时,胚性细胞团整体上表现为白色或淡黄色,颗粒状,半透明,表面突起多,在后期的增殖培养基中仍可正常增殖;在葡萄糖处理组中,外植体诱导反应的响应较快,胚性细胞团与蔗糖组上的表现类似,但后期转入以蔗糖为碳源的增殖培养基后,细胞团开始发黄、变黑,最后失去增殖潜能;而在麦芽糖处理组中产生的胚性细胞团则为白色,结构紧致,不透明,突起较少,后期的增殖状态不佳,难以建立稳定的增殖体系。
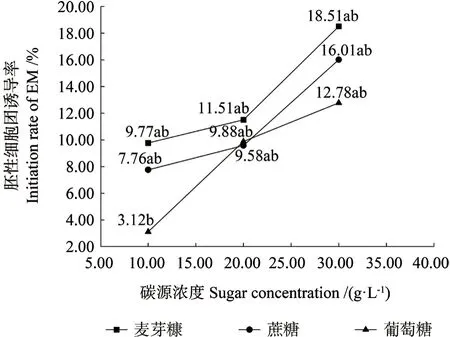
图4 碳源对胚性细胞团诱导的影响Fig.4 Effect of carbon source on induction of embryogenic masses
2.5 氮源对胚性细胞团诱导的影响
表4 浓度对马尾松胚性细胞团诱导的影响Table 4 Effectofconcentrations onthe initiation of EM onPinus massoniana
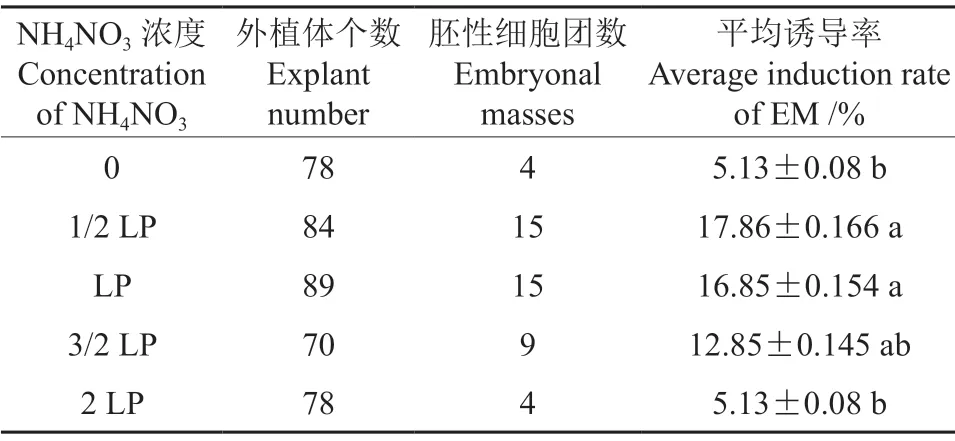
表4 浓度对马尾松胚性细胞团诱导的影响Table 4 Effectofconcentrations onthe initiation of EM onPinus massoniana
NH4NO3 浓度Concentration of NH4NO3平均诱导率Average induction rate of EM /%0 78 4 5.13±0.08 b 1/2 LP 84 15 17.86±0.166 a LP 89 15 16.85±0.154 a 3/2 LP 70 9 12.85±0.145 ab 2 LP 78 4 5.13±0.08 b外植体个数Explant number胚性细胞团数Embryonal masses
通过调整培养基中KNO3的用量来调节培养基离子的浓度水平,研究培养基中不同离子浓度对胚性细胞团诱导的影响,对照处理为原LP 培养基中的原离子浓度,结果如表5所示。由表5可知不同的离子浓度水平对马尾松胚性细胞团的诱导并无显著性差异(P>0.05),但在原处理(LP)上适当提高离子浓度(3/2 LP)有利于胚性细胞团的诱导,诱导率达到15.48%;在这5 个处理中,最低的诱导率出现在极低处理组(0)处理中(7.14%),当提高离子浓度达到2 LP 水平时,诱导率降至8.97%,低于适量提升离子浓度的处理组(3/2 LP)的诱导率,这说明适量调整提升培养基中的离子浓度,如3/2 LP 水平,能提升胚性细胞团诱导率,而培养基中过高(2 LP)和过低(0)不添加浓度不利于胚性细胞团诱导。在0 处理中虽然仍可诱导出少量胚性细胞团,但在此(0)处理下得到的胚性细胞团,其后期增殖培养中出现生长缓慢,细胞团外观颜色发生变黑变黄的现象,最后失去增殖潜能。这说明,离子浓度太低,对细胞团后期的增殖生长会产生严重的影响。
表5 浓度对胚性细胞团诱导的影响Table 5 Effect ofconcentrations on the initiation of EMonPinus massoniana
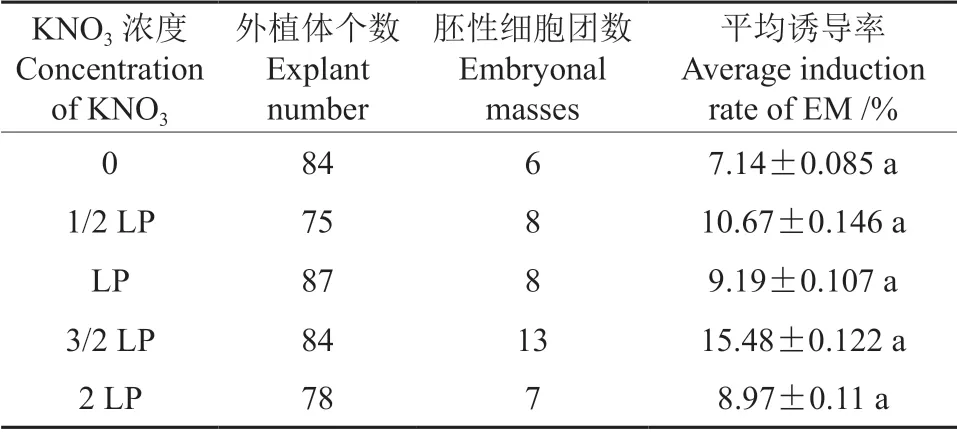
表5 浓度对胚性细胞团诱导的影响Table 5 Effect ofconcentrations on the initiation of EMonPinus massoniana
KNO3 浓度Concentration of KNO3外植体个数Explant number胚性细胞团数Embryonal masses平均诱导率Average induction rate of EM /%0 84 6 7.14±0.085 a 1/2 LP 75 8 10.67±0.146 a LP 87 8 9.19±0.107 a 3/2 LP 84 13 15.48±0.122 a 2 LP 78 7 8.97±0.11 a
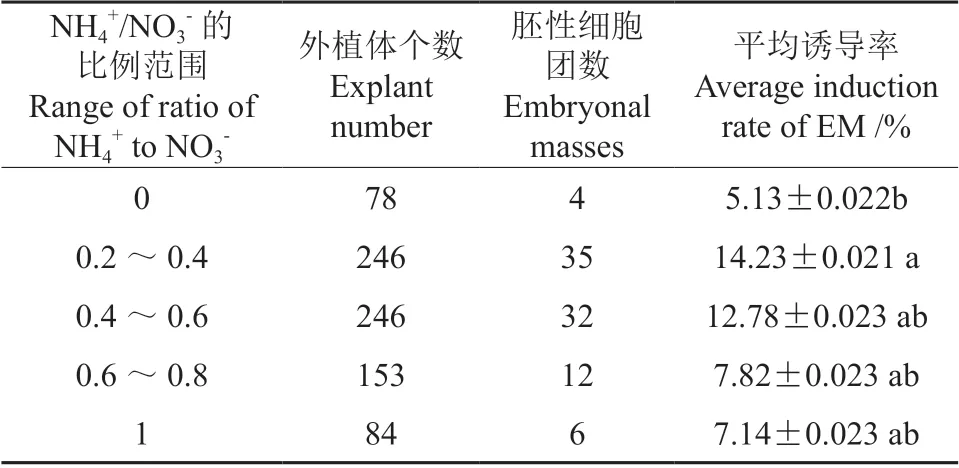
表6 氨硝比对马尾松胚性细胞团诱导的影响Table 6 Effect of the ammonium / nitrate molar ratio on the initiation of EM on Pinus massoniana
3 结论与讨论
3.1 结 论
本研究针对马尾松幼胚体细胞胚胎发生体系不稳定、胚性细胞团诱导率低的问题,从家系基因型、诱导培养基中植物生长调节剂、C、N 类型及其浓度水平等方面开展了马尾松胚性细胞团诱导体系优化探讨,获得的主要结论是:不同家系基因型对胚性细胞团的诱导有显著差异,受较强的遗传控制,因此,以LP 基本培养基为基础,选用诱导敏感型基因型,并在其幼嫩合子胚发育的多胚卵裂后期至子叶前期进行诱导处理,能提高胚性细胞团诱导率;培养基中应用30 g/L 的蔗糖,调控培养基中氨硝比(NH4+/NO3-)离子浓度比值在0.2~0.4 的范围内,并选用1.5 mg/L 2.4-D+1.0 mg/L 6-BA 的激素配比,经4~8 周诱导期的暗培养,保持培养温度23 ℃,马尾松胚性细胞团诱导率最高可达40%,平均诱导率也可提高至17%以上,这为建立稳定的马尾松胚性细胞团诱导体系提供了研究参考和关键技术支撑。
3.2 讨 论
3.2.1 母树基因型对胚性细胞团诱导的影响
不同母树基因型诱导马尾松胚性细胞团的研究结果表明,不同家系胚性细胞团诱导存在显著地差异,这与在针叶树种体细胞胚胎发生中已发现的家系基因型差异诱导遗传控制效应的表现一致[8,12-13],然而,这种受遗传控制的家系差异诱导效应已成为阻碍针叶树体胚发生实践应用的瓶颈问题之一,并得到人们地普遍关注[2,14]。如若仅能在某些诱导敏感型的基因型上获得林木体胚发育的成功,这将极大地限制所能造林应用的无性系数量,特别是对一些性状表现优异的良种可能因体胚发生困难而导致优良基因型在无性系林营建中的流失,这将进一步限制优良材料遗传增益的持续获得;无性系基因型数量有限,林分群体遗传多样性便会不足,其结果会表现出无性系林分对不良环境抗性弱,进而严重影响林分健康和稳定性[8,13]。同时,本实验也发现,同一时期采集的不同家系,其各自合子胚发育阶段的成熟度存在着一定差异,因针叶树胚性细胞团诱导存在诱导敏感的“窗口期”[2,13],那么,这些当前表现为诱导困难的顽拗型家系,是否因其没处于合子胚发育诱导敏感“窗口期”而导致诱导率低,这个问题还值得进一步研究。这也提醒我们,预先实时监测各家系合子胚的发育状态,挑选家系合子胚诱导敏感的“窗口期”进行诱导,对获得更稳定可靠的胚性细胞团诱导体系更有保障。而对那些确实诱导困难但又表型表现优良的家系,可考虑利用杂交育种方式,把诱导“顽拗型”家系与诱导“敏感型”家系控制杂交,通过基因型遗传重组获得杂交后代幼胚,然后再用于胚性细胞团诱导及体胚发生植株再生,以发挥优良基因型无性快繁的遗传增益[22]。此外,尽可能借鉴合子胚发育的环境需求(不同发育阶段雌配子体各个营养组分特征)来提供幼胚胚性细胞团诱导、增殖所需要的培养基环境条件,也是今后对“顽拗型”家系优化诱导体系、提高其胚性细胞团诱导率的可选途径[10-11]。
3.2.2 碳源对胚性细胞团诱导的影响
在本研究中,提高诱导培养基中的碳源浓度水平,即用较高浓度的蔗糖、麦芽糖等(浓度水平达30.0 g/L),均可不同程度地提高胚性细胞团的诱导率,且家系诱导率与碳源类型及水平间存在交互效应,如k1 家系在30.0 g/L 的蔗糖处理下,最高诱导率达到了40.0%。而Fuentes 等[23]在咖啡胚性细胞团诱导中已发现,不同的家系其最高诱导率也具有碳源类型及浓度水平的差异性,本研究中家系基因型与糖源交互处理的实验结果与Fuentes 等[23]的研究结果类似。原因可能是,各个母树树体内生理特性的异质性使得各自幼胚在胚性细胞团诱导中所需要的环境条件也出现差异化需求,似乎有必要推行不同家系诱导的差异化诱导环境策略。然而,针对各个家系幼胚的特殊生理环境需求,差异化准备培养基做诱导实验,实践上却不具有可行性。综合各家系在不同碳源水平下的反应,在30.0 g/L 的蔗糖上获得了最高的平均诱导率,兼顾诱导体系经济、方便和高效的要求,推荐采用30.0 g/L 蔗糖做诱导培养基的糖源,以取得相对较高的诱导率。
提高糖浓度可在一定程度上提高了马尾松胚性细胞团诱导率,这可能与高浓度糖源在培养基中对外植体(包含未成熟合子胚的雌配子体)形成一种高渗透压的胁迫环境有关。近年来,受益于分子生物学研究技术的进步,对植物体细胞胚胎发生机制机理的遗传学和表观遗传学研究也得到了长足地发展,Fehér[24]和Zavattieri 等[25]综述已有的体细胞胚胎发生研究结果后认为,体细胞胚胎发生是受到胁迫的植物细胞应对极端环境胁迫情形下基因差异表达重编程的结果,胚性细胞团诱导发生是植物应对环境胁迫的典型应激反应,因此,提高培养基中的环境胁迫压力有利于发生细胞命运改变的决定性事件[24]。仔细观察马尾松胚性细胞诱导成功的外观表现和解剖图片,注意到最初马尾松胚性细胞团绝大部分均从雌配子体珠孔一端挤出、或呈喷射状突出珠孔,切开珠孔,挑出内外相联系的胚性细胞团,从解剖图上可见,从珠孔端挤出的胚性细胞团,是一团与雌配子内所包含的胚性胚柄细胞团细胞结构同源的培养物,且随蔗糖浓度的增加,胚性细胞团的挤出率升高。这也能一定程度上解释,为什么处于多胚卵裂期至子叶前期阶段的针叶树幼胚,是胚性细胞团诱导的敏感“窗口期”,这与当前其雌配子体内现存有较多胚性胚柄细胞团有关[9],随着合子胚的继续成熟,这些胚性胚柄细胞团因发生细胞程序性死亡,胚性胚柄细胞团逐渐消失殆尽[26],其幼胚诱导胚性细胞团的潜力也逐渐丧失;而过于幼嫩的合子胚(此期因还未有成形可辨识的合子胚雏形与胚性胚柄细胞团的极性结构),可能因其还没有发育出足量的胚性胚柄细胞团,故也难于诱导出胚性细胞团。
蔗糖在植物组织培养中作为培养基的渗透压调节物质和胁迫环境因子,已得到人们的广泛关注[15]。已有多个研究表明,碳源在植物组织培养中,除了供给外植体碳素营养外,还是培养基中渗透压调节、环境胁迫的因子,此外,蔗糖还可作为信号分子,参与细胞团的增殖生长代谢过程[15-16]。不断积累的研究数据,正更新着人们对体细胞胚胎发生细胞分化方向决定的认识。一般认为,体细胞胚胎发生是植物细胞在内源和外源信号作用下,应对环境胁迫时细胞命运重编程的应激反应和自适应调节结果[24-26]。本研究观察到,诱导出的马尾松胚性细胞团,实际上是一团从雌配子体珠孔端挤出的、与雌配子内所包含的胚性胚柄细胞团细胞结构同源的培养物,且随蔗糖浓度的增加,胚性细胞团诱导率升高。与低糖浓度处理相比,高糖浓度处理的培养基上具有更高的渗透压水平[10],故而,这将对其上放置的外植体(包含未成形合子胚的雌配子体)造成更高的培养环境胁迫压力,而这种高渗透压胁迫可能会干扰雌配子体内现存的胚性胚柄细胞团细胞胞间连丝的连接,促使这些胚性细胞在生理上发生分离[27],并在培养基外源生长调节物质(2,4-D,6-BA)的作用下,使得原本应在雌配子体内经历程序性死亡的胚性胚柄细胞团向细胞分裂增殖方向转变[26],从而发生胚性细胞团在雌配子体内的增殖,最终胚性培养物从珠孔端挤出,表现为成功诱导出胚性细胞团。而本研究中通过增加培养基中碳源浓度提升胚性细胞团诱导反应的分子机制,还值得进一步研究。
3.2.3 氮源对胚性细胞团诱导的影响
培养基中的氮素水平是影响植物细胞生命活动的重要因素。本研究发现,培养基中的氨硝比()调整在0.2~0.4 之间时,得到了较高的诱导率(14.0%左右)。Bozhkov等[20]研究发现,培养基中的N 素平衡(有机氮和无机氮)显著地影响挪威云杉胚性细胞团的诱导,在含有机氮3.0 nM 谷氨酰胺的培养基中,氨硝比()控制在0.2 左右,挪威云杉胚性细胞团诱导的效率最高;而在本马尾松胚性细胞团诱导的研究中,也得到了与以上研究类似的结果,这为今后通过调整培养基组成氮素成分提升针叶树种胚性细胞团诱导率提供了一种可借鉴的途径。
Kaul 等[28]研究表明,培养基中不同无机氮供应形式(、或两者兼用)对北美乔松愈伤组织生长有显著地影响,若培养基中只使用铵态氮(NH4Cl)则对北美乔松愈伤组织的生长不利,但这种不利影响可随同时添加硝态氮(NH4NO3)而得到改善。Amancio 等[29]研究了不同无机氮形式对玉米愈伤组织细胞生长的影响,发现在不同无机氮形式的处理下,细胞内的物质合成和生理代谢均发生了较大的差异,具体表现是在不同处理下,细胞内磷酸烯醇丙酮酸羧化酶活性、细胞内环境的pH 值以及氨基酸类物质的合成等均有不同程度地差异表现。另外,Laukkanen 等[21]研究欧洲赤松愈伤组织在不同无机氮供给培养基处理上的反应时发现,培养基中不同无机氮供给利用形式,明显地影响细胞代谢和细胞团生长的活力水平。因此,调整培养基中的氨硝比()可能是优化细胞团生长状态的一个关键调控措施。Grimes 等[30]研究发现,改变培养基中硝态氮和铵态氮的比例,可增加水稻幼胚对生长素的敏感程度;而通过增加或降低、的用量,对胚性细胞团的诱导及细胞生长表现,均出现了与其上研究类似的研究结果。因此,在体细胞胚胎发生体系优化中,考虑培养基中氮素利用形式及其平衡是今后胚性细胞团诱导中重点关注的问题,尤其是氨硝比()的合理取值范围,是培养基优化探讨的一个方向。
在本研究中分别从筛选诱导敏感基因型和优化培养基成分两个方面着手,成功提高了马尾松胚性细胞团诱导率;然而,同期采种的不同家系其诱导率有显著地差异,既可能是基因型的影响,也有可能是合子胚发育阶段不同步而导致。因此,在今后的马尾松胚性细胞团诱导中,应着重考虑以下3 个方面:1)扩大母树基因型筛选范围,选出更多诱导敏感且胚性细胞团增殖培养胚性保持质量稳定的母树基因型;2)实时监测适宜于胚性细胞团诱导的未成熟合子胚诱导敏感“窗口期”进行采种诱导,以确保在最适诱导期处理家系,以提高胚性细胞团的诱导率;3)今后可从优化调整培养基组成成分方面探讨诱导体系,注重碳、氮平衡及其碳源类型与氮素形式培养基成分的合理调整,并对不同优化措施下胚性细胞团诱导的分子作用机制方面开展探讨,可为针叶树体细胞胚胎发生体系优化提供理论指导。
感谢:本研究得到了湖南省桂阳县林业局苗圃唐黎、伍新云,湖南省林业科学研究院许忠坤、黄帆等的大力支持,他们积极参与为本实验的顺利进行提供了实验材料来源和采样协助,在此一并感谢。
