脑微出血的临床意义及其伴心房颤动时的抗凝治疗决策进展
2020-12-08武冬冬胡夏生刘银红蒋景文
武冬冬,胡夏生,刘银红,蒋景文
(北京医院保健医疗部神经内科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730)
脑微出血(cerebral microbleed,CMB)是一种在磁共振成像(magnetic resonance imaging,MRI)梯度回波T2*(gradient recall echo T2*,GRE T2*)成像或MRI磁敏感加权成像(susceptibility weighted imaging,SWI)中表现为小圆形、均匀一致的低信号,直径多不超过5 mm。1996年,Offenbacher等[1]最先提出了“微出血”的概念,随后经组织病理学与MRI征象间相关性的研究证实,脑小血管破裂出血所致的含铁血黄素沉积是MRI图像中所见多数CMB的病理基础[2]。
CMB在老年人中很常见,在卒中患者中也越来越多地被检测出。有研究报道,21%的健康人群和高达40%的80岁以上老年人中可以检测到CMB;19%~83%的脑出血(intracerebral hemorrhage,ICH)患者以及35%的缺血性卒中(ischemic stroke,IS)患者均可检测到CMB[3]。在无卒中或痴呆病史的患者中,高血压可使CMB出现的风险增加4倍,糖尿病可使其出现的风险增加2倍[4]。在神经病理学上,CMB是脑小血管病的重要标志之一,大多数CMB其实是病变小血管中红细胞在脑实质内的不断外渗[4],但约有1/3的CMB可能涉及其他机制[2]。CMB的具体分类及可能的机制见表1[5]。

表1 CMB的分类和可能的机制
CMB已成为近年来脑血管病领域的研究热点,而MRI技术的发展,包括高场强、回声时间的选择及优化的GRE T2* 序列以及SWI的应用[6],均增加了CMB的检出率。
心房颤动(atrial fibrillation,AF)在老年人中常见,AF患者发生IS的风险大大增加[7],且AF患者的CMB发生率也显著高于非AF患者[8]。抗凝治疗可有效降低AF患者的IS的发生率[9],但同时也会增加ICH的风险[10]。对伴有CMB的不同AF患者,需进行个体化评估抗凝治疗在卒中预防中的获益和导致出血风险。本文将就近年来有关CMB临床意义及伴CMB的不同AF人群其抗凝决策相关研究进展作一综述。
CMB的临床意义
关于CMB的临床意义仍有待研究。CMB是否与认知障碍有关,或能否导致卒中样症状等问题,目前依然存在争议[11]。Lovelock等[12]发表的系统回顾性分析显示,CMB与ICH的发生相关,CMB被认为是认知损伤患者及老年患者死亡的预测因子。此外,越来越多的研究显示,CMB可能是脑血管病变治疗方案决策的重要标志物。
一、CMB预测既往ICH人群的复发风险
对既往有ICH病史的患者,CMB数量通常与ICH复发风险相关[13],但是CMB的位置似乎更加重要。例如既往有脑叶ICH史的老年患者,其脑叶内多发CMB则高度提示脑淀粉样血管病(cerebral amyloid angiopathy,CAA)的诊断,且可使每年的ICH复发风险增加30%[13]。ICH病死率高,是严重的脑血管病,因此当患者需要接受可能引起ICH风险的潜在疾病治疗 (如抗栓或他汀降血脂治疗)时,CAA成为主要关注点。但在有大脑深部(包括基底节、丘脑、内囊、外囊及胼胝体和脑室周围白质)ICH史的患者中,CMB的存在及数量对ICH复发风险的影响似乎较弱[14]。从病理生理机制上讲,深部CMB与动脉粥样硬化性和(或)深穿透小动脉的脂质玻璃样变性等高血压相关性脑小血管病(hypertensive cerebral-small vessel disease,HT-SVD)有关,HT-SVD不仅与ICH的复发风险增加有关,同时还与IS风险增加相关[15]。
二、CMB预测既往有IS史人群的缺血事件
2013年一项荟萃分析发现,CMB似乎是既往缺血性脑血管病 [包括IS或短暂性脑缺血发作 (transient ischemic attack,TIA)]患者复发缺血事件和首发ICH的独立标志物[15]。2016年,Wilson等[17]对15项研究结果进行荟萃分析,共纳入5 068例患者,结果发现CMB与IS或TIA后卒中复发风险增加相关,与无CMB者相比,有CMB者随着CMB数量的增加,ICH发生的风险增加幅度大于IS。该研究认为,无论CMB数量多少,IS绝对事件的发生率仍然高于ICH绝对事件发生率;CMB≥5个时,可能有助于医师识别未来发生ICH风险大于IS风险的患者。
三、CMB预测健康中老年人群发生卒中的风险
CMB对健康中老年人群未来发生卒中的风险也有预测价值。2015年,Akoudad等[18]的一项研究纳入了4 579例年龄≥45岁的受试者,根据基线脑MRI中CMB的存在、数量和(或)位置评估受试者的卒中风险,并随访5年。结果显示,在调整年龄和性别因素后,基线时存在CMB的患者未来发生卒中的风险增加近2倍[18]。该研究结果还显示,脑叶CMB与首发ICH风险增加5倍相关,但与首发IS风险无关;深部CMB既与首发IS风险增加2倍相关,也与首发ICH风险增加5倍相关[18]。
CMB与AF的发生
一、AF患者中CMB的发生率
与CMB一样,AF在老年人中也很常见。Saito等[8]在一项对131例日本AF患者和112例非AF者的对照研究中发现,AF患者的CMB检出率明显增高(AF患者为30.5%,非AF者为18.8%,P=0.04)。研究发现,AF可使IS的发生风险增加5倍[7]。在IS的一级和二级预防中,口服抗凝药(oral anticoagulant,OAC)尤为有效,最高可使IS的风险降低70%[9]。OAC的一个致命且不可预测的并发症是ICH,而ICH住院患者有42%的死亡率,并可导致幸存者严重残疾[10]。因此临床需要准确地预测ICH的发生风险,并将其与发生IS的风险区分开来,以便临床医师评估OAC治疗可能带来的临床净获益,但目前尚未有可靠的评价指标。随着MRI GRE T2* 或SWI技术使用的增多,CMB在约30%的AF合并IS患者中被检测到,OAC治疗的风险与获益平衡的不确定性由此产生[19]。
二、CMB与AF伴卒中人群死亡率间的相关性
2014年,Song等[20]回顾分析了504例AF伴卒中患者,在校正了年龄、性别及其他导致卒中死亡的重要风险因素后,发现CMB数量≥5个与全因死亡及IS风险增加相关;Kaplan-Meier曲线显示,全因死亡和出血性卒中死亡的发生取决于CMB的位置,而缺血性心脏病及IS的死亡与CMB的位置并不相关。多变量Cox回归分析显示,脑叶合并深部的混合性CMB是全因死亡的独立危险因素,脑叶CMB是出血性卒中死亡的独立危险因素。该研究首次揭示了CMB的数量、位置与AF伴卒中人群死亡率之间的关系。
CMB与不同AF患者的抗凝决策
CMB的存在、数量及位置能够作为临床医师评估老年患者发生ICH及IS的风险时的参考,但目前尚缺乏依据CMB状态将患者分层的随机对照试验,因此临床实践仍以间接证据为基础。
一、既往无IS的AF患者的抗凝治疗
对于既往无IS的AF患者,HAS-BLED(hypertension,abnormal renal/liver function,stroke,bleeding history or predisposition,labile international normalized ratio,elderly,drugs/alcohol)评分能够在一定程度上预测其发生ICH的风险,但此评分并没有纳入CMB这个影响因素。Eckman等[21]设计了决策模型来检验CMB对抗凝治疗的影响。受试者是1例69岁新诊断的非瓣膜性AF患者,无卒中病史。模型结果提示,若CMB存在使得患者发生ICH的风险增加2倍,则不建议停用口服抗凝药维生素K拮抗剂(vitamin K antagonist,VKA);若ICH风险增加了3倍,则IS低危风险的患者需要停用VKA。近几年陆续进行的新型口服抗凝药 (novel oral anticoagulant,NOAC)研究发现,NOAC较VKA可使无IS病史的AF患者ICH发生率降低近50%[22-24]。基于既往研究结果,目前认为,无论CMB的数量或位置如何,都不影响既往无IS的AF患者服用NOAC。
二、既往有ICH的AF患者的抗凝治疗
对于有ICH病史且IS风险较高的患者,应用抗凝药物并非绝对禁忌证。尽管接受抗凝治疗的患者发生ICH后,结局往往更严重[25],但幸存者的ICH复发风险似乎不会因既往是否接受抗凝治疗而存在差异[15]。
1.脑叶ICH:ICH的位置可能是影响抗凝药物使用的决定性因素。Eckman等[26]曾在一项决策分析中发现,AF伴既往脑叶ICH患者采用“不抗凝”策略比采用“抗凝”策略能带来更多的临床获益,结果提示每1 000例脑叶ICH患者采用抗凝治疗可预防约31例心源性脑栓塞,但在治疗的第1年,抗凝治疗的代价是增加150例ICH的发生。加之基线CMB数量与脑叶ICH患者的ICH复发风险相关,存在CMB可能进一步破坏抗凝净收益的平衡[27]。因此,不建议脑叶ICH后AF患者采用抗凝治疗[26]。
2.脑深部ICH病史:对于有脑深部ICH病史的患者是否应该启动抗凝治疗,多项研究数据显示,患者发生深部ICH后接受抗凝治疗是相对安全的[28]。Eckman等[26]基于脑深部ICH患者每年总复发率2.1%的评估,发现如果脑深部ICH患者具有较高的心源性脑栓塞风险[>6.5%/年;CHA2DS2-VASc[congestive heart failure,hypertension,age ≥75 year (doubled),diabetes mellitus,stroke (doubled)-vascular disease,age 65-74 and sex category (female)≥5分],或复发ICH的低风险(<1.4%/年),接受抗凝治疗可能对其有益。然而,既往研究报道发现,脑深部ICH后复发ICH的风险可能会超过1.4%[29],在伴发多个CMB的情况下,死亡率高达73%[29]。此种情况下行抗凝治疗或许风险大于获益,尚待进一步研究。
无论在何种情况下,ICH患者都应强化血压控制[30],并积极干预可引发ICH的危险因素。除ICH的位置以外,CMB对个体化抗凝策略是否有其他意义尚待研究[31]。关于ICH风险极高者是否需要行左心耳 (left atrial appendage,LAA)封堵术、CMB是否有助于识别LAA封堵治疗的潜在获益人群等问题,都需要进一步行更深入的研究以明确。
三、既往有IS的AF患者的抗凝治疗
对既往有过IS的AF患者而言,在其他发生IS的危险因素相同的情况下,IS复发风险高于既往无IS史的AF患者[32],脑血管病病史也是服用OAC的AF患者发生ICH的独立危险因素[33]。因此,有IS病史者在服用OAC时,较同龄、同血压水平的人群更易发生ICH。既往研究发现,AF患者发生缺血事件风险的增加似乎大于发生首发ICH的风险,所以原则上建议无论CMB数量及位置如何,既往有IS的AF患者均应尽量采用抗凝治疗。但抗凝后是否增加出血(特别是ICH的风险),已成为目前抗凝治疗的关注点。
国际上关于“IS或TIA患者行抗凝治疗AF的ICH发生率与基线CMB关系”的前瞻性研究数量有限。2013年,韩国学者Song等[34]在1项纳入了550例患者的前瞻性研究中发现,基线CMB的存在与AF抗凝后发生ICH显著相关(HR=3.785,95%CI为1.090~13.148,P=0.036)。但因其他几项前瞻性研究不能调整混杂因素,均未证实这一相关性。
为进一步明确在近期发生IS或TIA后行抗凝治疗的AF患者中,CMB存在是否是ICH高危患者的提示标志,英国学者Wilson等[35]开展了一项以英国为主、多中心、前瞻性队列研究(CROMIS-2),并于2018年公布了研究结果。此研究共纳入1 490例AF患者,结果提示症状性ICH发生率在有CMB组为9.8‰(95% CI为4.0~20.3),高于无CMB组的2.6‰(95% CI为1.1~5.4)。研究提供了新的证据,即在IS或TIA发作后行抗凝治疗的AF患者中,CMB是ICH发生的独立危险因素,该研究证实了Song等[34]的研究结果,与2013年Charidimou等[16]的荟萃分析结果相一致。CROMIS-2研究还发现,ICH风险随着CMB数量的增加而增加,但IS的绝对事件发生率仍然高于ICH(即使是多发CMB患者)。该研究首次将CMB作为神经影像学指标纳入ICH的风险预测评分,改善了目前临床常用出血风险评分(如HAS-BLED评分)的预测价值。
2018年,中国香港学者Soo等[36]在一项前瞻性研究中也发现,在预测ICH方面,CMB计数比HAS-BLED评分及CHA2DS2-VASc评分更灵敏。但CROMIS-2研究无法确定CMB的数量阈值,即能够反映ICH的绝对事件率超过IS绝对事件率的阈值,这可能与该研究中高数量CMB的患者少以及ICH事件的发生率很低有关。但Soo等[36]的前瞻性研究发现,抗凝后CMB为0~4个的患者,其ICH发生率低于IS发生率,CMB≥5个的患者,其ICH发生率高于IS。既往Wilson等[37]在2016年的荟萃分析以及Charidimou等[19]在2017年的荟萃分析中均得出,基线CMB≥5个的患者抗凝后ICH的风险增加[18]。以上研究提示有关CMB阈值还需要更进一步的研究。
不同AF人群抗凝治疗的决策
一、AF患者中不建议抗凝的情况
AF患者需要抗凝,目前证据支持大多数确诊为AF伴CMB的患者需要抗凝,建议不要同时合并使用其他抗血小板药物,如阿司匹林等。但以下几种情况,不建议抗凝[38]:①既往有脑叶ICH(或表面铁沉积)及脑叶多发CMB(目前尚无法确定具体阈值)的患者;②中年ICH、早发性痴呆家族史及头颅MRI提示CAA的患者;③急性冠脉综合征或经皮冠状动脉介入治疗后行双重抗血小板治疗及脑叶多发CMB患者。
二、抗凝流程
如何应对CMB的影响,提出AF患者的个体化抗凝治疗决策,尚缺乏有效的高质量证据。根据现有的研究结果,Wilson等[31]提出了不同AF患者伴CMB的抗凝决策流程(见图1),供临床参考,具体如下。既往有ICH史的AF人群,若为脑深部ICH,则无论是否合并CMB,均可予OAC治疗,同时CMB亦可选择LAA封堵术。若为脑叶ICH,对于合并CMB且不能排除很可能CAA的患者,则建议避免长期抗凝,应考虑LAA封堵术;对于合并CMB但已排除CAA的患者,或不合并CMB时,则选择OAC治疗或LAA封堵术。既往健康或无卒中AF人群和伴IS的AF人群,无论是否合并CMB,均应予OAC治疗。
三、抗凝药物的选择
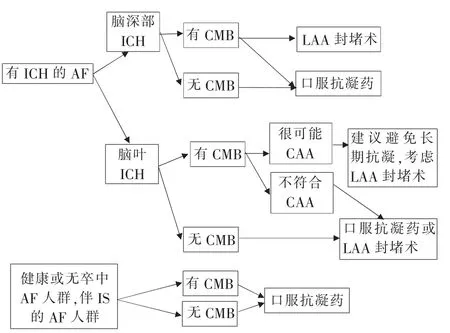
图1 不同AF人群的抗凝治疗决策流程图
每年服用VKA (如华法林)的AF患者ICH总风险从0.1%或>2.5%不等[39-41],与服用华法林的患者相比,服用NOAC的ICH风险较低 (RR=0.48,95%CI为0.39~0.59; P<0.000 1)[42]。多项研究提供的间接证据表明,CMB的存在,特别是脑叶CMB,可能会增加AF患者抗凝治疗后发生ICH风险,特别是服用华法林抗凝的患者[12]。然而,大多数相关研究为回顾性研究,而前瞻性研究的数据有限。Lee等[43]在一项小型横断面病例对照研究中,入组了24例华法林相关性ICH患者,同时随机选取48例华法林治疗的无ICH史的患者,结果显示,CMB的存在使得华法林相关性ICH风险增加8倍以上,且CMB的数量(r=0.299,P<0.001)和位置(就CMB分布位置而言,分布在脑叶、基底节及小脑的CMB与华法林相关的ICH呈显著相关;而分布在脑干、丘脑的CMB与华法林相关ICH不相关)与发生ICH风险有关。
另有证据表明,华法林的使用与CMB的进展有关。2015年Saito等[44]的一项前瞻性研究结果显示,华法林的使用与随访1年内新出现CMB独立相关,而接受NOAC治疗的患者未出现CMB进展。Fisher[45]曾指出,伴有CMB的AF患者可能是NOAC治疗的理想人选,因为发生出血不良反应和缺血性结局的风险均较低。目前有3项对不明栓子来源的脑栓塞患者采用NOAC与阿司匹林治疗的比较研究尚在进行中[46]。上述研究均在基线时和结束时对受试者进行CMB评估,在研究结束后,将获得更多关于服用NOAC患者CMB的位置及数量与ICH风险间关系的证据。
四、抗凝治疗前进行CMB筛查的必要性
Fisher[45]提出了≥60岁的AF患者在开始抗凝前进行MRI筛查CMB的流程(见图2)。该流程建议,头颅MRI检查显示无脑叶CMB或脑深部CMB<5个的患者应启动抗凝治疗;对于任何脑叶CMB或脑深部CMB≥5个的患者,建议到神经内科咨询,如果考虑抗凝治疗,应避免使用华法林。此外,在抗凝期间出现神经功能改变的患者应复查头颅MRI,如果MRI显示CMB有进展,则应停止抗凝。因这方面的研究证据非常有限,尚需进一步研究证实该流程的有效性和实用性。
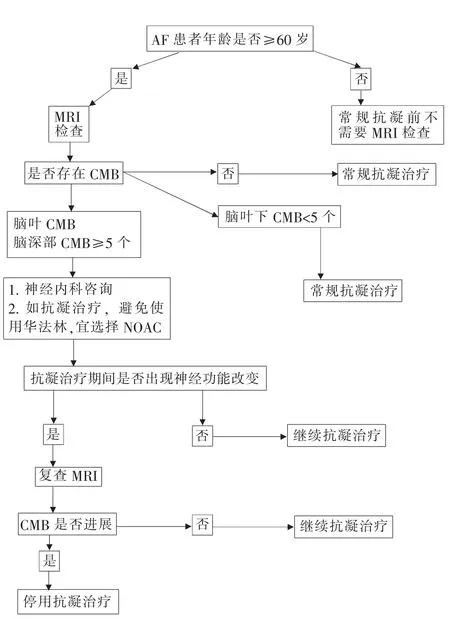
图2 房颤患者抗凝治疗前行MRI筛查的流程图
美国心脏协会和美国卒中协会在2017年发表的无症状脑血管病患者预防卒中的科学声明中提出[47],合并CMB的患者,当有AF等指征时应给予抗凝或抗血小板治疗,不建议在开始治疗前对CMB进行MRI筛查。相信随着前瞻性研究结果和临床试验证据的不断增加,未来的指南可能会在相关方面作出相应的更新。
结论
CMB的存在、数量及位置是预测脑卒中,特别是ICH的重要标志物。根据目前的研究证据,多数情况下,CMB的存在还不足以改变伴有IS的AF患者的抗凝治疗策略。但脑叶CMB和CMB数量较多时,患者不宜接受长期抗凝治疗。总之,还需要设计规范、大规模、前瞻性研究以及根据CMB状态对患者进行分层的随机对照试验,来明确不同亚组的治疗策略。随着一些正在进行中的研究,以及2016年新建立的微出血国际合作网络、微出血联盟(META-MICROBLEEDS Consortium)数据的不断更新[48-49],希望这能为临床抗凝治疗决策提供更多的直接证据。
