慢病毒shRNA沉默Rac1表达抑制胃癌细胞上皮-间质转化的机制
2020-12-01张艺馨黄幼生周晓明王敏健吴文婷郑艺菲
张艺馨,黄幼生,2,解 娜,2,周晓明,2,王敏健,吴文婷,郑艺菲
胃癌是常见的恶性肿瘤之一,其发病率及病死率位居我国恶性肿瘤的第2位,绝大多数患者的死亡与肿瘤的侵袭、转移、复发相关[1]。大部分胃癌分化程度低,具有高度异质性,复发、转移率高,可能与胃癌频繁的遗传改变有较大关系。
Ras相关的C3肉毒素底物1(ras-related C3 botulinum toxin substrate 1, Rac1)是Rho家族的一个重要成员,属于小GTP结合蛋白的Ras超家族,调节着各种各样的细胞事件,包括控制细胞生长、细胞骨架重组和蛋白激酶的激活。Rac1在人类大部分侵袭性肿瘤中有过度活化、高表达现象,如结直肠癌[2]、胃癌[3]、肺癌[4]、乳腺癌[5]等。过表达的Rac1蛋白具有活化MAPK、Wnt、JNK/SAPK、PI3K、NF-κB等信号传导途径,参与肿瘤血管形成、抑制肿瘤细胞凋亡、促进其增殖;调节细胞黏附、骨架蛋白的合成与降解、层形足板的形成提升癌细胞的移动能力;诱导癌细胞上皮-间质转化(epithelial-mesenchymal transition, EMT),促进肿瘤的侵袭转移[2-6]等功能。然而,Rac1在胃癌中的作用机制尚未阐明,因此,本实验通过TCGA数据分析Rac1在胃癌组织中的表达情况,qPCR进一步验证;随即应用慢病毒包装Rac1干扰质粒沉默胃癌细胞Rac1的表达,观察细胞的增殖、细胞克隆表达变化等情况,并进一步探讨其作用机制,以期为阐明胃癌的发病机制,及胃癌分子治疗靶标提供理论基础。
1 材料与方法
1.1 病例收集从TCGA数据库(https://portal.gdc.cancer.gov/)中下载胃癌RNA-seq表达的相关数据,应用Python和R数据包对数据进行整合、基因注释,筛选出胃癌及配对正常胃黏膜Rac1基因表达的相关数据。收集海南医学院第一附属医院2017年1月~2018年12月确诊为胃癌,且未经放、化疗的手术标本及配对癌旁组织90例。其中男性53例,女性37例;平均年龄56.7岁。所有样本的采集均经患者或其家属知情同意,同时经海南医学院第一附属医院伦理委员会讨论通过。所有入选病例的病理类型、分期、分级均经两名高级职称病理医师复核。
1.2 主要试剂RPMI 1640液体培养基购自杭州博士德生物公司;标准胎牛血清购自杭州四季青生物公司;靶向Rac1基因序列(5′-TTCTTAACAT CACTGTCTT-3′)设计的shRNA序列(正向:5′-CCT TCTTAACATCACTGTCTT-3′,反向:5′-AAGACAGT GATGTTAAGAAGG-3′),GV248载体连接及慢病毒包装由上海吉凯基因公司合成、扩增;BCA试剂盒、CCK-8试剂盒均购自碧云天生物研究所;Rac1、β-actin、N-cadherin、Snail、MMP-9、ERK1/2一抗及二抗均购自美国Abcam公司;E-cadherin、vimentin购自杭州博士德生物公司(用于Western blot)及福州迈新生物公司(用于免疫组化)。
1.3 RNA提取采用天根生物公司RNAprep Pure FFPE Kit提取胃癌及癌旁正常胃黏膜组织总RNA,按试剂盒说明进行提取:切取各石蜡样本6 μm厚8张放置在1.5 mL EP管中,经二甲苯脱蜡、乙醇清洗后,移除上清、完全挥发乙醇;加入裂解液RF以及Proteinase K于沉淀中,55 ℃孵育15 min,后80 ℃孵育15 min到组织完全溶解至透明;再加入缓冲液RB及无水乙醇后,将液体转移至核酸吸附柱,离心弃除废液;随后去除DNA、蛋白后清洗2遍,室温晾干后,用ddH2O洗脱RNA收集备用。采用天根生物RNAprep Pure Cell Kit提取培养细胞总RNA,按试剂说明书进行操作,取出呈对数生长的培养细胞,清洗后在培养瓶中直接加入裂解液RL,常温裂解5 min后转移至1.5 mL EP管中,其余步骤同石蜡组织提取RNA。
1.4 细胞培养人胃癌MGC-803细胞购自上海中国典型生物保藏中心。细胞孵育在含有100 mL/L胎牛血清、100 U/mL青霉素、100 U/mL链霉素双抗混合液的RPMI 1640细胞培养液中,于37 ℃ 5%CO2培养箱中培养。细胞生长融合度达80%满度时,取对数生长期的细胞用于实验研究。
1.5 细胞感染将人胃癌MGC-803细胞分为空白对照组(未感染Rac1-shRNA干扰质粒及GFP-shRNA阴性对照质粒)、阴性对照组(感染GFP-shRNA阴性对照质粒)和Rac1干扰组(感染Rac1-shRNA干扰质粒)。转染前1天将MGC-803细胞按1×105个/孔接种于6孔板,24 h在细胞对数生长期内进行感染,具体转染步骤按吉凯基因慢病毒感染说明书进行。在1 mL无血清及抗生素的培养基中加入4×106TU目标病毒、40 μL HiTran GP感染增强液(25×),分别转染入Rac1干扰组及阴性对照组细胞,2~3天后在倒置荧光显微镜下观察细胞感染效率。在感染效率超过90%,细胞生长80%满度,且细胞处于对数生长期时,收集细胞待用。
1.6 qPCR检测应用Primerprimer 7.0软件设计Rac1及GAPDH基因mRNA引物,Rac1上游引物序列5′-ATGTCCGTGCAAAGTGGTATC-3′,下游引物序列5′-CTCGGATCGCTTCGTCAAACA-3′;GAPDH上游引物序列5′-GCCAAAAGGGTCATCATCTC-3′,下游引物序列5′-GTAGAGGCAGGGATGATGTTC-3′。qPCR检测按文献[8]进行:收集各组细胞,提取总RNA,qPCR反应体系及反应程序按天根生物公司Taq PCR MasterMix试剂盒说明书设定,在ViiA system qPCR检测仪中进行。qPCR结果按2-ΔΔCt方法计算。相对于GAPDH表达值,≥配对黏膜组织1.5倍的病例归为高表达组,<1.5倍为低表达组。
1.7 细胞增殖检测取对数生长期的MGC-803细胞,以2 000个/孔接种于96孔细胞培养板中,每组设置3个复孔,按照上文1.5的方法进行慢病毒感染,8 h换去转染液,再继续培养12、48、72 h,每孔细胞中加入CCK-8试剂10 μL,于37 ℃、5%CO2条件下继续孵育2 h,酶标仪测定490 nm的吸光度,计算细胞增殖率。
1.8 细胞克隆实验将感染后胃癌细胞按每组800个种植于6孔板中,每组3复孔,置于37 ℃ 5% CO2恒温箱中培养,每隔3天换液1次;培养至控制组大多数克隆细胞数>50时终止,PBS洗涤2次、多聚甲醛固定、GIEMSA染色、拍照、计数克隆数及平均克隆大小。
1.9 Western blot法收集并裂解各组细胞,BSA法定量。加入上样缓冲液变性后以每孔30 μg上样,电泳分离,转膜,固定蛋白于PVDF膜上,漂洗,5%脱脂奶粉常温封闭2 h,加入Rac1(1 ∶1 000)、ERK1/2(1 ∶500)、p-ERK1/2(1 ∶500)、E-cadherin(1 ∶500)、vimentin(1 ∶500)、N-cadherin(1 ∶500)、Snail(1 ∶500)、MMP-9(1 ∶500)、β-actin(1 ∶1 000)一抗4 ℃孵育过夜,洗涤3遍,加入二抗(1 ∶4 000)常温孵育1.5 h,TBST缓冲液洗涤3遍,ECL底物显色,分析其光密度、计算各目标蛋白相对表达量(β-actin为内参)。
1.10 统计学分析采用SPSS 22.0软件进行统计学分析,计量资料采用studentT检验,计数资料用百分比或率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织中Rac1基因的表达从TCGA数据库中共提取373例胃癌组织相关数据,删除信息不全、罕见类型胃癌病例后计入统计分析。分析显示Rac1在胃癌组织中的表达明显高于配对正常胃黏膜组织,差异有显著性(P<0.001,图1)。90例胃癌及其配对正常胃黏膜石蜡组织提取总RNA后进行qPCR检测,结果显示,胃癌组织中Rac1表达明显高于配对正常胃黏膜组织,胃癌组织表达强度是正常胃黏膜组织的1.53倍,其中癌组织阳性率为76.0%,显著高于正常胃黏膜组织(12.2%),差异有显著性(P=0.03)。Rac1表达增强与胃癌转移、分期、浸润深度显著相关(P<0.01),与患者年龄、性别、肿瘤部位、分化程度等无明显相关性(P>0.05,表1)。
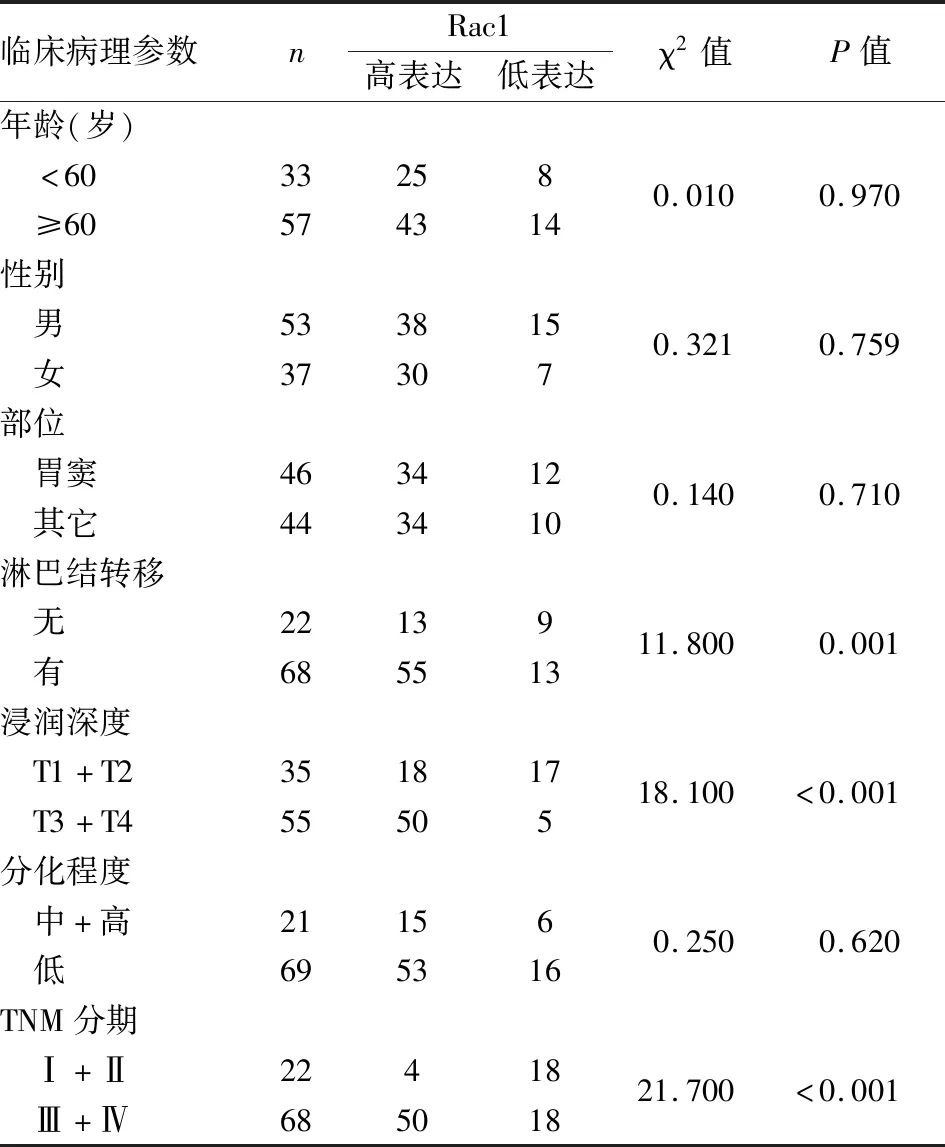
表1 胃癌中Rac1的表达与临床病理特征的关系
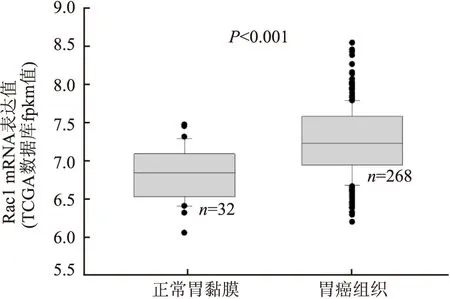
图1 TCGA数据分析Rac1 mRNA在胃癌及其配对正常胃黏膜组织中的表达
2.2 RNAi沉默Rac1基因表达的效率慢病毒包装Rac1-shRNA干扰质粒及GFP阴性对照质粒感染胃癌MGC-803细胞3天后,倒置荧光显微镜下观察,阴性对照组及Rac1干扰组细胞出现绿色荧光表达,10个高倍视野下观察仅个别细胞未表达,感染效率在90%以上,空白对照组无荧光表达(图2)。qPCR检测结果显示,相比阴性对照组,Rac1干扰组细胞的Rac1基因表达明显下调,干扰效率达72.2%,差异有显著性(P<0.01,图3)。
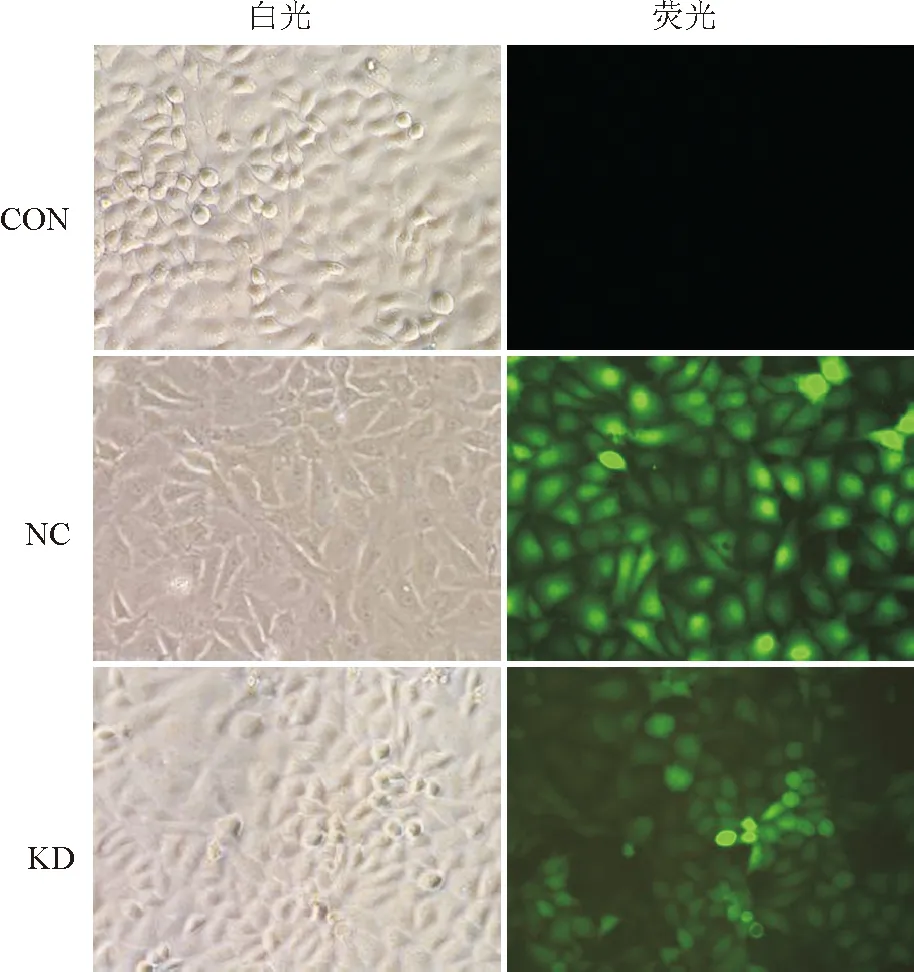
图2 Rac1慢病毒感染MGC-803细胞白光及荧光图:CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组
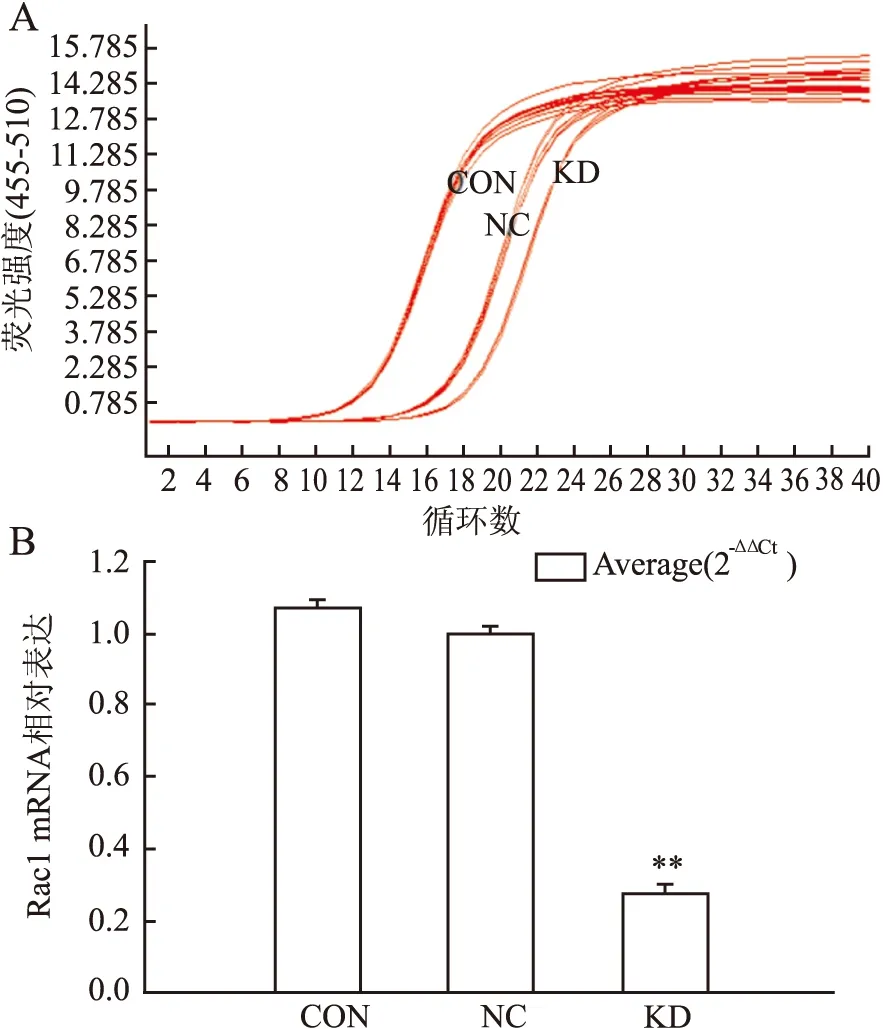
图3 Rac1慢病毒感染MGC-803细胞干扰效率检测:A. qPCR检测Rac1、GAPDH mRNA扩增曲线图;B.Rac1基因相对表达柱状图;CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组;KD与NC相比,**P<0.01
2.3 MGC-803细胞的增殖能力应用CCK-8实验检测Rac1基因沉默前、后MGC-803细胞生长变化,结果显示Rac1干扰组细胞生长速度明显低于阴性对照组,24 h抑制效率为49.9%(P=0.028,图4)。细胞克隆形成实验同样显示(图5),Rac1表达抑制后,细胞克隆形成率明显降低,克隆体积显著缩小,Rac1干扰组是阴性对照组克隆形成率的50.9%(P=0.001),平均体积是阴性对照组的67.3%(P=0.033)。表明沉默Rac1表达能降低胃癌细胞的生长速度及肿瘤克隆形成。
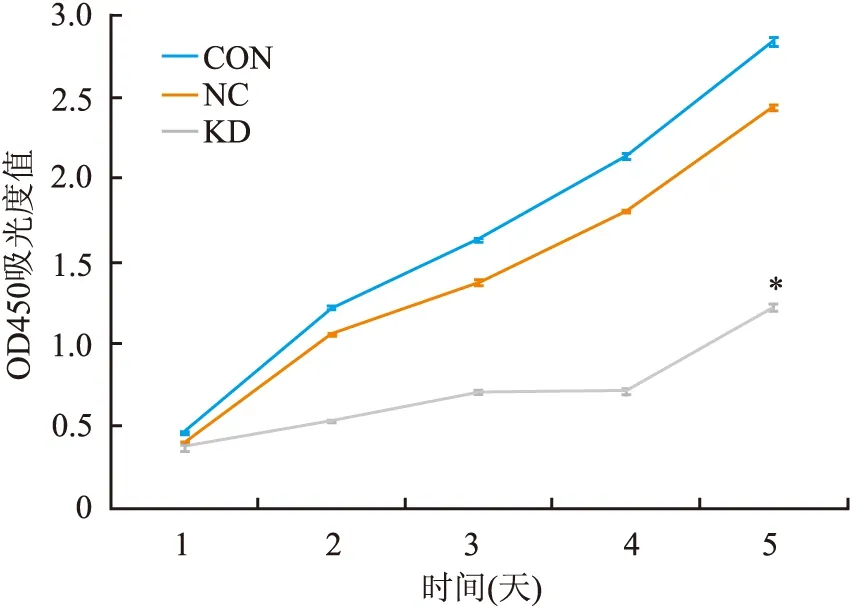
图4 CCK-8实验检测Rac1基因沉默前后MGC-803细胞生长情况:CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组;KD与NC相比,*P<0.05
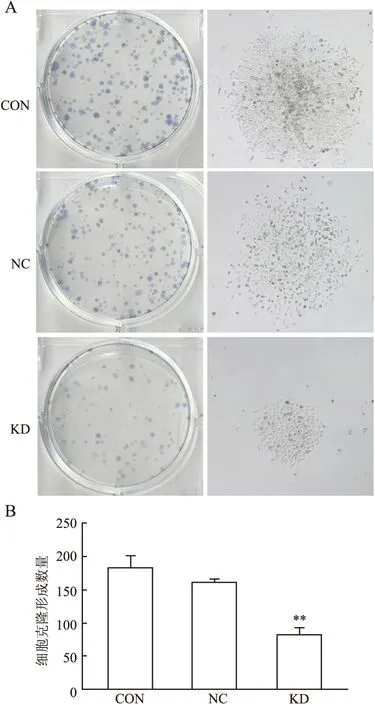
图5 Rac1基因沉默前后MGC-803细胞克隆形成情况:A.细胞克隆平板Giemsa染色及显微镜白光图;B.细胞克隆计数柱状图;CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组;KD与NC相比,**P<0.01
2.4 Rac1基因沉默后胃癌细胞EMT标志物的表达沉默胃癌细胞MGC-803 Rac1基因表达后,本实验继而检测Rac1基因对胃癌细胞EMT的影响。Western blot(图6)及免疫组化(图7)结果表明:相对于空白对照组及阴性对照组,Rac1干扰组细胞E-cadherin表达上调,vimentin、N-cadherin表达下调,表明沉默Rac1基因能够抑制胃癌细胞EMT。
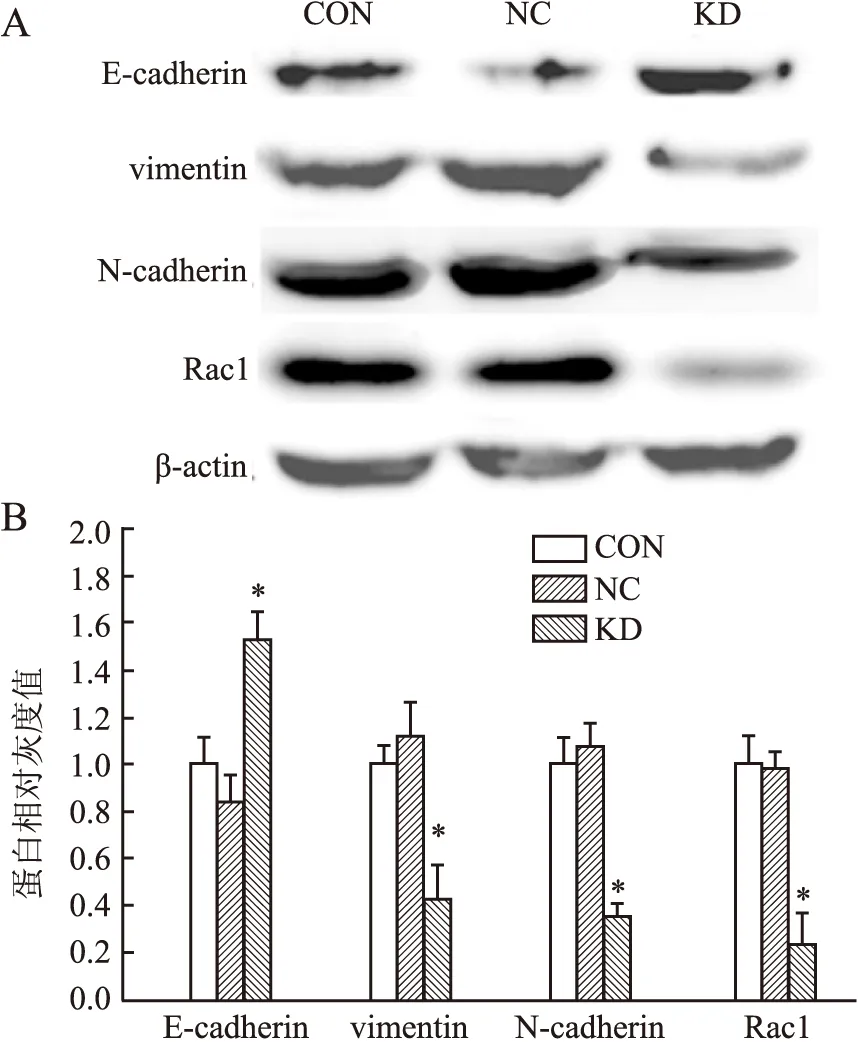
图6 Western blot法检测Rac1基因沉默后胃癌细胞EMT标志物的表达变化:A.Western blot条带图;B.Western blot条带灰度扫描相对值;CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组;KD与NC相比,*P<0.05
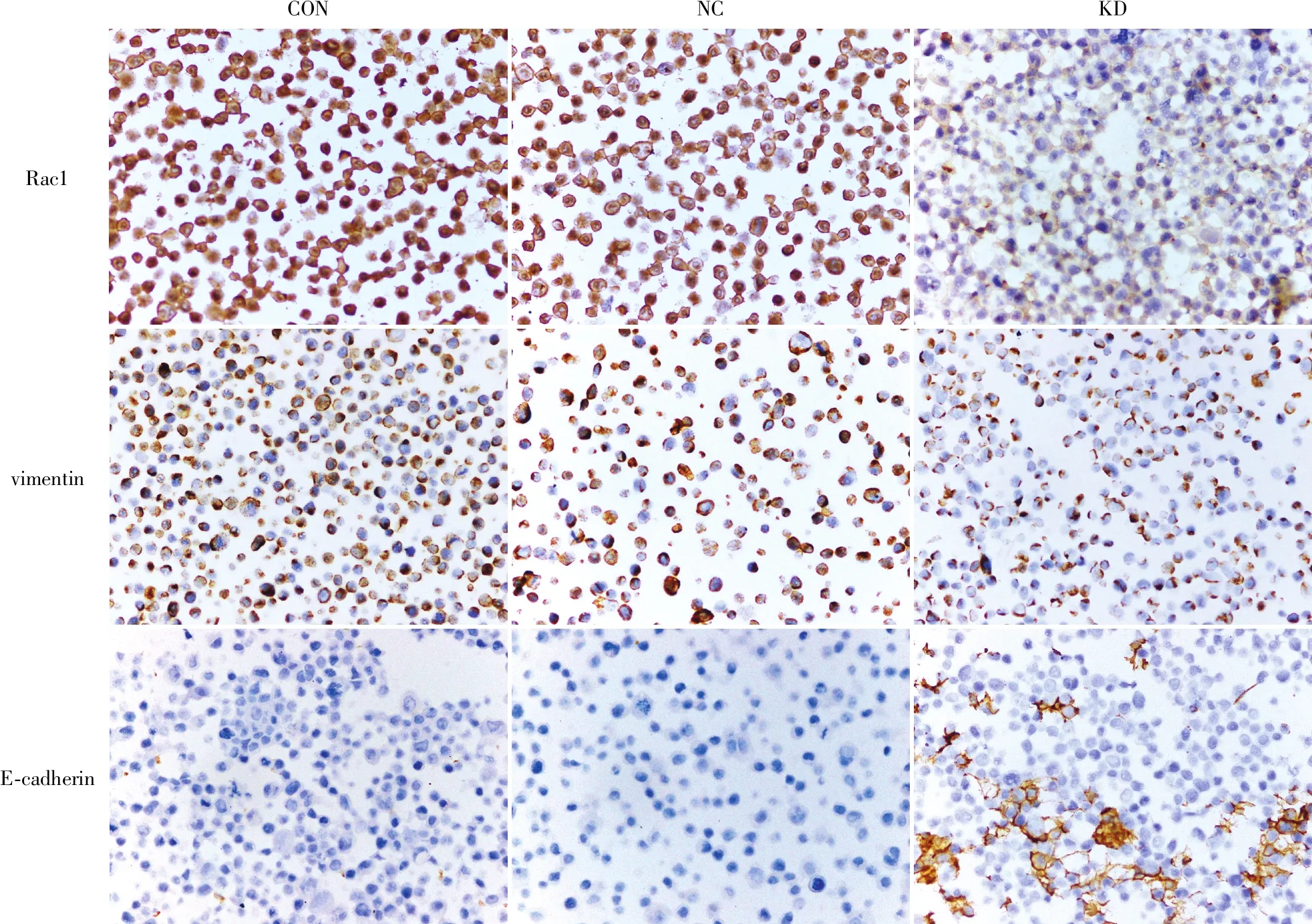
图7 免疫组化法检测Rac1基因沉默后胃癌细胞EMT标志物的表达变化:CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组,EnVision两步法
2.5 Rac1基因沉默后胃癌细胞ERK1/2信号通路蛋白表达变化已有研究表明Rac1蛋白表达变化能够引起细胞中ERK1/2蛋白发生磷酸化,本实验利用shRNA沉默胃癌MGC-803细胞Rac1基因表达后,应用Western blot法检测细胞ERK1/2磷酸化及其下游蛋白表达水平。结果发现,与阴性对照组相比,Rac1干扰组细胞总ERK1/2蛋白表达水平无明显变化,但ERK1/2蛋白磷酸化水平明显降低(P=0.041,图8);与阴性对照组相比,ERK信号通路蛋白Snail、MMP-9蛋白表达水平降低(P<0.05)。
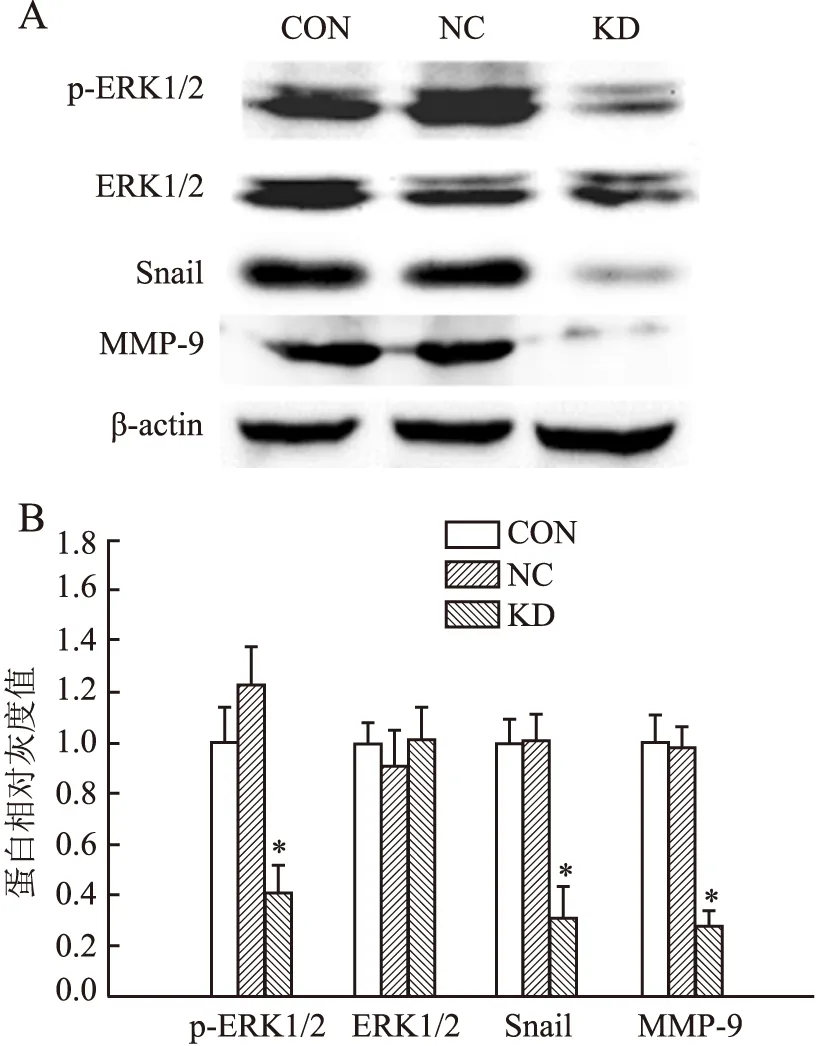
图8 Western blot法检测Rac1基因沉默后胃癌细胞ERK1/2通路蛋白表达变化:A.Western blot条带图;B.Western blot条带灰度扫描相对值;CON.空白对照组;NC.阴性对照组;KD.Rac1干扰组;KD与NC相比,*P<0.05
3 讨论
Rac亚家族包括Rac1、Rac2、Rac3和Rac1的剪切突变体Rac1b。Rac1基因全长29 kb,包含7个外显子,位于人染色体7p22。Rac1基因的转录产物有1.2 kb和2.5 kb两种。Rac1是细胞内重要的信号转导分子,是肿瘤细胞迁移侵袭的重要调控分子。Rac1蛋白在人类大部分侵袭性肿瘤中没有发现突变体,但发现有过度活化、高表达现象。在胃癌、肺癌、乳腺癌、睾丸肿瘤、胰腺癌、头颈部肿瘤等均报道有Rac1表达的异常增高[2-6]。有研究证实Rac1在正常胃组织中低表达或不表达,而在胃癌组织中高表达,其表达程度与胃癌的浸润、远处转移有密切联系[3,6]。
本实验应用TCGA数据分析及qPCR的方法检测胃癌石蜡组织中Rac1的表达情况,同样显示在胃癌组织中Rac1存在高表达,其表达与胃癌组织淋巴结转移、浸润深度、分期有密切关系;实验进一步通过RNA干扰的方法抑制胃癌细胞株MGC-803细胞Rac1表达后,胃癌细胞增殖明显下降,细胞克隆率显著降低,这些实验结果表明Rac1表达增高促进了胃癌的进展,而沉默Rac1表达能抑制胃癌的增殖。
研究认为胃癌的转移可能与癌细胞EMT有关。EMT是指具有极性的上皮细胞转换成为具有活动能力的间质细胞并获得侵袭和迁移能力的过程。当前认为90%以上的上皮细胞恶性肿瘤在发生侵袭与转移过程中发生了EMT,如结肠癌[2]、胃癌[3,7]、肝癌[8]等。EMT以上皮细胞表型的丧失及间质特性的获得为重要特征,具体包括上皮细胞黏附分子(如E-cadherin等)表达减少、间质细胞黏附分子(N-cadherin)表达增加、角蛋白(如Cytokeratin18等)为主的细胞骨架转变为波形蛋白为主(如vimentin等)的细胞骨架,从而引起细胞形态的改变。这种表型的转换允许肿瘤细胞摆脱细胞-细胞间连接,而表现得更具侵袭性,因此与肿瘤细胞的侵袭、转移关系密切[7,9-10]。本实验也证实在低分化胃癌细胞株MGC-803细胞E-cadherin表达丢失,而间叶标记vimentin、N-cadherin表达增高,证实MGC-803细胞发生了EMT。
研究表明过表达的Rac1能够刺激新的肌动蛋白聚合,通过活化靶蛋白Scar/Wave激活Arp2/3复合体,该复合体是一种肌动蛋白相关蛋白,能刺激肌动蛋白单体的成核作用,从而导致新的肌动蛋白丝形成,加快细胞移动[2-6,11]。活化的Rac1能激活NF-κB,调节uPA和MMP-9,活化核转录因子Snail,Snail能结合E-cadherin启动子,抑制E-cadherin蛋白表达,从而诱导细胞EMT,促肿瘤侵袭、转移[2-6,12]。有研究显示,应用Rac1抑制剂NSC23766处理胃癌细胞后,能阻滞癌细胞EMT,从而降低癌细胞转移率[2-3]。本实验也证实在应用慢病毒介导Rac1-shRNA抑制胃癌细胞Rac1表达后,胃癌细胞间质表型vimentin、N-cadherin及MMP-9表达下调,而上皮标记E-cadherin表达上调,表明Rac1表达与胃癌EMT相关,沉默Rac1表达能够部分逆转胃癌细胞EMT,进而抑制肿瘤细胞生长、转移。
研究显示Rac1高表达诱导细胞EMT与增强p38α、AKT、ERK和GSK3β的磷酸化有关[2-6,11]。多种EMT诱导因子能通过激活ERK信号通路调控细胞EMT,证明ERK信号通路是EMT的关键协调因子[13]。积累的研究表明,活化的Rac1能激活MAPK信号通路,促进ERK1/2的磷酸化,磷酸化的ERK1/2(p-ERK1/2)能诱导Snail及MMP-9表达增加,从而降低E-cadhern表达,向N-cadherin、vimentin等间质表型转换,最终诱导EMT的发生[11,14]。有研究显示沉默Rac1表达或抑制Rac1活性能降低ERK的磷酸化程度,进而减少Snail,上调E-cadherin等的表达,逆转癌细胞EMT[3,15]。本实验显示,应用慢病毒介导Rac1-shRNA沉默Rac1表达后,ERK1/2的磷酸化程度显著降低,Snail及MMP-9表达降低,进而阻断胃癌细胞EMT。这些实验结果表明沉默Rac1表达抑制胃癌细胞EMT可能与降低ERK1/2磷酸化有关。
综上所述,Rac1在胃癌组织中高表达,与胃癌转移和浸润相关;沉默Rac1的表达,能抑制胃癌细胞EMT,从而降低胃癌细胞增殖,可能与降低ERK1/2磷酸化程度有关。Rac1过表达在胃癌的发展中可能起到关键作用,或能成为胃癌靶向治疗的另一靶标。
