超声波辅助提取山竹果壳色素及其抑菌活性的研究
2020-12-01胡元庆张娇李凤霞
胡元庆,张娇,李凤霞
(闽南师范大学 生物科学与技术学院,福建 漳州 363000)
山竹(Garciniamangostana)是一种藤黄科藤黄属植物,原产于印度尼西亚群岛,现主要种植于马来西亚、菲律宾、泰国、越南和中国等地。果实呈球形,成熟时果壳呈紫红色,占鲜果重的52%~68%,果肉呈透明的白色[1,2]。果壳含有丰富的红色素,可作为天然食用色素的原料,该红色素对热、光和酸度有较好的稳定性,可应用于碳酸饮料的着色[3]。山竹作为一种药食同源性水果,以鲜食果肉为主,而果壳一般被作为废弃物处理,既不利于环境保护,也不利于天然植物资源的有效利用[4]。在东南亚,山竹果皮作为泰国传统医药,可治疗痢疾、腹泻、腹痛、化脓、淋病、感染性创伤、慢性溃疡等疾病[5]。有研究曾报道,山竹果壳提取物具有抗氧化、抗菌消炎、抗肿瘤等多方面的医学活性[6]。果皮中的氧杂蒽酮是决定其抗菌作用的主要成分,研究发现其对金黄色葡萄球菌、霍乱弧菌和幽门螺杆菌都有很好的抑制作用[7-9]。
现代食品工业依靠色素和添加剂赋予食品丰富的品相和足够长的保质期,其中天然色素不但可以有效使加工食品着色[10],安全无毒,而且绝大多数具有生物活性功能[11]。因此,开发利用山竹果壳不仅可以变废为宝,还可以减轻环境污染压力,进一步提高山竹产业的经济效益。从山竹果壳中提取红色素,可为现代食品工业中的天然色素寻求新的来源,也能减少人工合成色素用于食品着色而产生的毒理学风险[12]。随着科学技术的发展,现常用超声波辅助提取法、微波辅助提取法、酶解提取法等方法提取[13-17]。故本文以山竹果壳为原料,通过单因素试验和正交试验探索超声波辅助提取山竹果壳色素的最优工艺条件,进一步探讨其对几种常见食源性病原菌的抑菌活性、最低抑菌浓度和最低杀菌浓度。这对于开发应用天然植物色素提供了新的途径和理论依据,具有良好的发展潜力和广阔的应用前景。
1 材料与方法
1.1 材料与仪器
山竹:购自漳州新华都超市;无水乙醇:西陇科学股份有限公司;普通肉汤、营养琼脂、TCBS琼脂:北京陆桥技术有限公司;副溶血性弧菌ATCC17802、金黄色葡萄球菌CMCC26003、沙门氏菌50041、志贺氏菌B4、大肠杆菌D5:由漳州海关综合技术服务中心微生物检测室惠赠,在生物科学与技术学院实验室保存备用。
DHG-9030A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;FW100高速万能粉碎机 天津市泰斯特仪器有限公司;KQ-200VDE超声波清洗器 昆山市超声仪器有限公司;MIKRO 220R高速冷冻离心机 德国Hettich公司;SW-CJ-1FD超净工作台 苏净集团苏州安泰空气技术有限公司;BXM-30R立式压力蒸汽灭菌器、GSP-9050MBE隔水式恒温培养箱 上海博迅实业有限公司医疗设备厂;UV-1100紫外可见分光光度计 上海美谱达仪器有限公司;HQY-C恒温振荡摇床 金坛市鸿科仪器厂;RE-2000旋转蒸发仪 上海亚荣仪器有限公司。
1.2 试验方法
1.2.1 原料预处理
将新鲜山竹果壳清洗干净后自然晾干,置于电热恒温鼓风干燥箱中60 ℃干燥12 h。干燥后的果壳在万能粉碎机中粉碎5 min,过60目筛,收集粉末密封保存备用。
1.2.2 最大波长测定
称取果壳粉0.5 g于三角瓶中,按照料液比1∶20加入70%乙醇,在温度65 ℃、功率160 W超声波清洗器中浸提40 min,4000 r/min离心20 min,取上清液2.5 mL定容至10 mL后摇匀,用紫外可见分光光度计在波长360~630 nm范围内测定山竹果壳色素提取液的吸光度。
1.2.3 单因素试验
1.2.3.1 乙醇浓度对山竹果壳色素提取效果的影响
称取0.5 g果壳粉于三角瓶中,配制体积分数为50%、60%、70%、80%、90%的乙醇作为提取剂,按照料液比1∶20加入提取剂,摇动三角瓶使粉末全部溶解,用保鲜膜将三角瓶封口,在温度65 ℃、功率160 W的超声波清洗器中浸提40 min,4000 r/min离心20 min,取上清液2.5 mL定容于10 mL容量瓶中,摇匀,用紫外分光光度计在最大波长478 nm下测定提取液的吸光值,确定最佳乙醇浓度,每个梯度做3组平行,结果取其平均值。
1.2.3.2 提取温度对山竹果壳色素提取效果的影响
称取0.5 g果壳粉置于三角瓶中,按料液比1∶20加入70%乙醇,摇动三角瓶使果壳粉全部溶解,用保鲜膜将三角瓶封口,在功率为160 W、温度分别为35,45,55,65,75 ℃的超声波清洗器中浸提40 min,4000 r/min离心20 min,取上清液2.5 mL定容于10 mL,摇匀,用紫外分光光度计在最大波长478 nm下测定提取液的吸光值,确定最佳提取温度,每个梯度做3组平行,结果取其平均值。
1.2.3.3 提取时间对山竹果壳色素提取效果的影响
称取0.5 g果壳粉于三角瓶中,按料液比1∶20加入70%乙醇,摇动三角瓶使果壳粉全部溶解,用保鲜膜将三角瓶封口,将其放在功率为160 W、温度为65 ℃的超声波清洗器中分别浸提30,40,50,60,70 min,4000 r/min离心20 min,取上清液2.5 mL定容至10 mL,摇匀,用紫外分光光度计在最大波长478 nm下测定山竹果壳色素提取液的吸光值,确定最佳提取时间,每个梯度做3组平行,结果取其平均值。
1.2.3.4 超声波功率对山竹果壳色素提取效果的影响
称取0.5 g山竹果壳粉置于三角瓶中,按料液比1∶20加入70%乙醇,摇动三角瓶使山竹果壳粉充分溶解,用保鲜膜将三角瓶封口,将其放在温度为65 ℃、功率分别为80,120,160,200 W的超声波清洗器中浸提40 min,4000 r/min离心20 min,取上清液2.5 mL定容于10 mL容量瓶中,摇匀,用紫外分光光度计在最大波长478 nm下测定山竹果壳色素提取液的吸光值,确定最佳超声波功率,每个梯度做3组平行,结果取其平均值。
1.2.3.5 料液比对山竹果壳色素提取效果的影响
称取0.5 g山竹果壳粉于三角瓶中,分别按料液比1∶10、1∶20、1∶30、1∶40、1∶50加入70%乙醇,摇动三角瓶使果壳粉全部溶解,用保鲜膜将三角瓶封口,将其放在温度为65 ℃、功率为160 W的超声波清洗器中浸提40 min,4000 r/min离心20 min,取上清液2.5 mL定容于10 mL容量瓶中,摇匀,用紫外分光光度计在最大波长478 nm下测定山竹果壳色素提取液的吸光值,确定最佳料液比,每个梯度做3组平行,结果取其平均值。
1.2.4 正交试验
1.2.4.1 正交试验设计
在单因素试验基础上,利用极差法,选取提取温度、提取时间、超声功率和乙醇浓度4个因素作为考察对象,设计了L9(34)正交试验以优化提取工艺条件。
1.2.4.2 最优组合验证试验
根据多因素的正交试验得到最优工艺条件组合,进行3次验证试验。试验操作同1.2.3,结果取其平均值。
1.2.5 山竹果壳色素成品制备
称取20.0 g山竹果壳粉置于三角瓶中,按照最佳料液比、最佳乙醇浓度加入提取剂,摇动三角瓶使果壳粉全部溶解,用保鲜膜将三角瓶封口,设置超声波清洗器在最佳超声功率、最佳提取温度和最佳提取时间条件下进行提取。以4000 r/min离心20 min,将所有上清液倒入45 ℃、0.09 MPa、75 r/min的旋转蒸发仪中浓缩1 h使溶液成黏稠状,再将其在60 ℃电热恒温鼓风干燥箱中干燥12 h,即得到山竹果壳色素成品。
1.2.6 抑菌活性
1.2.6.1 滤纸片法检测抑菌圈
采用滤纸片扩散法测定抑菌活性。无菌操作将待测试5种细菌菌悬液的浓度调整为106~107CFU/mL,吸取200 μL涂布于相应培养基上。用无菌镊子将浸泡在山竹果壳色素溶液和无菌生理盐水中的滤纸片取出晾干,贴到培养基上,每个培养皿等距贴4片(山竹果壳色素溶液和无菌生理盐水浸泡过的各贴2片),每种菌重复3次。将处理过的培养皿倒置在37 ℃隔水式恒温培养箱中培养24 h。用直尺量取各滤纸片周围的抑菌圈直径大小,取3次试验结果的平均值。
1.2.6.2 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
采用试管二倍稀释法测定最低抑菌浓度(MIC)[18]。取6根干净的试管,按照二倍稀释法配制不同浓度的山竹果壳色素溶液(10,5,2.5,1.25,0.625 mg/mL,6号试管不加样液做空白对照),在每根试管中均加入各种供试菌菌悬液0.05 mL,不同浓度的色素溶液0.2 mL,每个供试菌种做3个平行,然后放在37 ℃摇床培养24 h,观察试管中无细菌生长的最低浓度即为该山竹果壳色素的最低抑菌浓度(MIC)。从上述无菌生长的每根试管中吸取0.2 mL样液,采用平板涂布法均匀涂布于平板培养基上,在37 ℃隔水式恒温培养箱中倒置培养24 h,以含色素量最少且平板上无菌生长的试管,对应的浓度为山竹果壳色素对该供试菌种的最低杀菌浓度(MBC)。
1.3 数据处理
采用GraphPad Prism 5.0统计软件进行数据处理和作图,单因素试验中指标均测定3次,用X±SD表示。
2 结果与分析
2.1 最大吸收波长选择
山竹果壳色素提取液在波长360~630 nm之间有一个最大吸收峰(位于478 nm处),因此该山竹果壳色素在可见光区的最大吸收波长为478 nm(见图1),与赖萱等对山竹果皮色素的最大吸收波长一致。

图1 山竹果壳色素的吸收光谱
2.2 单因素试验结果
2.2.1 乙醇浓度对山竹果壳色素提取效果的影响
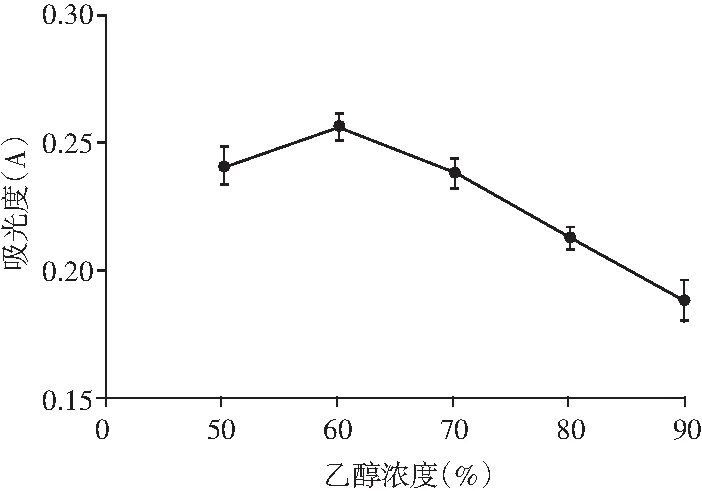
图2 乙醇浓度对山竹果壳色素提取效果的影响
山竹果壳色素是醇溶性物质,由图2可知,随着乙醇浓度升高,色素提取液的吸光值先逐渐升高,当乙醇浓度超过60%时,果壳色素提取液的吸光值下降。这可能是因为当乙醇浓度越大时,山竹果壳中的其他醇溶性、脂溶性杂质溶出增加,竞争性地减少了提取剂中色素的含量,从而使山竹果壳色素提取液的吸光值呈逐渐下降趋势[19]。
2.2.2 提取温度对山竹果壳色素提取效果的影响

图3 提取温度对山竹果壳色素提取效果的影响
由图3可知,随着提取温度的升高,山竹果壳色素提取液的吸光值也逐渐增大,当提取温度超过55 ℃时,色素提取液的吸光值又逐渐减小。这可能是由于适宜的高温可加快分子的热运动,加快分子渗透、扩散和溶解速度,提高色素溶解度。但过高的温度可能会引起山竹果壳色素的氧化降解,同时其他杂质随着温度升高溶出率也增加,最终使色素得率受到影响。
2.2.3 提取时间对山竹果壳色素提取效果的影响
由图4可知,在60 min之前,随着提取时间的延长,山竹果壳色素提取液的吸光值也逐渐增大,即山竹果壳色素的提取量增加。原因可能是在这个时间段山竹果壳的细胞壁基本破坏完全,且溶剂挥发较少,有利于色素分子的溶出[20]。当提取时间大于60 min时,山竹果壳色素提取液的吸光值随时间的延长又逐渐降低,是因为提取时间过长,色素分子被光照等因素氧化破坏,导致山竹果壳色素提取液的吸光值降低。
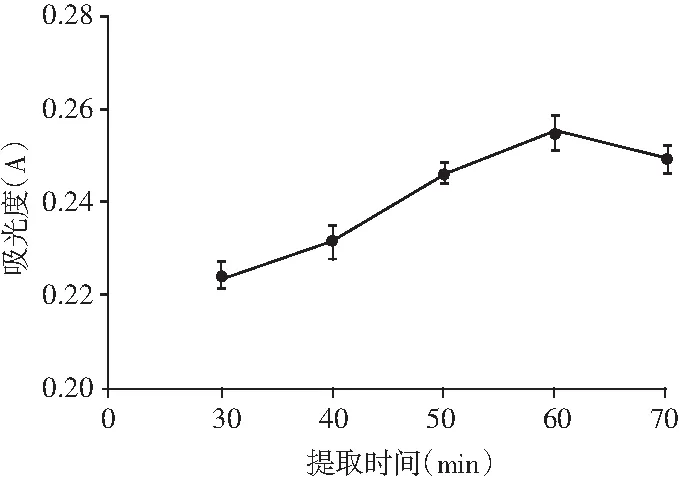
图4 提取时间对山竹果壳色素提取效果的影响
2.2.4 超声波功率对山竹果壳色素提取效果的影响
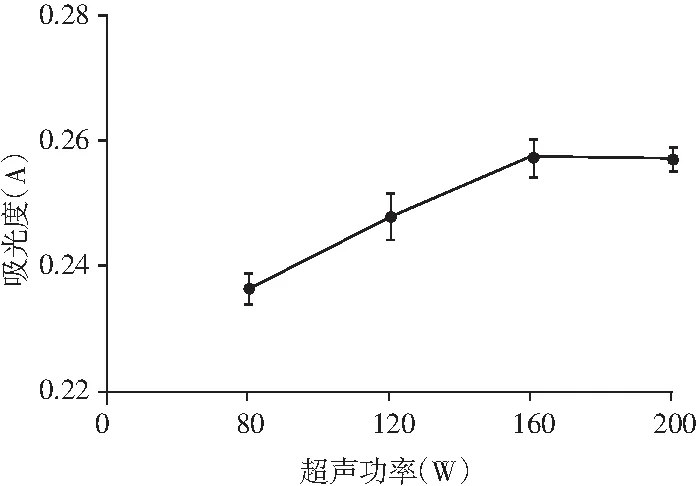
图5 超声波功率对山竹果壳色素提取效果的影响
由图5可知,山竹果壳色素提取液的吸光值随着超声波功率的增大也逐渐增大,当功率达到160 W时,增加的幅度非常小。可能是因为对于一定频率的超声波,随着功率的逐渐增大,单位时间内超声产生的空化效应也随之增多。在超声波场中,声波产生的空化效应可造成细胞壁和细胞膜破碎,促进色素溶出。但过高的功率也会使杂质部分溶出率增加,降低色素的提取率。
2.2.5 料液比对山竹果壳色素提取效果的影响

图6 料液比对山竹果壳色素提取效果的影响
由图6可知,随着料液比增加,山竹果壳色素提取液的吸光值逐渐最大。当料液比达1∶40时,色素提取液的吸光值基本平稳。这可能是因为随着料液比的增加,除了溶解有效的色素分子外,还会溶出更多的杂质成分以及消耗大量的提取溶剂,为了减少生产成本和后续的处理难度,因此在后面的正交试验时选取1∶40作为最佳料液比。
2.3 正交因素试验结果
通过对单因素试验的研究,以提取温度(A)、提取时间(B)、乙醇浓度(C)、超声波功率(D)4个因素进行L9(34)正交试验(水平均由单因素试验得出),用吸光值(A478 nm)为指标,确定超声波辅助提取山竹果壳色素的最优工艺。正交试验设计表见表1,正交试验结果见表2,方差分析见表3。

表1 山竹果壳色素正交试验设计表
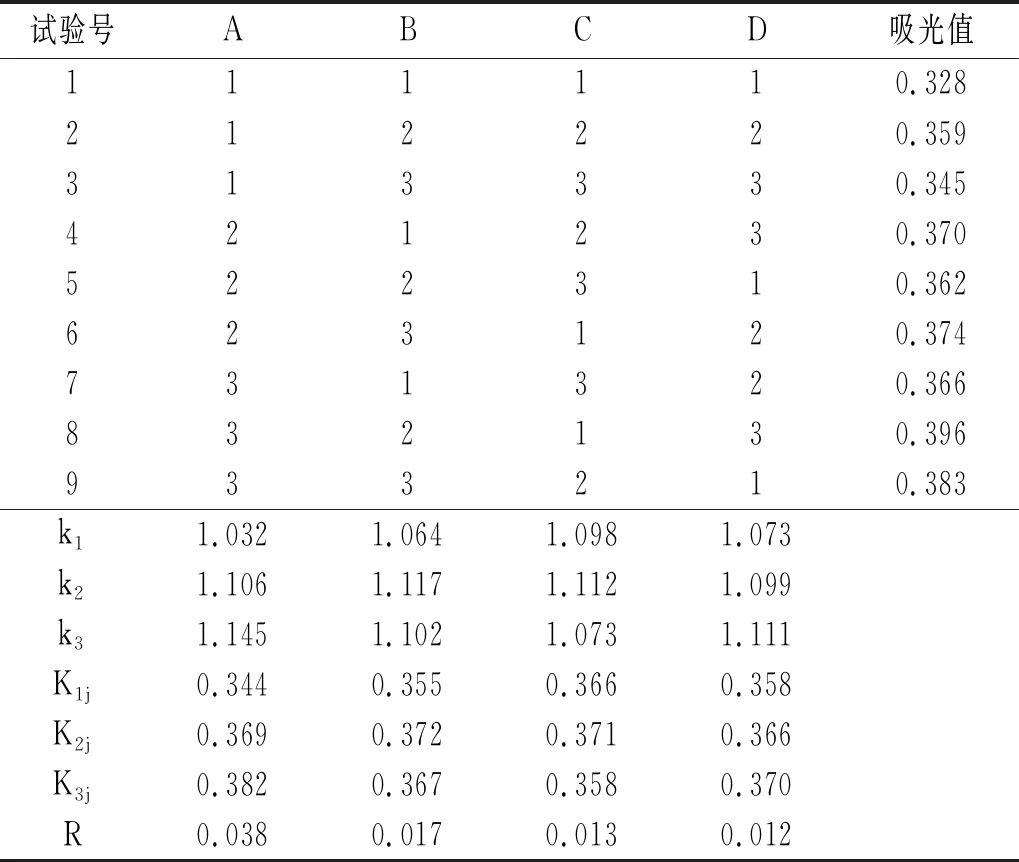
表2 山竹果壳色素提取工艺正交试验结果
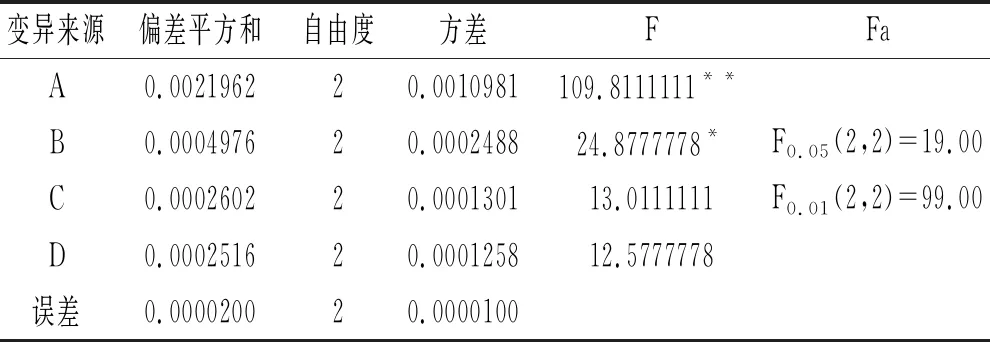
表3 正交试验结果方差分析
由表2可知,8号试验组A3B2C1D3的提取效果最好,即为最优提取工艺条件。由表2极差分析可知,RA>RB>RC>RD,即各个因素对超声波辅助提取山竹果壳色素的影响主次顺序为A(提取温度)>B(提取时间)>C(乙醇浓度)>D(超声波功率)。由表3方差分析可知,提取温度对色素提取效果的影响为极显著,提取时间对色素提取效果的影响为显著,乙醇浓度和超声波功率对色素提取效果的影响不显著,即显著性分析为A(提取温度)>B(提取时间)>C(乙醇浓度)>D(超声波功率)。根据K值以及从高效和经济角度考虑,选择的最佳条件为提取温度65 ℃、提取时间60 min、乙醇浓度60%、超声波功率200 W。综上所述,本试验超声波辅助提取山竹果壳色素的最优工艺条件组合为A3B2C2D3。
2.4 最优工艺条件验证试验结果
选取所得最优工艺组合,对山竹果壳色素进行提取,对正交试验所得结论进行了3次验证试验,结果所得吸光值的平均值为0.463,证实了A3B2C2D3为最优组合。
2.5 测定供试菌种抑菌圈直径试验结果

表4 山竹果壳色素对供试菌种抑菌圈直径结果
由表4可知,山竹果壳色素对沙门氏菌、金黄色葡萄球菌、副溶血性弧菌、大肠杆菌、志贺氏菌的抑菌圈直径依次在减小。测量5种供试菌抑菌圈直径大小,山竹果壳色素对沙门氏菌的抑菌效果最强,对金黄色葡萄球菌的抑菌效果次之,对副溶血性弧菌的抑菌效果较弱,对大肠杆菌和志贺氏菌没有抑菌效果。
2.6 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)的测定
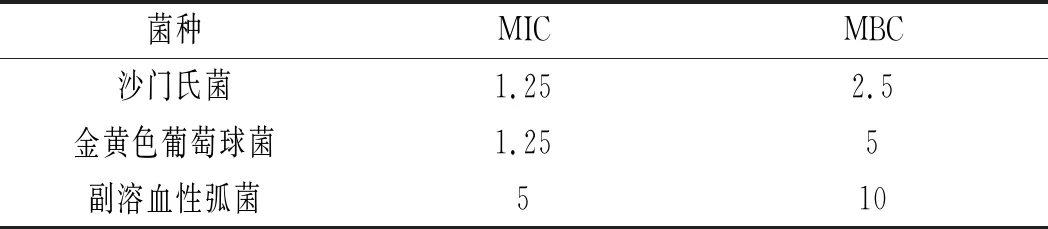
表5 山竹果壳色素对测试菌的MIC和MBC结果
由表5可知,山竹果壳色素溶液对3种供试菌均有明显抑菌效果。山竹果壳色素溶液对沙门氏菌和金黄色葡萄球菌的MIC为1.25 mg/mL,对副溶血性弧菌的MIC为5 mg/mL。山竹果壳色素溶液对沙门氏菌的MBC为2.5 mg/mL,对金黄色葡萄球菌的MBC为5 mg/mL,对副溶血性弧菌的MBC为10 mg/mL。
3 结论
本研究以泰国山竹作为试验材料,采用了超声波辅助提取法提取山竹果壳色素,选取乙醇作为提取剂,以提取时间、提取温度、乙醇浓度、超声波功率和料液比作为影响试验的主要因素,根据L9(34)正交试验结果及验证试验,最终确定出超声波辅助提取山竹果壳色素的最优工艺条件为:提取温度65 ℃、提取时间60 min、乙醇浓度60%、超声波功率200 W、料液比1∶20,此条件下山竹果壳色素提取液的吸光值为0.463。与传统的提取方法相比较,本研究所采用的超声波辅助提取方法操作简单、时间短、提取效率高、节约溶剂、成本低等。山竹果壳色素对常见食源性病原菌沙门氏菌和金黄色葡萄球菌有明显的抑菌作用,对副溶血性弧菌的抑菌作用较弱,对大肠杆菌和志贺氏菌没有抑菌作用。这些研究为山竹果壳色素在产业化应用中提供了重要的参考,同时为山竹副产物生物功能特性的进一步开发利用提供了依据。
