基于光干涉原理的生物亲和性检测环境中甾体类激素
2020-11-30吴再辉
吴再辉

摘 要:目的:基于光干涉原理的生物亲和性检测技术,实现甾体类激素动力学参数及定性与定量检测。方法:利用阻遏蛋白RepA与3α-HSD/CR的回文序列基因及甾体类激素的特异性结合,建立一种非标记光学原理的甾体类激素检测新方法。结果:检测了睾丸酮丛毛单胞菌双链DNA OP1与RepA特异亲和性,亲和常数KD为9.865×10-9M,建立了环境监测中双链DNA OP1与RepA抑制法的甾体类激素总量定量检测新方法,最低检测限0.45ng/ml;结论:本文在研究光干涉生物亲和性关键检测技术基础上,建立快速、灵敏、特异的环境监测中甾体类激素总量的新型应用检测方法,实现甾体类激素的定量检测,为环境监测领域的生物应用提供新方法。
关键词:光干涉原理;甾体类激素;3α-羟类固醇脱氢酶/碳酰基还原酶(3α-HSD/CR);阻遏蛋白RepA
生物分子的亲和性检测是指通过实时监测其相互作用过程,获得分子间是否发生作用,作用强度等信息,揭示微观生命活动规律的重要方法。该方法具有检测时间短、精度高、成本低廉等特点,对病毒、细菌及毒素的检测、临床用药筛选等方面有着广泛的应用[1-3],是目前检测领域研究热点。
甾体类激素在维持生命和调节性功能等方面有着极其重要的作用。人工合成激素类物质能够模仿生理激素对生物体产生诱导反应,干扰体内代谢信号通路[4],属于一类致癌物质[5]。目前,对于环境甾体类激素的检测主要以液相与质谱等大型进口仪器为主[6,7],价格昂贵、操作复杂、仅适用于实验室环境检测,并且仅能检测单一组分的已知环境甾体类激素污染物,因此迫切需要建立一种快速、灵敏、高通量、实时、原位检测环境甾体类激素总量的新方法。
睾丸酮丛毛单胞菌(C.testosteroni,C.T.)ATCC 11996是一种以甾体类激素作为碳源及能源[8,9]的微生物,其中3α-羟类固醇脱氢酶/碳酰基还原酶(3α-HSD/CR)在甾体类激素代谢途径中发挥至关重要的作用[10,11]。其基因上游含有两个10bp回文操纵序列[12],其基因附近还有一个RepA,在没有甾体类激素时,RepA与回文序列基因相结合,抑制3α-HSD/CR的表达;当有甾体类激素存在时,RepA与甾体类激素特异性结合,构象发生改变,启动3α-HSD/CR基因的表达功能[13]。
本文將dsDNA固定到SA光纤探针表面,光干涉生物亲和性传感检测系统实时监测dsDNA与RepA的相互作用曲线,非线性拟合获得相互作用动力学参数;同时建立dsDNA、RepA与甾体类激素间的抑制检测法,以最大响应信号与甾体类激素浓度建立定量关系,实现甾体类激素的定量检测,为环境监测领域的生物应用提供新方法。
1 材料与试剂
睾丸酮标准品,N-月桂酰肌氨酸钠盐(SKL)(购自Dr.Ehrenstorfer);5-Biotin修饰单链DNA(ssDNA)片段(上海生工合成);阻遏蛋白RepA原核表达菌株BL21-pET-15b-RepA(实验室保存)。
2 实验方法
2.1 RepA的表达与纯化
BL21-pET-15b-RepA在110rpm,16℃下进行原核表达,在表达过程中加入终浓度0.5%SKL溶液提取蛋白。采用SDS-PAGE电泳及Bradford方法对纯化蛋白进行鉴定及含量测定[14]。
2.2 OP1的合成
分别合成ssDNA上/下游10OD 5末端标记生物素(Biotin)的含有回文序列的OP1,及阴性对照CO片段。并采用退火方法[15]将合成的单链互补形成双链DNA(dsDNA)。OP1:5bioin-GCAGCTCGGCCATGTCAAAGCCCAGCGGCCCCGCGCCC;CO:5biotin-GGCCACGGTAAATTTTCCCTAGGGGAATTACATCGTCC
2.3 dsDNA与RepA亲和性检测
采用光干涉生物亲和性传感检测系统与SA光纤探针,以dsDNA为生物特异性固定分子研究dsDNA在光纤探针表面的最适固定浓度。检测过程:平衡阶段;最适浓度Biotin-dsDNA固定阶段;平衡阶段;与不同浓度RepA结合反应阶段;解离反应阶段。以dsDNA CO为阴性对照,以PBS-T缓冲液作为dsDNA与RepA蛋白稀释液、空白对照、平衡阶段及解离阶段溶液。所有溶液均吸取200μl置于黑色微孔板内,1000rpm混匀,恒温30℃。
2.4 dsDNA与RepA蛋白抑制法甾体类激素定量检测新方法
以不同浓度睾丸酮标准品与20μg/ml RepA提前孵育,封闭RepA的激素结合位点,使其DNA结合位点构象改变。方法见2.3。
2.5 方法学可行性对比
采集吉林省内某养殖鱼塘水样,采用氯仿粗提法提取水样中的甾体类激素,然后分别采用HPLC方法、非细胞体系高效生物化学发光传感器方法[16]及本文建立方法对鱼塘水样中睾丸酮含量进行检测,研究方法精密度与准确度。
3 结果
3.1 RepA的鉴定
如图1所示,表达及纯化的RepA蛋白分子量为48kDa,浓度为0.58mg/ml。
3.2 dsDNA在SA光纤探针表面固定的最适浓度
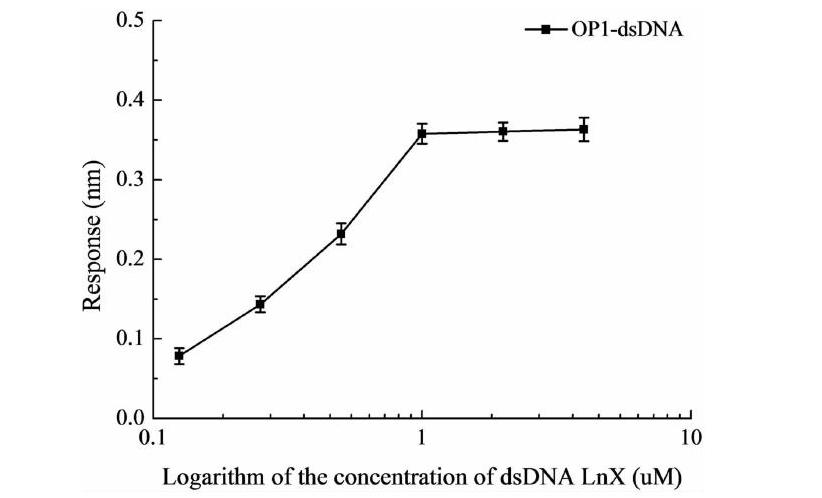
dsDNA OP1在0.125~4μM倍比稀释浓度范围内,分别固定于SA光纤探针表面,达到平衡后的光谱响应信号值如图2所示,最适浓度为1μM时,光纤探针表面dsDNA自组装达到饱和状态,光谱响应信号不再变化。
3.3 dsDNA与RepA相互作用动力学参数测定
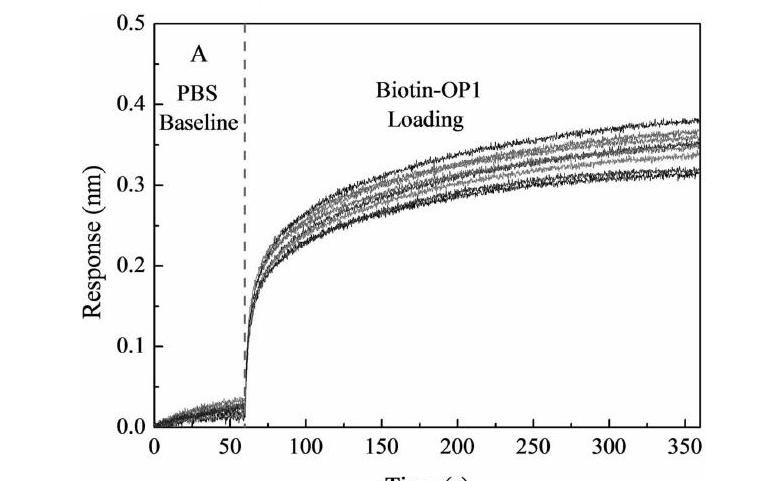
分别采用8只SA光纤探针固定Biotin-dsDNA OP1,如图3所示,最大响应信号的相对标准偏差RSD分别为5.76%,说明光纤探针一致性较好。
采用固定有dsDNA OP1 SA光纤探针,检测dsDNA OP1与RepA的亲和性。对每个浓度结合曲线做y=y0+a1-e-kaC+kdt非线性拟合,对解离曲线做y=ae-kd(t-t0)非线性拟合,获得动力学参数结果如表1所示,结合速率常数ka=1.196×1041/Ms、解离速率常数kd=1.179×10-41/s、亲和常数KD=9.865×10-9M。亲和常数越小,亲和性越高,说明RepA与dsDNA OP1亲和性高;RepA与阴性对照dsDNA CO无交叉反应,说明RepA与dsDNA OP1相互作用具有特异性。
3.4 甾体类激素定量检测新方法
将不同浓度睾丸酮标准品与RepA提前孵育,封闭RepA激素结合位点,改变RepA蛋白构象,从而无法与dsDNA OP1发生特异性结合反应。抑制法检测甾体类激素反应过程曲线如图4所示,最大信号响应值与睾丸酮浓度呈负相关。
a:预混溶液中不含睾丸酮的空白对照曲线;b-k:预混溶液中含有终浓度为0.534~546.500ng/ml范围内倍比稀释的睾丸酮标准品反应曲线;m:预混溶液中含有终浓度为1093ng/ml的睾丸酮标准品反应曲线。
每浓度重复测定3次,定量检测标准曲线如图5所示,检测时间为24min,睾丸酮标准品在0.534~546.500ng/ml浓度范围内,标准曲线方程符合Logistic四参数非线性拟合,R2=0.988。空白对照为100μl RepA与100μl PBS-T预混匀孵育,最低检测限(LOD)为空白对照响应值3SD对应的睾丸酮浓度,经实验为0450ng/ml,定量限(LOQ)为空白对照响应值10SD对应的睾丸酮浓度,经实验为2.351ng/ml。
3.5 检测甾体类激素的方法学对比
通过三种方法对水样甾体类激素的检测结果与加标回收实验结果对比,说明光干涉抑制法在总量检测方面优于HPLC方法,在检测方法精密度与准确度方面优于非细胞体系生物化学发光传感器检测方法。
4 讨论
采用光干涉生物亲和性传感检测系统及SA光纤探针,检测睾丸酮丛毛单胞菌(C.testosteroni,C.T.)ATCC 11996中dsDNA OP1与RepA的相互作用动力学参数,其中亲和常数KD分别为9.865×10-9M,亲和常数越小,亲和性越高。利用本文建立的方法与HPLC方法及非细胞体系高效生物化学发光传感器检测方法进行对比,結果表明,本文建立的光干涉生物亲和性传感检测抑制方法在甾体类激素总量的检测中优于HPLC方法的单一物质检测;检测方法加标回收率为9440%~110.14%,相对标准偏差RSD为5.60%~12.65%,说明检测方法精密度与准确度好;样品前处理简单,能够应用于环境中甾体类激素总量的快速检测。
参考文献:
[1]Stevens J F,Maier C S.Acrolein:Sources,metabolism,and biomolecular interactions relevant to human health and disease[J].Molecular Nutrition & Food Research,2008,52(1):7-25.
[2]Linenberger K J,Stacey L B.Biochemistry students' ideas about shape and charge in enzyme substrate interactions[J].Biochemistry & Molecular Biology Education,2014,42(3):203-212.
[3]Kienberger F,Kada G,Mueller H,et al.Single molecule studies of antibody-antigen interaction strength versus intramolecular antigen stability[J].Journal of Molecular Biology,2005,347(347):597-606.
[4]J.Sambrook,D.W.Russel.Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,New York,2001.
[5]Hotchkiss A,Rider C C,Wilson V,et al.Fifteen years after "Wingspread"-environmental endocrine disrupters and human and wildlife health:where we are today and where we need to go[J].Toxicological Sciences,2010,105(2):235-259.
[6]Tsutsui T,Barrett J C.Neoplastic Transformation of Cultured Mammalian Cells by Estrogens and Estrogenlike Chemicals[J].Environmental Health Perspectives,1997,105(3):619-624.
[7]Farre M,Kuster M,Brix R,et al.Comparative study of an estradiol enzyme-linked immunosorbent assay kit,liquid chromatography-tandem mass spectrometry,and ultra performance liquid chromatography-quadrupole time of flight mass spectrometry for part-per-trillion analysis of estrogens in[J].Journal of Chromatography A,2007,1160(1-2):166-175.
[8]Sara R M,Alda M J L D,Damia B.Picogram per liter level determination of estrogens in natural waters and waterworks by a fully automated on-line solid-phase extraction-liquid chromatography-electrospray tandem mass spectrometry method[J].Analytical Chemistry,2004,76(76):6998-7006.
[9]Slabas A R,Chase D,Nishida I,et al.Molecular cloning of higher-plant 3-oxoacyl-(acyl carrier protein)reductase.Sequence identities with the nodG-gene product of the nitrogen-fixing soil bacterium Rhizobium meliloti[J].Biochemical Journal,1992,283(2):321-326.
[10]Mbus E,Jahn M,Schmid R,et al.Testosterone-regulated expression of enzymes involved in steroid and aromatic hydrocarbon catabolism in Comamonas testosteroni[J].Journal of Bacteriology,1997,179(18):5951-5955.
[11]Mbus E,Maser E.Molecular cloning,overexpression,and characterization ofsteroid-inducible 3α-hydroxysteroid dehydrogenase/carbonyl reductase from Comamonas testosteroni.A novel member of the short-chain dehydroge-nase/reductase superfamily[J].J Biol Chem,1998,273(47):30888-30896.
[12]Mbus E,Jahn M,Maser E,et al.Testosterone-regulated expressionof enzymes involved in steroid and aromatic hydrocarbon catabolism in Comamonas testosteroni[J].J Bacteriol,1997,179(18):5951-5955.
[13]Xiong G,Markowetz S,Maser E.Regulation of 3alpha-hydroxysteroid dehydrogenase/carbonyl reductase in Comamonas testosteroni:function and relationship of two operators[J].Chemico-biological interactions,2003,144(2):411-423.
[14]Xiong G,Martin H J,Blum A,et al.A model on the regulation of 3α-hydroxysteroid dehydrogenase/carbonyl reductase expression in Comamonas testosteroni[J].The Journal of biological chemistry,2001,130-132:723-736.
[15]Masahiro K,Rei K,Kazuo N,et al.Study of neonatal exposure to androgenic endocrine disruptors,testosterone and dihydrotestosterone by normal-phase HPLC[J].Biomedical Chromatography,2006,20(11):1237-1241.
[16]于源華,张昊,于化东,等.一种检测甾体类激素及多环芳烃的高效生物化学发光传感器,CN 102135497 A[P].2012.
基金项目:家庭助孕用多激素指标定量检测系统的研制(项目编号:Z171100000417014)