陇南核桃腐烂病一株伴生细菌的分离与鉴定
2020-11-30卓平清王让军王明霞
王 瀚,卓平清,王让军,王明霞
(1.陇南师范高等专科学校农林技术学院/陇南特色农业生物资源研究开发中心,甘肃陇南 742500;2.成县核桃科技服务中心, 甘肃陇南 742500)
0 引言
甘肃陇南成县气候温润,林果独特,是甘肃省乃至我国西部重要的核桃产区之一,被命名为“中国核桃之乡”.核桃已成为当地的重要经济林果产业.截止2016年,该县栽培面积达34.0×103hm2、1 120万株,坚果产量达21.44×103t[1].核桃产业的快速发展离不开核桃品种的推广和繁育,但随着不同地区间不同品种核桃接穗的广泛交流,病害的传播速度也随之加快,病害发生率逐年提升.核桃腐烂病是一种严重的危害核桃树势的真菌病害,研究表明,该病是一种由壳蕉孢属(Cytospora)真菌引起的病害,主要靠分生孢子的快速扩散感染树体,发病范围较广,危害极其严重[2-3].
诸多研究发现,核桃病害是一类复合型病害.其病原菌除了主要的致病菌之外,尚存在大量其他种类伴生病原菌,它们与主要病原菌一起共同侵染寄主植物.为准确认识并分析核桃腐烂病的传播途径及复合侵染模式,控制其蔓延态势,本研究对其伴生病原菌进行了分离鉴定,以期为核桃腐烂病的综合防治提供理论参考.
1 材料与方法
1.1 材料
1.1.1 菌株来源 甘肃成县索池大草湾村(海拔1 433 m,地理坐标33°29’45”N,105°57’30”E)核桃基地核桃腐烂病病斑部位分离得到.
1.1.2 供试培养基及试剂 LB培养基:蛋白胨10.0 g,NaCl10.0 g,酵母提取物5.0 g,蒸馏水1000 mL,pH为7.0~7.5[4].革兰氏染色试剂盒购自碧云天试剂公司;Ezup柱式细菌基因组DNA抽提试剂盒(SK8255/8256),所需其他分子生物学试剂均购自上海生工有限公司.
1.2方法
1.2.1 病原菌的分离和培养 野外考察期间,挖开核桃腐烂病表层,以无菌手术刀挖取核心部位,样本采回后取核心区部分黑色组织,置于无菌水中浸泡10 min后,以接种环蘸取无菌水液后以常规划线法在LB平板上划线,划线后平板倒置培养24 h后,再挑取单菌落分别以划线法继续纯化,培养后得一白色菌落,具木腐味,命名为HBG.将其涂布于试管斜面上放37 ℃培养条件下培养后,置于4 ℃冰箱保存备用.
1.2.2 病原菌的形态特征研究 取保存好的病原菌后,于30 ℃条件下活化24 h后观察菌落形态,后以接种环刮取少量菌膜,按常规方法涂片、干燥和固定.先滴加草酸铵结晶紫染液覆盖涂菌部位,染色1~2 min后倾去染液,水洗至流水无色,之后以卢戈氏碘液冲去残留水迹,再用碘液覆盖1 min,倾去碘液,水洗至流出水无色,最后以95%酒精脱色,之后复染,镜检观察[5].
1.2.3 病原菌生理生化特征测定 不同的细菌具有不同的酶系和不同的生理特性,这些特性可以作为细菌鉴定和分类的重要方法.为准确、快速及微量化鉴定该菌株.菌株HGB的生理生化性质的测定参照文献[5]的方法进行.
1.2.4 病原菌生长特性测定 不同的环境因素对微生物的增殖具有一定的影响.为进一步研究该病原菌在不同温度下的生长特性,取配制好的LB液体培养基,以5 mL离心管分装,接种活化菌液后按照4、10、15、20、25、30、35、40℃设置处理温度,每个温度设置3个平行,培养24 h后分别吸取少量菌液测定OD600;为进一步研究pH值对该菌株增殖的影响.取配制好的LB液体培养基,分别调节pH值为4.0、5.0、6.0、7.0、8.0、9.0、10.0,接种活化菌液后培养24 h测定菌液的OD600;为进一步研究该病原菌的增殖规律,将活化菌液分别接种于LB液体培养基中于25℃恒温条件下培养48 h,其中每隔2 h测定OD600,并以此值绘制生长曲线.
1.2.5 病原菌16S rDNA基因序列分析 分离到的菌株经纯培养后,采用Ezup柱式细菌基因组DNA抽提试剂盒(SK8255/8256)提取细菌基因组DNA,采用细菌16S rDNA通用引物27F:AGA GTT TGA TCC TGG CTC AG和1492R:TAC GGC TAC CTT GTT ACG ACT T扩增细菌的16S rDNA,将PCR扩增产物回收后送上海生工有限公司测序.测序结果在GenBank数据库中进行BLAST比对分析.
2 结果与分析
2.1 病原菌HBG菌落形态
该细菌为短杆状,菌落较小,白色,边缘整齐,菌落周围分泌出粘性物质(见图1).经革兰氏染色鉴定为革兰氏阴性菌(G-).随着培养时间的延长,可闻见木腐味.
2.2 病原菌HBG的生长特性
温度是生命体存活的最基本环境因素之一.对于细菌而言,其生长温度范围有些较宽、有些较窄.但是对于植物病原菌而言,其增殖的温度范围一般与其宿主正常生长的温度范围保持一致.通过测定温度对该菌株HBG的影响,发现其最适温度为25~30 ℃(图2).pH值决定生物大分子表面的电荷变化,进而影响其活性的变化.对该病原菌而言,其最佳pH值范围为6.0~8.0,最适值pH值为7.0左右(图3).生长曲线表明,该病原菌培养12 h后,细菌开始从对数生长期缓慢增至平台期,36 h后逐渐进入衰退期(图4).


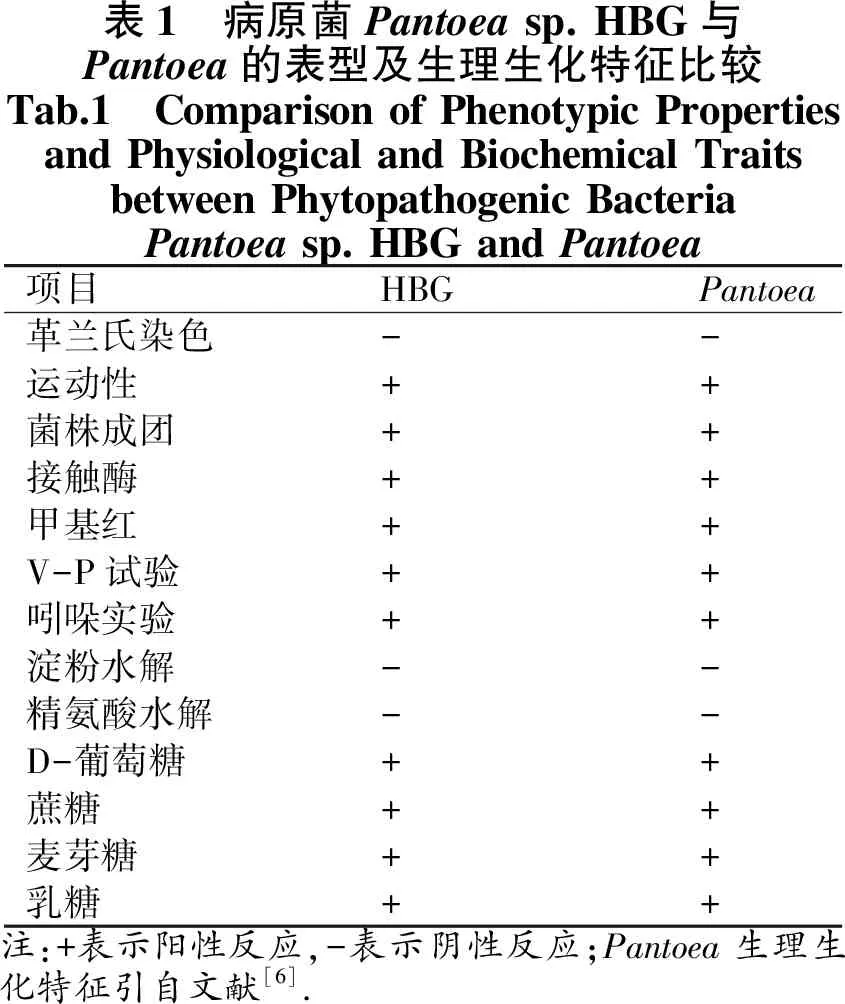
2.3 病原菌HBG生理生化特征
病原菌Pantoeasp. HBG生理生化结果见表1.该菌株具有运动性、菌株成团、其接触酶、甲基红、V-P试验及吲哚实验均为阳性.其淀粉及精氨酸分解能力为阴性.经葡萄糖、乳糖、麦芽糖及蔗糖发酵试验,均呈阳性.这些特征均与Pantoeasp.非常相似[6].
2.4 病原菌HBG的16S rDNA序列分析
以该菌株DNA为模板,利用细菌16S rDNA通用引物进行PCR扩增,得到长度为1 375 bp的扩增产物(图5),将测序结果通过 BLAST (https://blast.ncbi.nlm. nih.gov/) 进行分析,挑取BLAST 结果中相似菌株,用 Mega 7 软件进行系统发育树构建(图6).发现该菌株与Pantoeasp. NIIST-167(FJ445)聚为一枝,结合形态特征及生理生化特征,确定该菌株属于Pantoea,命名为Pantoeasp. HBG.

注:M 为 Marker.图5 病原菌Pantoea sp. HBG 电泳图Fig.5 Electrophoresis of Phytopathogenic bBacteria Pantoea sp. HBG图6 病原菌Pantoea sp. HBG的系统发育树Fig.6 Phylogenetic Tree of Phytopathogenic Bacteria Pantoea sp. HBG
3 讨论
核桃腐烂病是影响核桃产业发展的一种重要的真菌病害,目前认为其发病的主要机理在于影响核桃树皮层下韧皮部,进而影响到植物根对营养物质的吸收.另外由于腐烂病的发生影响到了核桃树体对于矿质元素的吸收.研究表明,气温及其他病害发生也常常造成核桃腐烂病的发生[7].
对植物病害研究而言,病原的分离及鉴定是至关重要的.但是,由于植物受病害影响的程度不同、病原物分离方法的差异及其鉴定方法的不同,最终导致该病的病原菌的种类存在差异.目前诸多研究表明其病原菌为壳蕉孢属(Cytospora),但种类不尽一致.如国内最早的文献报道病原为CytcosporajuglandicolaEll et Barth,属于半知菌亚门[8];黄治民等研究报道为Cytosporajuglandis(DC.) Sacc.[9-10];马荣等报道为Cytosporachrysosperma[11];岳朝阳等人报道为Cytosporasp[2,12-16],均属于壳蕉孢属(Cytospora).张海军等[17]分离出的菌株鉴定为Phomasp.为茎点霉属;郭开发等[18]分离鉴定出新疆核桃腐烂病病原为Chrysosperma.
病原微生物侵染植物体通常是复合侵染,其病原存在多样性.不同的病原菌在侵染过程中扮演的角色是不同的,它们之间存在拮抗作用或协同作用.对于真菌引发的病害,其病原同样存在多样性,通常是真菌、细菌甚至植物病毒侵染植物体.这在经济作物病害研究方面已有相关报道.如张智慧等[19]报道,三七根腐病病原菌除了腐皮镰孢菌Fusariumsolani、细链格孢菌Alternariatenuis、坏损柱孢菌Cylindrocarpondestructans和黄腐病菌Cylindrocarpondidynum等真菌外,也存在一些其他伴生细菌,共同引发三七的根腐病.泛菌属细菌是一类重要的土壤腐生细菌,三七根腐病中泛菌属的细菌,占39.33%.经分离鉴定为成团泛菌Pantoeaagglomerans.对核桃而言,成团泛菌的危害程度更甚于黑斑病的病原菌[20].
在本研究中,在核桃腐烂病的病斑部位分离到泛菌属的细菌(Pantoeasp.).经培养后发现,该菌菌落为白色,呈粘稠状,具木腐味.该菌在和其他真菌病原侵染核桃茎干时形成粘稠状、湿润的液体环境,一方面保证了这种腐生型细菌的快速增殖,另一方面这种腐生环境也给核桃腐烂病的其他病原菌提供了较好的微环境,在核桃腐烂病的发生及蔓延过程中扮演着重要作用.但其具体感染途径及其扮演的角色尚需进一步研究证实.
