MicroRNA-93及Tspan1在结肠癌中的表达及其临床病理意义*
2020-11-28高小卓张辉乔鋆王楠杨世华张继福马诗扬李记彬石刚张睿
高小卓,张辉,乔鋆,王楠,杨世华,张继福,马诗扬,李记彬,石刚,张睿
[1.中国医科大学肿瘤医院(辽宁省肿瘤医院) 病理科,辽宁 沈阳 110044;2.丹东市人民医院 呼吸肿瘤科,辽宁 丹东 118000;3.中国医科大学肿瘤医院(辽宁省肿瘤医院) 结直肠外科,辽宁 沈阳 110044]
结直肠癌在全球发病率呈上升趋势,随着化疗及靶向治疗药物的发展,整体生存率较10 余年前有明显升高[1]。对结直肠癌早期诊断的分子生物学标志物的探索,以及对靶向治疗靶点的研究可能是进一步提高晚期结直肠癌患者生存率的主要方向[2]。MicroRNA 可以对靶mRNA 3'-UTR 端进行特异性识别,其组成为单链非编码RNA 长度为18 ~22 个核苷酸,对下游靶mRNA 降解进行调控或接受上游基因的调控,阻断翻译过程,对恶性肿瘤的行为有重要的调控作用[3]。有研究显示,microRNA-93(miR-93)能够抑制结肠癌细胞的增殖,与结肠癌发生、发展有重要联系[4]。四跨膜蛋白超家族成员Tspan1 是细胞膜内外信号传导的重要通路,对细胞迁移、侵袭等行为具有调控作用,有研究显示Tspan1 在胰腺癌中表达升高,并与侵袭、转移具有相关性[5-6]。本研究对组织及细胞中miR-93 及Tspan1 表达进行检测,并分析其与临床病理特征的关系及两者的相关性,为进一步研究miR-93 与Tspan1 的靶向调控关系提供前期实验基础。
1 材料与方法
1.1 材料
选取2016年5月—2018年4月于中国医科大学肿瘤医院结直肠外科行结肠癌根治术的患者74 例,取其手术标本,包括结肠癌组织及对应的距肿瘤边缘>5 cm 的癌旁组织。人结肠癌细胞株(SW480、SW620、HCT116、CaCo-2、LoVo、HT29)购 自 中 国科学院上海生命科学研究院细胞资源中心,正常人结肠上皮细胞株(FHC)购自美国ATCC 公司,于中国医科大学肿瘤医院中心实验室培养传代扩增。Tspan1 多克隆抗体购自美国Sigma 公司,BCA 蛋白定量分析试剂盒购自北京博凌科为公司,逆转录试剂盒购自立陶宛Fermentas 公司,microRNA 提取分离试剂盒购自美国Abcom 公司,All-in-One qPCR Mix 试剂盒及MTT 试剂盒购自大连宝生生物技术有限公司,引物由大连宝生生物技术有限公司设计并合成。本研究经中国医科大学肿瘤医院伦理委员会审核(No:20180336)。
1.2 方法
1.2.1 Western blotting取组织或细胞株,将组织或细胞进行预处理后做蛋白浓度定量。使用裂解液对蛋白进行裂解、震荡、充分摇匀,完成总蛋白的提取,然后提取上清液,应用BCA 蛋白定量分析试剂盒进行蛋白浓度定量。使用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将蛋白分离,转至PVDF 膜。5%的脱脂奶粉在室温下封闭90 min,加一抗,孵育过夜,TBST洗涤加二抗,再次孵育,再用TBST 洗涤,化学发光法显色,以β-actin 为内参照。以Quantity One 监测灰度值,蛋白相对表达量=目标蛋白灰度值/内参照蛋白灰度值。
1.2.2 qRT-PCR取组织或细胞标本,使用Trizol试剂盒进行总RNA 提取及纯化,严格按照试剂盒使用说明书进行相关操作,使用DNasel 去除污染的DNA,分光光度计检查OD 260/280=1.8 ~2.0,无蛋白和苯酚污染,甲醛变性琼脂糖电泳法检测RNA 完整性,后立即逆转录为cDNA,获得样本cDNA 产物,灭活逆转录酶,进行PCR 反应。按照All-in-One qPCR Mix 试剂盒使用说明书进行实时监测和定量扩增产物。采用2-ΔΔCt法分析熔解曲线。
1.3 统计学方法
数据分析采用SPSS 21.0 统计软件,生物信息学预测软件为TargetScan 及GeneCard。计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较用单因素方差分析,采用Pearson 法进行相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 miR-93、Tspan1 mRNA 及蛋白在结肠癌、癌旁组织中的表达
miR-93 在结肠癌组织与癌旁组织中的表达差异有统计学意义(t=12.33,P=0.000),miR-93 在结肠癌组织中表达较低。Tspan1 mRNA 在结肠癌组织与癌旁组织中的表达差异有统计学意义(t=4.312,P=0.000),Tspan1 mRNA 在结肠癌组织中表达较高。Tspan1 蛋白相对表达量在结肠癌组织与癌旁组织中的表达差异有统计学意义(t=10.980,P=0.000),Tspan1 蛋白在结肠癌组织中表达较高。见图1。
2.2 miR-93、Tspan1 mRNA 及蛋白在人结肠癌细胞株、正常人结肠上皮细胞中的表达
miR-93、Tspan1 mRNA 及蛋白在人结肠癌细胞株(SW480,SW620,HCT116,CaCo-2,LoVo,HT-29)及正常人结肠上皮细胞株(FHC)中的表达差异有统计学意义(F=9.098、4.576 和5.516,均P=0.000)。与正常人结肠上皮细胞株比较,miR-93 在人结肠癌细胞株中表达较低(P<0.05);Tspan1 mRNA 在人结肠癌细胞株中表达较高(P<0.05);Tspan1 蛋白在人结肠癌细胞株中表达较高(P<0.05)。见表1。
2.3 miR-93 及Tspan1 mRNA 表达与临床病理特征的关系
结肠癌组织中miR-93 及Tspan1 mRNA 在患者不同年龄、性别、肿瘤位置、肿瘤直径、肿瘤浸润深度、病理分型、肿瘤分化程度患者中的表达无差异(P>0.05),miR-93 在远处转移(M1)、淋巴结转移阳性、血管浸润阳性及高TNM 分期患者中的表达低(P<0.05),Tspan1 mRNA 在远处转移(M1)、淋巴结转移阳性、血管浸润阳性及高TNM 分期患者中的表达高(P<0.05)。miR-93 及Tspan1 mRNA 在结肠癌是否具有血行及淋巴转移的临床病理特征表达差异有统计学意义(P<0.05)。见表2。
2.4 miR-93 与Tspan1 mRNA 相关性分析及生物信息学预测
采用Pearson 法对miR-93 与Tspan1 mRNA 进行相关性分析,结果显示,在结直肠癌组织中,miR-93 与Tspan mRNA 表达呈负相关[r=-0.735(95% CI:-0.855,-0.535),P=0.000]。经生物信息学预测,miR-93 及Tspan1 在3'-UTR 区可能具有靶向调控关系。见图2。

图1 miR-93、Tspan1 mRNA 及蛋白在结肠癌组织及癌旁组织中的表达
表1 miR-93、Tspan1 mRNA 及蛋白在人结肠癌细胞株及正常人结肠上皮细胞株中的表达 (±s)
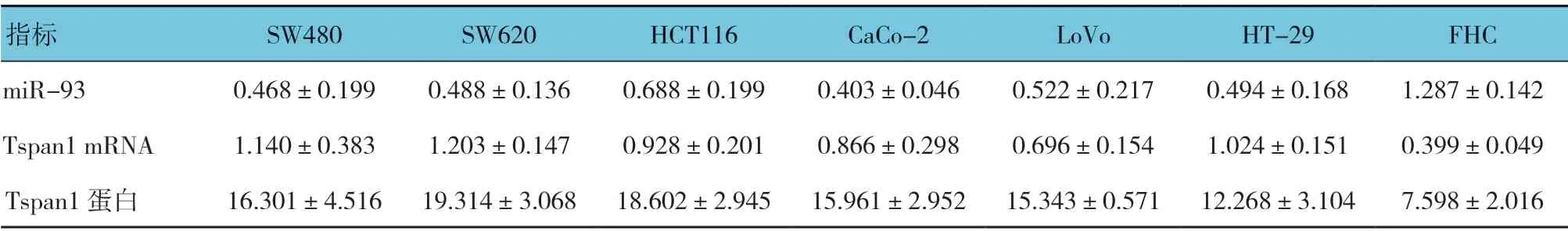
表1 miR-93、Tspan1 mRNA 及蛋白在人结肠癌细胞株及正常人结肠上皮细胞株中的表达 (±s)
指标 SW480 SW620 HCT116 CaCo-2 LoVo HT-29 FHC miR-93 0.468±0.199 0.488±0.136 0.688±0.199 0.403±0.046 0.522±0.217 0.494±0.168 1.287±0.142 Tspan1 mRNA 1.140±0.383 1.203±0.147 0.928±0.201 0.866±0.298 0.696±0.154 1.024±0.151 0.399±0.049 Tspan1 蛋白 16.301±4.516 19.314±3.068 18.602±2.945 15.961±2.952 15.343±0.571 12.268±3.104 7.598±2.016
表2 结肠癌患者临床病理特征与miR-93 及Tspan1 mRNA 表达的关系 (±s)
临床病理特征 n miR-93 t /F 值 P 值 Tspan1 mRNA t / F 值 P 值性别男40 0.314±0.208 1.732 0.088 0.576±0.290 1.531 0.130女34 0.242±0.137 0.671±0.233年龄≤60 岁 42 0.273±0.169 0.623±0.235 0.412 0.682 0.130 0.897>60 岁 32 0.291±0.199 0.615±0.310肿瘤位置左半结肠 42 0.272±0.206 0.640±0.297 0.474 0.637 0.725 0.471右半结肠 32 0.293±0.146 0.594±0.226肿瘤直径≤5 cm 48 0.276±0.172 0.623±0.254 0.330 0.743 0.128 0.899>5 cm 26 0.291±0.201 0.614±0.298浸润深度T1、T2 22 0.242±0.109 0.639±0.161 1.204 0.233 0.392 0.696 T3、T4 52 0.298±0.203 0.612±0.304淋巴结转移N0 42 0.340±0.179 0.534±0.240 3.022 0.003 3.375 0.001 N1、N3 32 0.212±0.163 0.733±0.265远处转移M0 58 0.317±0.180 0.561±0.248 3.525 0.001 3.937 0.000 M1 16 0.149±0.116 0.833±0.235血管浸润阴性 38 0.330±0.191 2.442 0.017 0.562±0.262 2.305 0.024阳性 36 0.230±0.157 0.700±0.251 TNM 分期Ⅰ、Ⅱ期 32 0.350±0.213 0.524±0.290 2.995 0.004 3.165 0.002Ⅲ、Ⅳ期 42 0.229±0.133 0.709±0.212大体形态分类肿块型 36 0.342±0.182 0.594±0.243溃疡型 20 0.199±0.156 0.987 0.330 0.792±0.234 1.322 0.190浸润型 18 0.251±0.171 0.505±0.276分化程度高、中 40 0.288±0.197 0.352 0.726 0.625±0.280 0.149 0.882低34 0.273±0.164 0.634±0.247
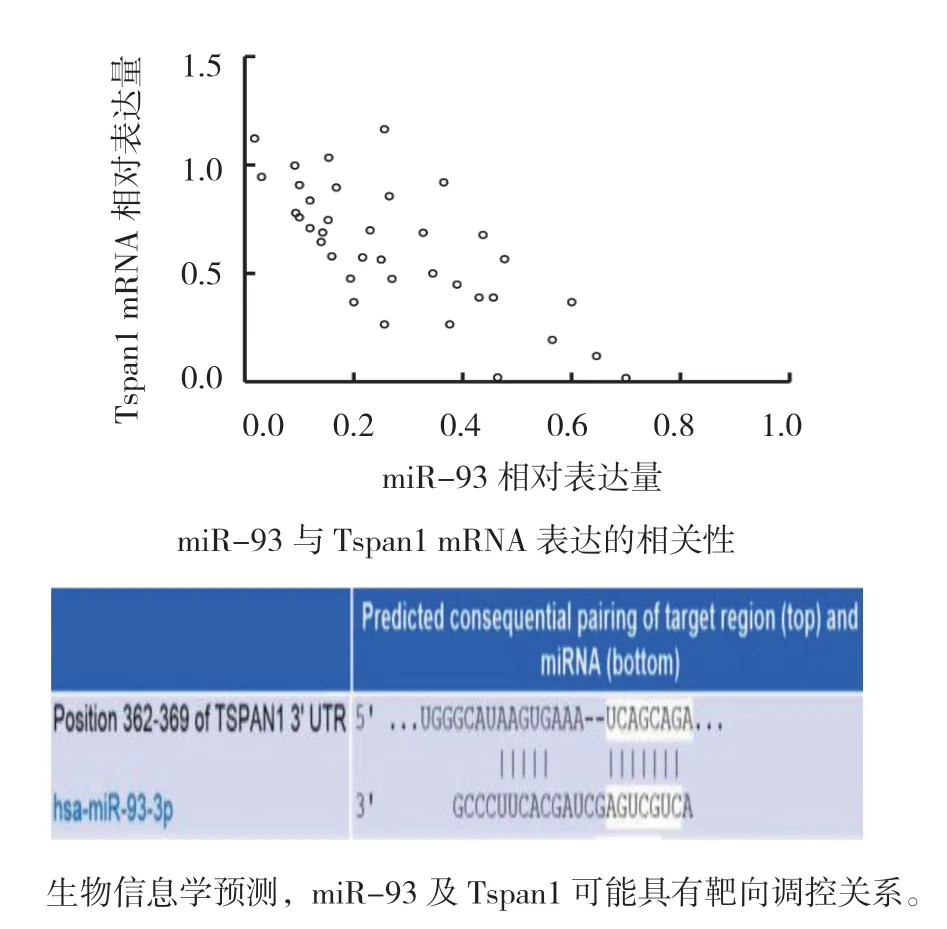
图2 miR-93 与Tspan1 mRNA 相关性分析及生物信息学预测
3 讨论
结直肠癌目前是消化系统最常见的恶性肿瘤之一,化疗药物及靶向药物的发展是晚期结直肠癌患者生存期延长的最主要原因[7-9]。miRNA 具有表达稳定的特征,对肿瘤发生及发展具有重要调控作用,并参与恶性肿瘤相关的信号通路调控[10-11]。miRNA 在恶性肿瘤的诊断、预后评价及靶向治疗中具有重要的应用价值[12-13]。XIANG 等[14]研究结果显示,miR-93会抑制SW1116 干细胞增殖及克隆形成,是抑癌基因。以往研究报道[15]Tspan1 在胰腺癌中与临床分期呈正相关,与癌症患者的生存率呈负相关,对胰腺癌细胞的侵袭转移具有促进作用,这种促进作用是通过调控MMP2 表达及PLCγ 磷酸化实现,Tspan1是一种促癌基因。另有研究显示[16],miR-200a 可以通过调控Tspan1 表达诱导非小细胞肺癌细胞的迁移,表明Tspan1 对恶性肿瘤细胞增殖、侵袭、凋亡的调控可以受到上游miRNA 的调控。通过生物信息学分析预测miR-93 及Tspan1 在3'-UTR 区可能具有靶向调控关系,本研究分析了结肠癌患者临床病理特征与miR-93及Tspan1 mRNA 表达的关系,把两者在信号通路方面的靶向调控关系作为前期实验研究基础。
本研究显示,与癌旁组织比较,miR-93 在结肠癌组织中低表达,Tspan1 mRNA 及蛋白在结肠癌组织中高表达,与正常人结肠上皮细胞比较,miR-93 在人结肠癌细胞株中低表达,Tspan1 mRNA 及蛋白在人结肠癌细胞株中高表达。miR-93 在远处转移(M1)、淋巴结转移阳性、血管浸润阳性及高TNM 分期患者中表达低,Tspan1 mRNA 在远处转移、淋巴结转移阳性、血管浸润阳性及高TNM 分期患者中表达高。这部分研究表明,miR-93 可能与结直肠癌转移的恶性行为有关,可能作为抑癌基因发挥作用,而Tspan1 可能作为促癌基因发挥作用。YANG 等[17]研究显示,在前列腺癌中,miR-93 是重要的预测因子及预后因子,在前列腺癌中低表达,miR-93 对KEGG 通路的靶向调控作用可能是前列腺癌靶向治疗的候选基因。CHEN 等[18]在胃癌的研究中显示,Tspan1 高表达的患者中位生存期短,TNM分期更差。CHEN等[19]在肝癌的研究中也显示,Tspan1 高表达的肝癌患者生存期短。SCHOLZ 等[20]在卵巢癌的研究中显示,Tspan1 是转移性卵巢癌不良预后的标志物,可能作为未来的治疗靶点。本研究显示,miR-93 与Tspan mRNA 表达呈负相关,经过生物信息学预测,miR-93 及Tspan1 在3'-UTR 区可能具有靶向调控关系。在进化上miRNA 是高度保守的内源性非编码单链RNA,对基因的调控是在转录后水平。在基因组中,miRNA 具有不同编码,编码miRNA 前体(premiRNA)。pre-miRNA 是发夹结构,而且是单一的,5'-端具备磷酸基团,3'-具备突出碱基2个及3'-羟基1个,miRNA 可以抑制mRNA 的蛋白传递,这是通过与靶mRNA3'-UTRs 互补结合实现的,从而调控下游基因的表达,从而抑制或破坏mRNA 蛋白传递,对基因表达产生负调控作用[21-22]。miRNA 表达失调与多种恶性肿瘤发生及发展具有相关性。有研究显示,在乳腺癌中,miR-93 通过抑制MKL-1 及STAT3 表达介导细胞表皮间质化形成,从而调控乳腺癌细胞转移,与化疗耐药也具有相关性[14]。本研究通过生物信息学预测miR-93与Tspan1 可能存在调控关系,在组织水平观察两者在结直肠癌组织中的表达,并分析两者与临床病理特征的关系,从统计学方面论证两者的相关性,为结直肠癌的诊断及预后预测靶基因的发现,为治疗靶向候选基因的探索,提供临床实验依据,为进一步的在体实验打下基础。
综上所述,miR-93 在结肠癌中表达下调,Tspan1在结肠癌中表达上调,miR-93 可能与Tspan1 mRNA具有靶向调控关系,两者可能成为结肠癌的肿瘤标志物或预测因子,可以通过进一步实验证明其是否可以成为靶向治疗的靶点。
