Nogo-A启动子的地塞米松结合区域以及相关转录因子的研究
2020-11-25吴双士李洪达赵季伟王永祥
吴双士, 李洪达, 赵季伟, 孙 浩, 胡 乐, 王永祥
(扬州大学临床医学院 骨科, 江苏 扬州, 225000)
脊髓损伤(SCI)是严重的中枢神经系统损伤, 具有高发病率、高致残率、高医疗费等特点,可导致肢体不可逆的感觉及运动功能丧失[1-2]。目前, SCI的病理机制尚不清楚,临床上多采用外科手术、药物治疗及康复治疗等手段,但疗效均欠佳[3]。糖皮质激素能与大多数动物细胞膜上的受体结合,在免疫和代谢调节中发挥重要作用[4]。地塞米松是治疗SCI的常用皮质类固醇药物,研究[5]表明,地塞米松对神经保护和神经再生的关键因子Nogo-A(又称RTN4)具有抑制作用。本研究探明了Nogo-A启动子的糖皮质激素结合区域,并利用生物信息学方法对该区域进行CpG岛预测,并对可能的转录因子结合位点进行分析,现将结果报告如下。
1 资料与方法
1.1 细胞培养与基因组提取
采用含10%胎牛血清的高糖DMEM培养胃癌细胞株SGC-7901。细胞保存于37 ℃饱和湿度和5%二氧化碳培养箱中,每2~3 d传代1次。所有实验均采用对数期细胞。采用天安普基因组DNA试剂盒(DP304)提取SGC-7901细胞基因组DNA, 所有步骤均参照说明书进行。
1.2 人Nogo-A基因启动子的扩增及其产物的纯化
针对Nogo-A不同长度截短启动子设计的引物见表1。以SGC-7901细胞基因组DNA为模板,采用聚合酶链式反应(PCR)扩增Nogo-A启动子片段。扩增条件为95 ℃预变性5 min, 95 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 共35个周期,然后在72 ℃下延伸10 min。将5 μL产品加入1.5%琼脂糖凝胶中电泳,随后采用凝胶提取试剂盒对PCR产物进行纯化。

表1 Nogo-A不同长度截短启动子的引物
1.3 纯化目的片段与克隆载体的连接与鉴定
收集PCR产物,经脂质体转染后将其转化并扩增得到质粒,随后采用限制性酶XhoⅠ和HindⅢ进行双酶切,并检测序列。
1.4 重组表达载体的建立与鉴定
将pGL3碱性质粒经XhoⅠ和HindⅢ双酶消化,加入凝胶提取试剂盒收集目的片段,用T4 DNA连接酶转化、扩增、提取质粒。产物经双酶消化和序列检测,命名为pGL3-Nogo-A启动子。
1.5 重组细胞转染及表达活性检测
转染前4 h将SGC-7901细胞接种于24孔板中,每孔加入0.5 mL全培养基和0.5×105细胞,当细胞融合率达到70%~80%时进行转染。转染48 h后,采用Promega公司的双荧光素酶报告试剂盒检测转染质粒的活性,每组有3个重复孔,实验重复3次。稳定转染,采用10-9、10-8、10-7mol/L的地塞米松处理48 h。
1.6 荧光检测与转录因子分析
细胞溶解后,按照指示进行荧光检测。采用酶联免疫测定仪读取数据。对照组数据设为1, 其余数据分别与对照组比较并计算,实验重复3次。Nogo-A基因序列通过UCSC(http: //genome.ucsc.edu/index.html)数据库获取,在GeneSorter中检索“Nogo-A”, 截取转录起始点上游-1 218~-833碱基对(bp)的序列,使用TRANSFAC数据库和Patch 1.0软件分析Nogo-A启动子中可能的转录因子。
1.7 CpG岛预测
采用EMBOSS 6.6.0在线预测软件对启动子区序列进行预测,预测条件设定为观察值/预期值大于0.60, (G+C)%大于50.00%, 长度大于200 bp。(G+C)%表示C、G这2种碱基在序列中的占比。
1.8 统计学分析
采用SPSS 19.0 (Chicago, IL, USA)分析数据。数据以均数±标准差表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 启动子载体的构建
启动子区域设计在起始密码子“ATG”(atggact-tgagagga)的上游区域,分别为-1 218、-833、-428和-239 bp。经琼脂糖凝胶电泳(图1B)和碱基序列确认后,成功克隆了这些启动子,并将其插入到HindⅢ和XhoⅠ双酶切的pGL3载体中。见图1。
2.2 荧光检测
地塞米松处理后,除pGL3-833 bp、pGL3-428 bp和pGL3-239 bp组外, pGL3-1 218 bp组的荧光测量数据显著增加,并呈剂量依赖性(10-9、10-8、10-7mol/L地塞米松)。结果表明地塞米松靶区或靶向转录因子位于起始密码子上游-1 218~-833 bp区间。见图2。
2.3 转录因子分析
PROMO 3.0.2的预测结果共有88个,主要包含GATA-1、Ap-1、AR等,见表2-1、2-2。Patch 1.0预测Nogo-A基因共有116个转录因子结合位点,见表3。据此推测Nogo-A基因转录因子结合位点至少包含GATA-1、Ap-1和AR, 此为2个软件的共同预测结果,相对可靠。结合2个软件预测结果,经人工筛选去重后,最终确定了84个可能的转录因子,即AP-1、AR、C/EBPalpha、C/EBPbeta、CAC-bindingprotein、CACCC-bindingfactor、CAR、CCAAT-bindingfactor、c-Ets-1、c-Ets-2、c-Fos、c-Jun、c-Myb、COUP-TF1、CP1、CRE-BP1、deltafactor、EBP-80、Elk-1、ER-alpha、ER-beta1、FOXM1a、FOXM1b、FOXP3、FOXP3、GATA-1、GATA-2、GATA-3、GATA-4、GR-beta、HiNF-D、HiNF-M、HNF-1A、HiNF-P、HNF-3B、Hp55、Hp65、HrpF、IRF-1、IRF-2、ISGF-3、LBP-1、LF-A1、LXR-alpha、LXR-beta、MCBF、MyoD、NF-1(-likeproteins)、NF-AT1、NF-ATc、NF-ATx、NF-CLE0a、NF-CLE0b、NF-E3、NF-kappaB、NHP-1、NIP、p58、Pax-2、Pax-5、Pax-8、PEBP2alphaA1、PPAR-alpha、PR-alpha、PR-beta、RAR-alpha1、RAR-beta、RXR-alpha、RXR-beta、SF-1、SRF、STAT4、T3R-alpha1、T3R-beta1、T3R-beta2、TBP、TFIID、TFII-Ⅰ、TMF、TR2-11、VDR、XBP-1、XrpFI、YY1。

A: 启动子区设计在起始密码子“ATG”的上游区,分别为-1 218、-833、-428和-239 bp, 并与Hind Ⅲ和Xho Ⅰ双酶切的pGL3碱性载体连接; B: Nogo-A不同长度截断启动子的琼脂糖凝胶电泳。图1 启动子载体的构建

图2 不同剂量地塞米松处理后转染质粒活性的荧光测量值

表2-1 PROMO 3.0.2预测结果

表2-2 PROMO 3.0.2预测结果

表3 Patch 1.0的预测结果
2.4 CpG岛预测结果
预测条件设定为观察值/期望值大于0.60, (G+C)%大于50.00%, 长度大于200 bp。未发现Nogo-A启动子区域有CpG岛。见图3。
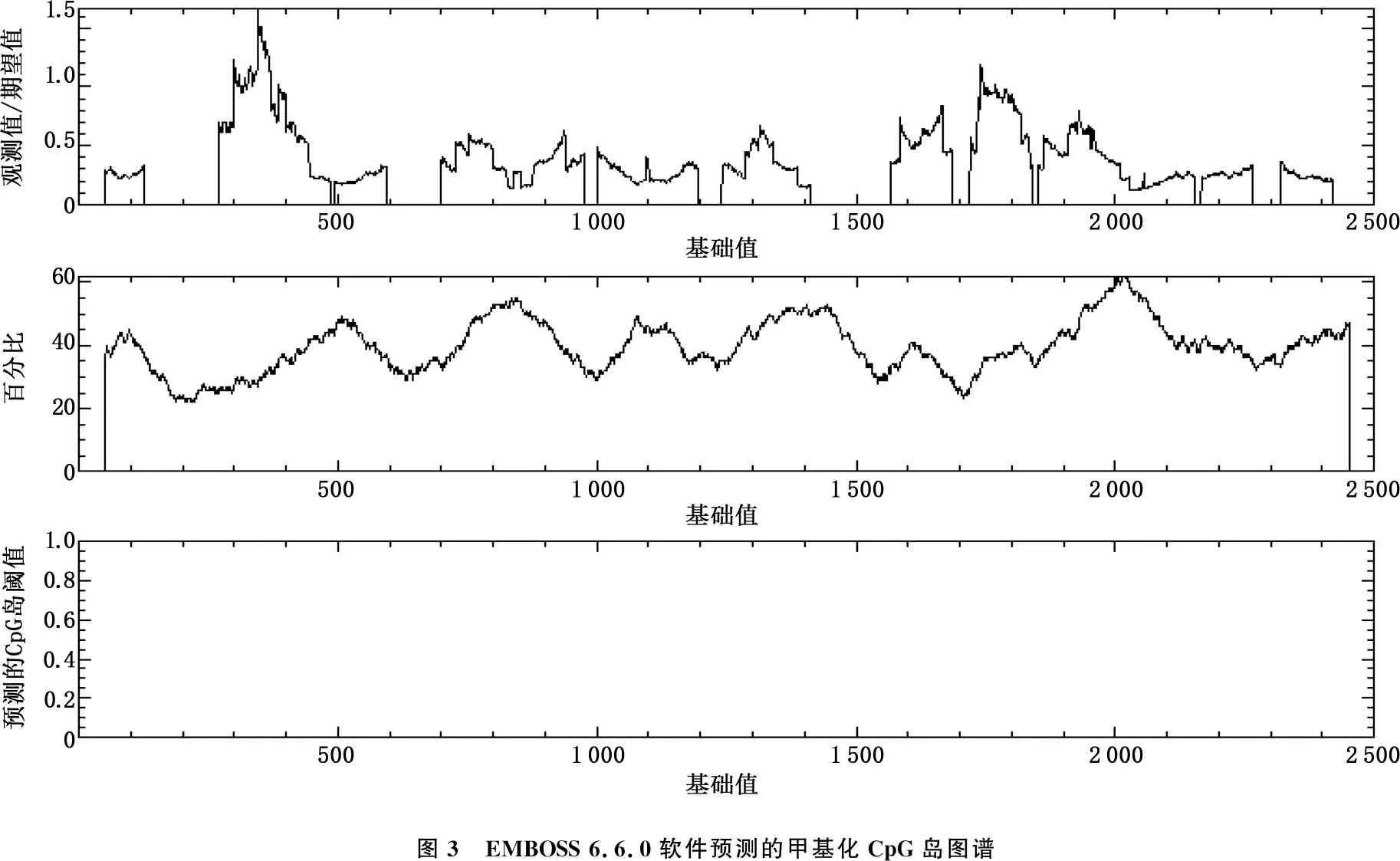
图3 EMBOSS 6.6.0软件预测的甲基化CpG岛图谱
3 讨 论
髓鞘衍生蛋白Nogo-A又称RTN4, 属于网状纤维蛋白家族,是中枢神经系统(CNS)特有的髓鞘相关神经突起生长抑制剂。CNS中的Nogo-A有助于形成一个非容许环境,在脑/脊髓损伤和神经再生中起着关键作用[6-8]。在成年人脊髓中,Nogo-A不仅在髓鞘形成的少突胶质细胞中表达,也在神经元中表达。Nogo-A能与其他因子共同抑制轴突的生长,如少突胶质细胞髓鞘糖蛋白(OMgp)、髓鞘相关糖蛋白(MAG)、肾上腺素和信号素[9-12]。抑制Nogo-A可能是促进脊髓损伤后神经再生、可塑性和功能恢复的重要策略。
糖皮质激素目前广泛用于脊髓损伤的治疗,其可以与受体结合减轻炎症,因此被用于脊髓损伤的初级治疗。地塞米松是常用的糖皮质激素之一,能促进脊髓损伤后的慢性恢复,抑制细胞凋亡[13]。启动子分析是基因调控研究中最常用的方法。基因启动子是指DNA序列上的一个特殊区域,主要启动基因转录。通常情况下,启动子的长度为100~1 000 bp。本研究首先克隆了Nogo-A转录起始位点上游不同长度的启动子,分别为-1 218、-833、-428、-239 bp, 并与PGL-3基本载体连接。荧光分析表明,地塞米松靶向转录因子位于起始密码子转录起始位点上游的-1 218~-833 bp区间。
在哺乳动物中, CG双核苷酸通常以2种方式存在于基因组序列中,即分散于DNA序列中或者呈现高度聚集状态,后者就是CpG岛。DNA的甲基化主要发生在CG二核苷酸的胞嘧啶残基第5个碳原子上,是一种很重要的表观遗传学标记,虽然不改变基因的序列,但是能调控基因的表达。研究[14]认为,正常组织中70%~90%的CpG是甲基化的,而CpG岛则是非甲基化的,当启动子区的CpG岛被甲基化时,通常会抑制基因的表达。本研究发现, Nogo-A启动子区域没有CpG岛,提示Nogo-A基因的表达调控与CpG岛甲基化无关。
转录因子是基因调控网络的重要组成部分,通过特异性结合启动子和其他基因调控区域来调控基因表达。TRANSFAC数据库包含真核转录因子、转录因子序列及其与真核DNA结合位点的信息。Patch1.0软件是基于TRANSFAC数据库中的模型匹配,在1个序列中找到与模型匹配的位置,并对每个位置进行评分,以评价匹配的质量。PROMO 3.0.2软件可以从特定物种或物种群的DNA序列中识别潜在的转录因子结合位点,在预测时可以直接选择人类物种作为预测条件,在一定程度上可以降低结果的假阳性率。本研究采用Patch1.0程序和PROMO 3.0.2程序在TRANSFAC数据库中对Nogo-A基因启动子区序列进行了比较和预测。通过筛选本研究发现,一些潜在的转录因子,这将为地塞米松调控Nogo-A的机制研究提供理论基础和线索。在这些转录因子中, c-Jun是一种由JUN基因编码的蛋白质,其与神经再生密切相关。研究[15]表明, c-Jun在神经细胞的再生过程中能显著激活星形胶质细胞和小胶质细胞,而c-Jun的缺失降低了损伤后轴突再生的速度,大部分的切断轴突的重新连接受到抑制。c-Jun与Nogo-A调控的关系未来将进一步探讨。
