鲁中肉羊LHCGR基因突变与其产羔数关联分析
2020-11-25王翔宇田志龙潘林香王金文刘秋月胡文萍储明星
王翔宇,田志龙,潘林香,王金文,狄 冉,刘秋月,胡文萍,马 琳,储明星*
(1. 中国农业科学院 北京畜牧兽医研究所,农业农村部动物遗传育种与繁殖重点实验室,北京 100193;2. 济南市莱芜嬴泰农牧科技有限公司,山东 济南 271114;3.山东省农业科学院 畜牧兽医研究所,山东 济南 250100)
中国肉羊生产方式由放牧向舍饲转型过程中,多羔绵羊品种使用日渐增加。在多羔绵羊新品种培育中,产羔数性状尤为重要[1]。产羔数是低遗传力性状,通过控制多羔性状的遗传标记进行标记辅助选择育种可以加快该性状选择的遗传进展[2]。
哺乳动物的排卵是一个激素依赖的过程。排卵前,优势卵泡会受到促黄体素(luteinizing hormone, LH)峰的诱导排卵。排卵后,LH依然发挥重要作用,它通过维持黄体产生孕酮维持妊娠。如果LH作用的剂量和时间存在偏差将会导致不育。因此,其受体促黄体素受体(luteinizing hormone/choriogonadotropin receptor, LHCGR)在维持LH发挥正常生理功能中发挥重要作用[3]。LHCGR是G蛋白的经典受体,包含7个跨膜结构域和1个胞外激素结构域[4]。LHCGR主要发挥作用的部位是卵巢,卵巢壁细胞、间质细胞、卵泡发育后期的颗粒细胞以及黄体细胞中都检测到其表达[5]。绵羊LHCGR在绵羊的3号染色体上,有11个外显子。绵羊卵泡在发育排卵过程中,需要通过颗粒细胞上LHCGR接受促黄体素(luteinizing hormone, LH)进行优势卵泡的选择,它是优势卵泡产生的标记基因[3]。LHCGR对哺乳动物繁殖效率有不同影响,LHCGR上的突变有些产生了有害的表型,但有些却会产生令人意想不到的变化。研究表明,LHCGR敲除小鼠表现为不育[6]。人LHCGR突变会导致女性多囊卵巢综合征的发病几率增加[7]。LHCGR突变会降低奶牛超数排卵的效率[8]。绵羊中,FecB突变可以增加LHCGR的表达,从而降低了优势卵泡的凋亡,增加绵羊排卵数[9]。而对于LHCGR突变对绵羊繁殖效率影响的报道却不多见。
1 材料与方法
1.1 试验动物选择和DNA提取
从山东省莱芜市嬴泰有机农业科技有限公司随机收集具有产羔记录的384只鲁中肉羊颈静脉血,柠檬酸葡萄糖抗凝,-20 ℃保存备用。严格按照天根血液DNA试剂盒(天根公司,北京)说明进行试验绵羊血液样本DNA提取,使用Nano Drop2000检测DNA浓度,并通过1%琼脂糖凝胶电泳对DNA完整性进行检测。
1.2 引物设计
根据SNP位点序列信息,使用Sequenom公司的引物设计软件Assay design3.1,设计PCR反应和单碱基扩展引物并合成。
表1 用于SequenomMassARRAYSNP分型引物Table 1 The primer information for genotyping
1.3 基因分型
1.4 统计分析
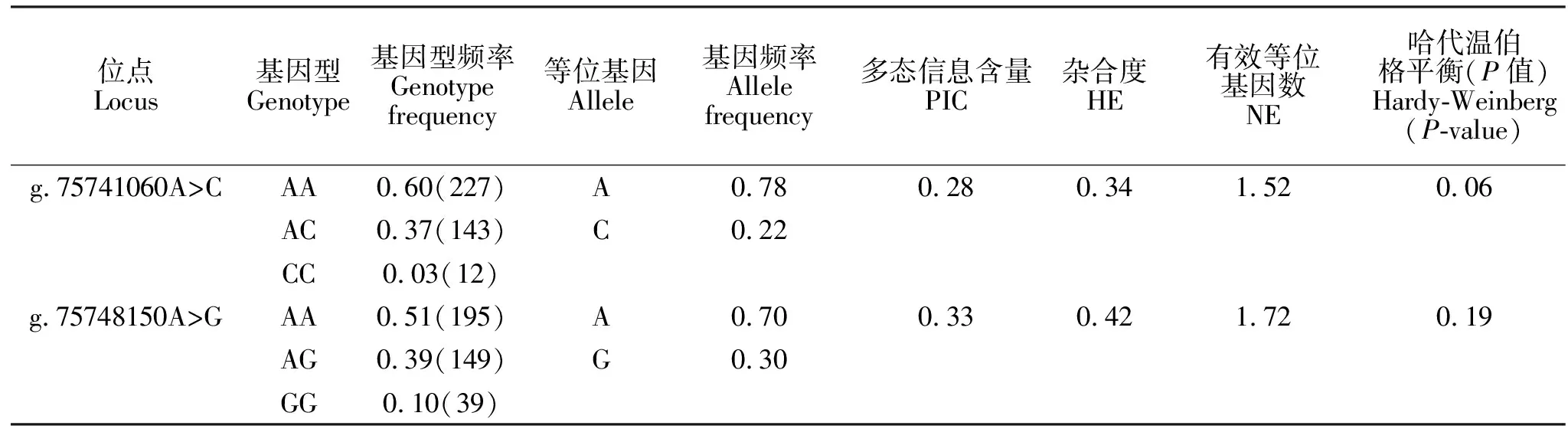
应用Microsoft Excel 2016软件统计绵羊LHCGR基因g.75741060A>C和g.75748150A>G位点的基因型频率、等位基因频率、有效等位基因数(Ne)、杂合度(He)和多态信息含量(PIC),随后对该群体不同SNP位点进行Hardy-Weinberg检测。
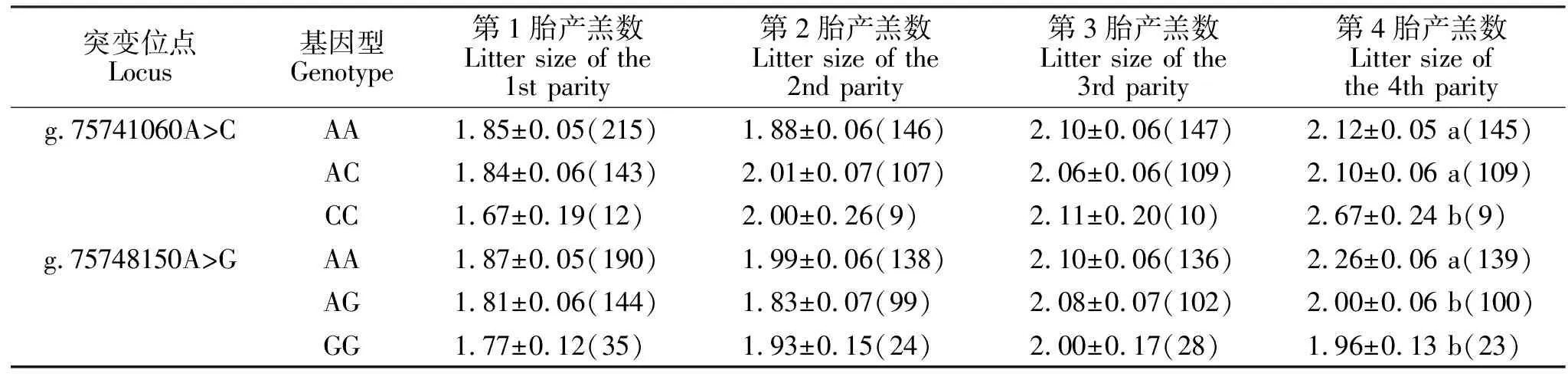
使用yijkl=μ+Si+Pj+Gk+eijkl模型进行鲁中肉羊产羔数和2个SNP关联分析。(yijkl:产羔数;μ:产羔数均值;Si:第i个季节效应;Pj:第j个胎次效应;Gk:LHCGR基因第k种基因型效应;eijkl:随机残差效应)。用SAS 9.0软件中GLM模型进行最小二乘分析,并对同一胎次中不同基因型差异进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。数据以“平均值±标准误”表示。
2 结果与分析
2.1 LHCGR基因多态性分析
从表2可知,在鲁中肉羊群体中,LHCGR基因g.75741060A>C和g.75748150A>G位点中AA均为优势基因型,A均为优势等位基因,这两个位点在鲁中肉羊群体中均表现为中度多态(0.25 由表3可知,LHCGR基因g.75741060A>C突变可以显著增加鲁中肉羊第4胎产羔数(P<0.05)。其中第4胎时,突变纯合CC型产羔数显著高于野生型AA和杂合子AC。g.75748150A>G的G突变可以降低鲁中肉羊的第4胎产羔数(P<0.05),该位点突变纯合型GG和杂合子AG的产羔数显著低于野生纯合型AA。 表2 鲁中肉羊LHCGR基因不同SNP位点群体遗传学分析Table 2 Population genetic analysis of g.75741060A>C and g.75748150A>G of LHCGR gene in Luzhong Mutton Sheep 表3 LHCGR基因不同位点各基因型与鲁中肉羊产羔数关联分析Table 3 Association analysis between different genotypes of two SNPs of LHCGR gene and litter size of Luzhong Mutton Sheep LHCGR突变在不同物种中对繁殖性状产生不同影响。在水牛[13]、大白和长白猪[14]以及济宁青山羊[15]的外显子中陆续发现了一些SNPs,但这些SNPs与繁殖性状没有关联。在人类的相关研究中发现,促进LHCGR蛋白功能的突变可以引起家族性男性性早熟;而抑制LHCGR功能的突变会引起女性的生育能力低下或者不育[5]。LHCGR突变可以改变奶牛对超数排卵的敏感性[16]。近年来,在对多羔品种的绵羊研究中,利用Ovine SNP50芯片对单羔和多羔绵羊进行GWAS分析发现,伊朗Lori-Bakhtiari绵羊的LHCGR基因上2个SNP位点与该品种多羔性状相关联,LHCGR是控制该品种多羔性状的主效基因[17]。在小尾寒羊中发现了2个突变位点,其中g.75741060A>C突变可以增加产羔数;而g.75748150A>G则会降低产羔数,这与本试验中这两个位点对鲁中肉羊产羔数的影响一致[11]。LHCGR基因g.75741060A>C和g.75748150A>G在鲁中肉羊群体中都处于Hardy-Weinberg平衡状态(P>0.05),有一定频率的杂合子。该群体的这两个位点没有经历选择。与本试验室先前多羔小尾寒羊群体中这两个突变的频率[11]相比,鲁中肉羊g.75741060A>C突变纯合子CC的频率低于小尾寒羊,g.75748150A>G中GG频率高于小尾寒羊。因此,想要在多羔鲁中肉羊的培育过程中提高产羔数,需要增加g.75741060A>C中CC频率,减少g.75748150A>G中GG频率。 LH在排卵前脉冲式增加会激活成熟卵泡卵泡膜和颗粒细胞上的LHCGR形成独特的转录复合物,以触发多条细胞内信号传导途径,从而介导一系列排卵相关基因的表达[18]。壁颗粒细胞和排卵前卵泡的卵泡膜细胞中LHCGR的mRNA和LHCGR蛋白表达水平比卵丘细胞高一个数量级,其中LHCGR表达被卵母细胞衍生的信号抑制[6]。因此,适当LHCGR的表达水平对LH精准发挥其在卵巢中调控排卵前类固醇激素生成、排卵、黄体形成和黄体细胞类激素生成等一系列功能至关重要[19]。LHCGR基因上既存在降低LHCGR表达量的突变,也存在增加LHCGR表达量的突变。在绵羊中,LHCGR基因主要通过增加表达量,提高绵羊产羔数。通过对高繁殖力母羊的研究发现,具有高繁基因的母羊卵泡在较小直径即可以响应LH变化。在小卵泡(直径1~3 mm)和中等卵泡(直径3~4.5 mm)的颗粒细胞中,具有高繁突变绵羊LHCGR基因的mRNA表达量高于野生型[20]。有研究表明,在含有Booroola和Inverdale基因的多羔绵羊中,LHCGR表达量在优势卵泡选择的关键时期显著高于单羔绵羊[21]。在对单、多羔湖羊卵巢组织甲基化状态的研究中发现,高产羔数的湖羊LHCGR部分区域的去甲基化状态显著高于单羔湖羊,说明高产羔数的湖羊LHCGR表达量较高[22]。LHCGR特异地在多羔小尾寒羊卵巢中表达[23]。因此,在鲁中肉羊中检测到g.75741060A>C的突变可能是增加了LHCGR在卵巢中的表达量,从而提高了LHCGR对于LH敏感性进而增加鲁中肉羊产羔数。 鲁中肉羊群体中g.75741060A>C突变可以增加产羔数,g.75748150A>G却降低产羔数,因此,在今后的育种过程中需要通过人工选择,增加g.75741060A>C位点C的频率,降低g.75748150A>G位点G的频率,从而辅助多羔鲁中肉羊的培育。而对于g.75741060A>C突变是否通过增加LHCGR基因的表达量增加产羔数的分子机制还需要进一步验证。2.2 LHCGR基因突变位点与鲁中肉羊产羔数的关系
3 讨 论
4 结 论
