苜蓿种植年限对土壤硝化潜势和氨氧化微生物丰度的影响
2020-11-21张耀全罗珠珠牛伊宁李玲玲蔡立群谢军红
张耀全,马 欣,罗珠珠,,牛伊宁,李玲玲,蔡立群,,谢军红
(1.甘肃农业大学资源与环境学院,甘肃 兰州 730070;2.甘肃省干旱生境作物学省部共建国家重点实验室,甘肃 兰州 730070)
紫花苜蓿(MedicagosativaL.)是豆科苜蓿属多年生草本植物,是西部黄土高原退耕还林的主要草种[1],它不仅耐贫瘠,产量高[2],而且具有土壤改良、培肥地力、植物修复等众多生态功能。苜蓿的根瘤可以固定空气中的游离氮,从而增加土壤氮素含量,同时苜蓿地上部枯枝落叶及地下部凋亡的须根可以经微生物分解增加土壤有机碳含量,改善土壤质量[3]。有研究发现苜蓿在水土保持方面也有着重要作用,主要是因为苜蓿在生长期间可以完全遮蔽地表,提高表层土壤抗冲蚀的能力,并且其根部深入土壤,能提高土壤聚合力,从而达到减少土壤侵蚀,防止土壤质量退化的目的[4-7]。我国西北黄土高原地区属干旱半干旱气候,降雨量少,地表植物稀疏,土壤肥力低下,沟壑纵横,长期以来土壤水蚀非常严重,生态环境极度脆弱[8]。紫花苜蓿由于抗逆性强,长期以来一直是该地区生态恢复的首选牧草,在生态环境修复、土壤结构改善及土壤肥力提升方面发挥着重要作用。

目前,关于西部黄土高原紫花苜蓿的研究大都集中在不同种植年限苜蓿的水分效应[5,20-21]、地上生物量[2,6]、温室气体排放[22]等方面,而关于土壤微生物介导的养分循环过程相对较少,特别是氮素转化的关键步骤——氨氧化过程研究几乎未见报道。苜蓿种植可以提高土壤氮固存,但土壤氮增加达到峰值的年限因研究区域不同而异。有研究表明种植苜蓿的第3年固氮作用开始体现,随着种植年限的延长苜蓿的固氮量增加[23]。紫花苜蓿种植前5 a为土壤全氮增长期,之后土壤全氮含量就开始降低,总体呈现出周期变化[24]。邰继承等[25]研究认为土壤全氮含量因苜蓿种植年限的延长而逐渐增加,但其增长率是随着年限的增加而降低的。徐艳霞等[26]研究认为,苜蓿草地土壤氮素含量在生长旺盛期呈下降趋势,在衰败期呈现逐渐增加的趋势。这些在特定的气候条件和土壤条件下得出的结论表明,气候和土壤质地等环境条件不同,种植年限对苜蓿草地土壤氮素的影响也不尽相同,但这些研究均未从影响土壤氮素循环转化的微生物角度进行探讨。因此,本研究以生长旺盛期(L2012)和衰退期(L2005和L2003)的紫花苜蓿为研究对象,通过探讨苜蓿由盛转衰后其土壤全氮、硝(铵)态氮、硝化潜势以及氨氧化微生物丰度的变化趋势,以期明确种植年限对影响土壤氮素转化的微生物学机制,亦可为黄土高原苜蓿适宜种植年限的确定提供理论依据。
1 材料与方法
1.1 试验地概况
试验设置在甘肃省定西市李家堡镇麻子川村的甘肃农业大学旱作农业综合试验站(104°44′ E,35°27′ N),于2012年实施。该站地处黄土高原中部,属于典型的雨养农业区,年均太阳辐射592.9 kJ·cm-2,全年光照2 476.6 h,年均气温6.4℃,≥0℃年积温2 933.5℃,≥10℃年积温2 239.1℃;无霜期140 d,年均降水400 mm,年蒸发量1 531 mm。土壤类型为黄绵土。土壤容重(BD)、有机碳(SOC)、全氮(TN)、全磷(TP)、全钾(TK)及pH值等基础理化性质见表1。
1.2 试验设计
所选品种为当地传统品种陇东苜蓿,试验共设3个处理,分别为2003年(L2003)、2005年(L2005)、2012年(L2012)建植的紫花苜蓿,各小区面积均为3 m×7 m=21 m2,3次重复,种植期间未施肥灌水,各处理田间管理保持一致,每年刈割2次(6月和9月)。
1.3 土壤样品采集
于2018年5月20日,采集苜蓿头茬花期0~30 cm土层土壤,各小区均采用传统五点取样法采集土壤样品,将样品混匀后,装入灭菌自封袋,干冰保存,及时带回实验室,将土样分为3部分,一部分放入-80℃冰箱用于氨氧化微生物丰度的测定,一部分鲜土保存在4℃冰箱中,测定硝态氮、铵态氮含量及硝化潜势,剩余土样风干后测定土壤全氮含量。
1.4 指标测定
1.4.2 土壤硝化潜势的测定 土壤硝化潜势(Nitrification potential,NP)测定采用氯酸盐抑制法[19]。称取5 g鲜土并加入20 mL含1 mM (NH4)2SO4的磷酸盐缓冲液,并加入少量0.2 mol·L-1KClO3溶液,抑制亚硝酸盐的氧化;将其放入恒温震荡培养箱中遮光培养24 h后,加入10 mL的2 mol·L-1KCl溶液浸提土壤并震荡1 h,过滤,滤液用来测定亚硝态氮含量,显色剂为N- (1-萘基) -乙二胺,用紫外分光光度计于540 nm波长下测定,单位时间内土壤中增加的亚硝态氮含量即为硝化潜势。
1.4.3 氨氧化微生物丰度的测定 由上海美吉生物医药科技有限公司进行氨氧化微生物丰度测定,共使用2对引物Arch-amoAF/Arch-amoAR[27]和AmoA-1F/AmoA-2R[28],如表2,PCR 采用TransGen AP221-02:TransStartFastpfu DNA Polymerase,PCR仪为ABI7500 型荧光定量 PCR 仪。PCR反应体系(20 μL):2×PCR mix 10 μL,上、下游引物(5 μmol·L-1)各0.8 μL,模板1 μL,补足dd无菌H2O至20 μL。PCR反应条件:预变性,95℃,5 min;变性,95℃,45 s;退火,58℃(AOA),60℃(AOB),30 s;延伸,72℃,1 min,35个循环。完成上述步骤后,把加好样本的96孔板放在ABI 7500型荧光定量PCR仪中进行反应。共设3个平行实验,以无菌水为空白阴性对照。
1.5 数据处理与分析
数据整理及作图用Excel 2010完成,显著性差异和相关性分析采用SPSS 22.0完成。
2 结果与分析
2.1 不同苜蓿种植年限对土壤硝化潜势的影响
硝化作用将氨氧化成亚硝态氮以及硝态氮,硝化潜势可表征其硝化速率。不同种植年限苜蓿土壤硝化潜势如图1所示。种植年限显著影响苜蓿土壤的硝化潜势,L2012处理土壤硝化潜势最高,为0.05 μg·g-1·h-1,随苜蓿种植年限延长,土壤硝化潜势逐渐降低。统计结果分析显示,L2012处理硝化潜势显著高于L2003和L2005处理(P<0.05),增幅达25%。
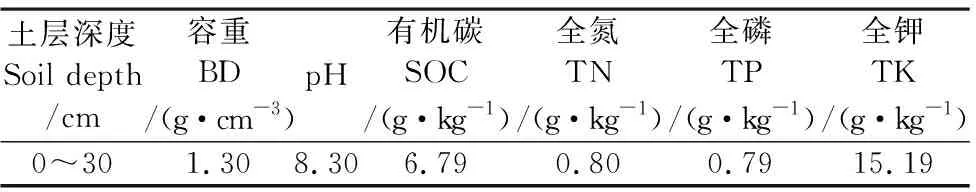
表1 土壤基础理化性质Table 1 Basic physical and chemical properties
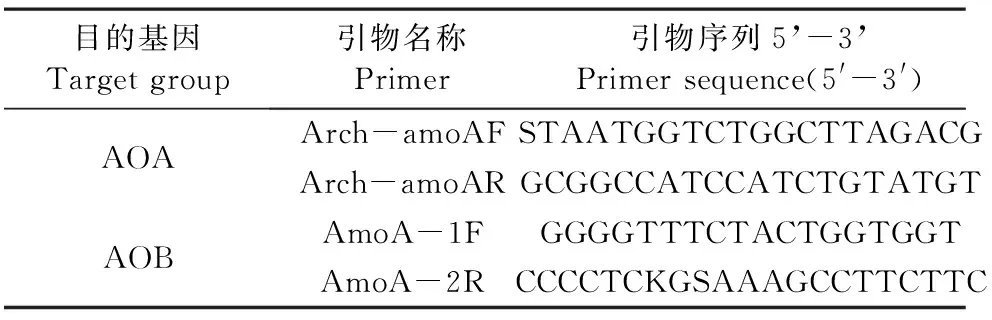
表2 目标基因的引物名称及引物序列
2.2 不同苜蓿种植年限对土壤全氮、硝态氮和铵态氮的影响
不同种植年限苜蓿土壤全氮、硝态氮及铵态氮含量如表3。延长苜蓿种植年限可以提高表层土壤中的全氮及硝态氮含量,且随苜蓿种植时间延长,土壤全氮、硝态氮差异显著。其中L2003处理和L2005处理土壤全氮含量显著高于L2012处理(P<0.05),分别高15.69%和11.76%;L2003处理和L2005处理硝态氮含量较L2012处理增加59.73%和33.62%。土壤铵态氮则对苜蓿种植年限没有明显的响应。
2.3 不同苜蓿种植年限对氨氧化微生物丰度的影响
不同种植年限苜蓿土壤中AOA基因拷贝数为9.75×106~12.68×106个·g-1,AOB基因拷贝数为5.01×106~7.70×106个·g-1,且各处理中AOA丰度均高于AOB(图2)。在表层土壤中,AOA丰度随种植年限延长显著增加(P<0.05),L2003和L2005处理AOA丰度较L2012处理分别增加30.26%和22.05%;AOB丰度随苜蓿种植年限延长先升高后降低,L2005处理AOB基因拷贝数显著高于L2003处理和L2012处理(P<0.05),增幅分别为44.74%和53.69%;AOA∶AOB的比值为1.55~2.38,呈现出先降低后增加的趋势。综合来看,随着苜蓿种植年限的增加,AOA和AOB的丰度均呈增加趋势,其比值呈现出先降低后增加的变化趋势。
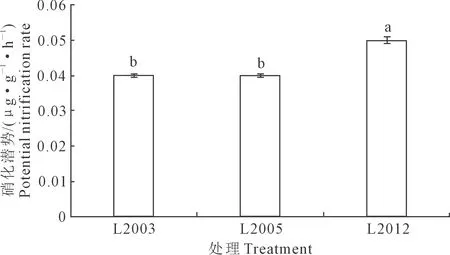
注:不同字母代表差异显著(P<0.05)。Note: Different letter represent significant differences among treatments (P<0.05).图1 不同苜蓿种植年限对土壤硝化潜势的影响Fig.1 Effects of different alfalfa planting years onsoil potential nitrification rate
2.4 土壤氨氧化微生物丰度与氮素、硝化潜势的相关性分析
土壤氨氧化微生物丰度与氮素、硝化潜势的相关分析表明(表4),氨氧化古菌(AOA)丰度受到土壤硝化潜势(r=-0.802)、全氮(r=0.853)和硝态氮含量(r=0.833)共同影响,其中土壤硝化潜势与全氮含量、AOA丰度呈极显著负相关(P<0.01),与土壤硝态氮呈显著负相关关系(P<0.05);土壤全氮与AOA丰度呈极显著正相关(P<0.01),与硝态氮含量具有显著正相关关系(P<0.05);氨氧化细菌(AOB)丰度与土壤理化性质没有明显的相关性。

表3 不同苜蓿种植年限对土壤全氮和硝、铵态氮的影响
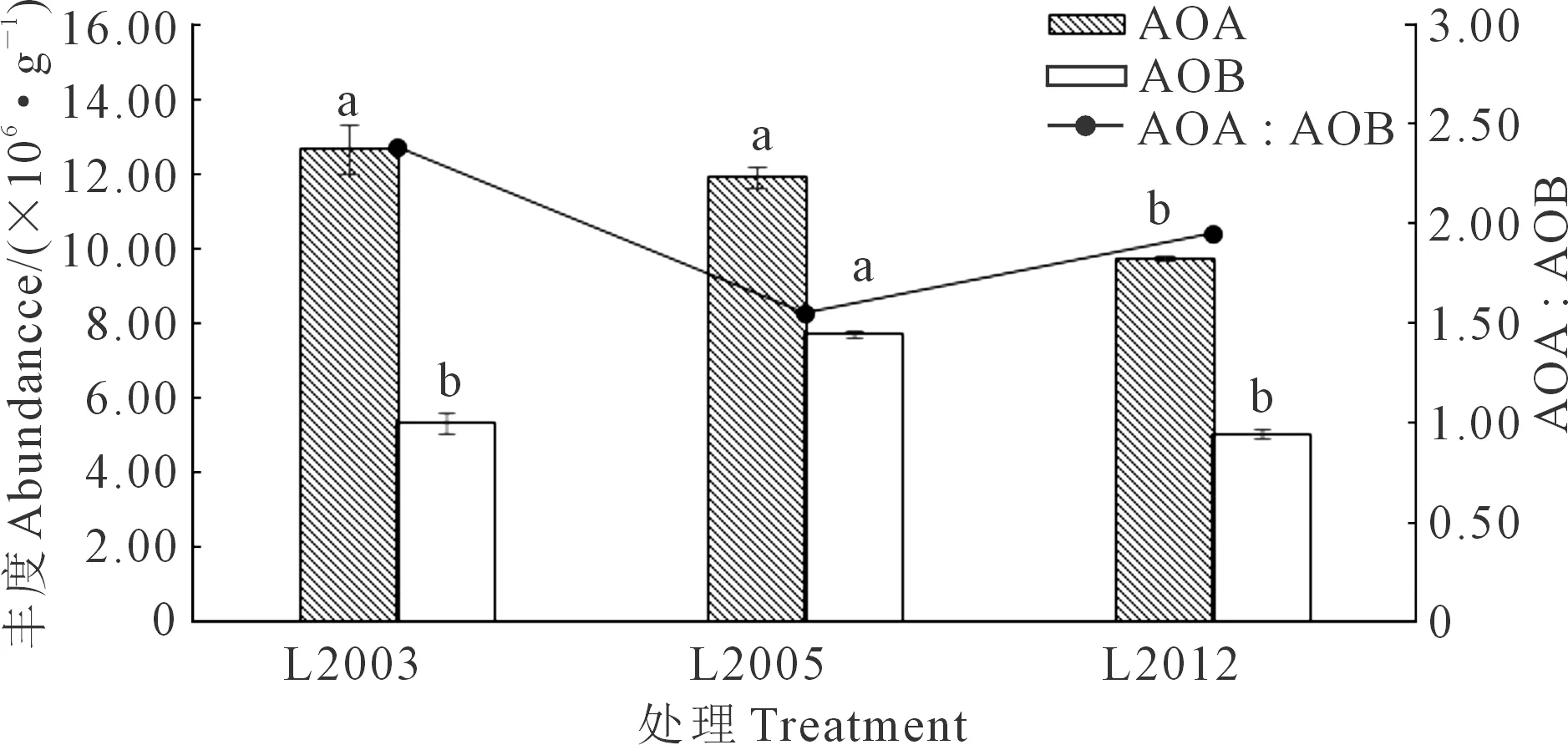
注:同一指标不同字母表示处理间差异显著(P<0.05)。Note: Different letters in the same index indicate significant differences among treatments (P<0.05).图2 不同苜蓿种植年限对土壤AOA和AOB丰度的影响Fig.2 Effects of different alfalfa planting years onsoil AOA and AOB abundance

表4 土壤氨氧化微生物丰度与土壤氮素、硝化潜势相关分析
3 讨 论
土壤微生物是土壤生态系统中的重要组成部分,在土壤物质循环、有机物的合成和分解、土壤质量改善、土壤肥力的提升以及作物的生长和病虫害防治等方面均发挥重要的作用[35]。氨氧化微生物是参与硝化作用的最主要微生物,是硝化过程的第一步,也是限速步骤,其丰度与氮素形态及土壤pH显著相关[9,12,15]。北方碱性土壤中,氨氧化细菌是硝化作用的主要驱动者,而南方酸性土壤中,硝化作用则主要由氨氧化古菌主导[36-38]。这些结果一致证实了AOA和AOB生态位分异的特征,AOB倾向于在高氮pH值中性或碱性的环境中起主导作用,而AOA则更适宜于在酸性及低氮高的土壤中占主导优势[39-40]。本试验研究发现,黄土高原半干旱雨养区苜蓿土壤AOA丰度显著高于AOB,说明由于土壤低氮环境使得AOA演变为优势类群。本研究相关分析发现,硝化潜势和AOA丰度呈显著负相关,而与AOB并无明显相关关系。这表明黄绵土区苜蓿土壤硝化潜势变化与氨氧化微生物丰度变化并不一致,也说明氨氧化微生物群落丰度与其活性之间存在不一致的关系。据此可以推断,除了AOB和AOA这2类半程氨氧化微生物之外,还存在其他类型的氨氧化微生物主导着黄绵土区苜蓿土壤的硝化过程,因为已有研究发现,属于硝化螺菌门谱系Ⅱ的全程氨氧化微生物(Comammox)广泛分布于农业土壤、森林土壤、稻田水域、淡水等自然环境中,其对底物NH3的亲和力远高于大多数可培养的AOA物种,能够更好地适应极低 NH3浓度的胁迫环境[41]。
4 结 论
黄土高原半干旱区长期种植苜蓿后,土壤氨氧化古菌(AOA)数量显著高于氨氧化细菌(AOB),土壤氮素含量显著影响AOA丰度,这表明黄土高原半干旱区苜蓿土壤氨氧化微生物AOA占主导地位,且对长期种植苜蓿后土壤理化性质的改变更为敏感。种植苜蓿会增加土壤氮素含量,年限显著影响着土壤硝化潜势。但是,土壤硝化潜势由于受多种环境因子的调控,相关分析结果并不能确定主导土壤硝化作用的优势微生物类群。
