三氯苯达唑:治疗人片形吸虫病的有效药物
2020-11-18李素君白秋江
李素君 白秋江
(南京大学医学院附属泰康仙林鼓楼医院药剂科,江苏南京 210046)
片形吸虫病是片形吸虫感染引起的一种人兽共患寄生虫病。片形吸虫主要寄生于牛、羊等哺乳动物。感染人体的片形吸虫主要为肝片形吸虫Fasciolahepatica和巨片形吸虫Fasciolagigantica(周岩等,2018)。据估计全球约有240万人感染片形吸虫,其中超过1.8亿人面临感染的风险(World Health Organization,2006)。硫双二氯酚(bithionol)曾被广泛使用,因疗程长,耐受性差,治愈率低,不再使用。吐根素(emetine)由于治疗选择有限、心脏毒性导致的安全问题,目前也不再使用。大多数常见的驱虫药吡喹酮效果不佳,甲苯达唑、阿苯达唑几乎没有疗效,青蒿琥酯也无效。硝唑尼特(nitazoxanide)可考虑作为二线选择,但治愈率较低,需更长时间,费用更高(李文杰等,2001;Gandhietal., 2019)。三氯苯达唑(Triclabendazole, TCZ)是80年代瑞士汽巴—嘉基制药有限公司生产的一种新的苯并咪唑化合物。已证明TCZ对动物体内肝片形吸虫的各期幼虫和成虫均有良好的杀虫效果,自1983年以来一直在兽医中广泛用作全身驱虫药物(Brennanetal., 2007)。当治疗人吸虫病其他待选药物无效时,1986年TCZ作为替代药物首次在临床中使用(Keiseretal., 2005)。1997年埃及注册可供人类使用,2004年以来WHO与诺华制药ASG达成协议,向申请国家免费提供TCZ用于肝片吸虫病的控制,并取得良好治疗结果(World Health Organization,2006)。许多病例报告和临床试验显示,TCZ治疗成人和儿童感染肝片吸虫病的急性和慢性感染阶段均具有很高的疗效。TCZ经历了漫长实践(图1),在2019年2月13日,美国FDA批准TCZ(Egaten)上市,用于治疗6岁以上的片形吸虫病(fascioliasis)患者。Egaten成为FDA批准的首个针对这种疾病的治疗药物。本文在此就该药作用机制、药代动力学、临床研究及合理使用等进行介绍。
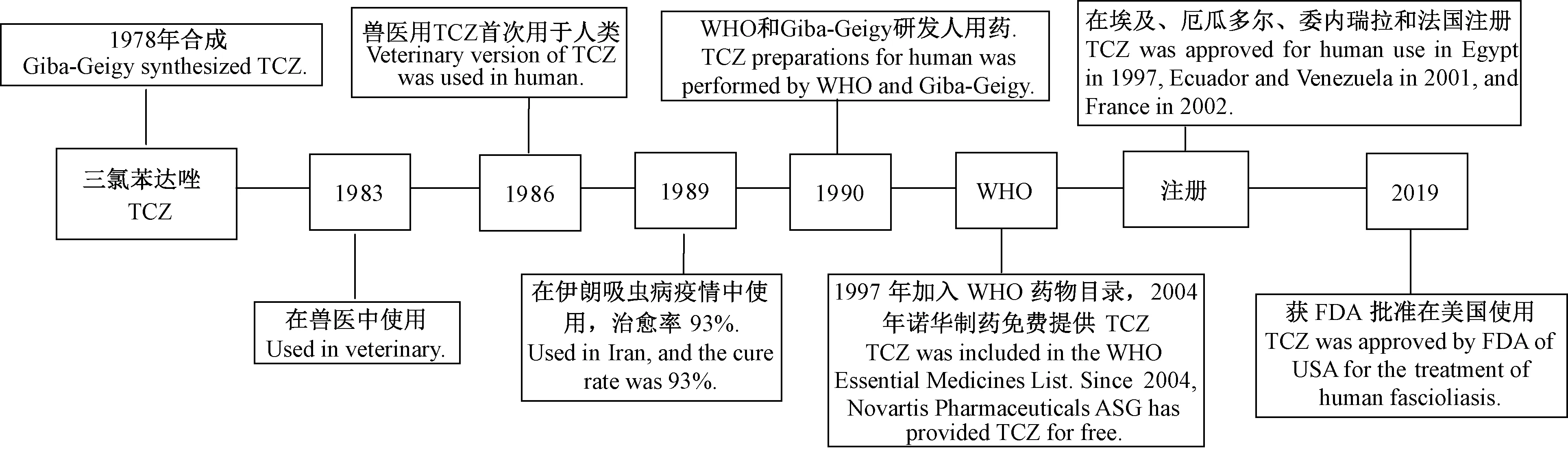
图1 三氯苯达唑(TCZ)的发展史
1 作用机制
TCZ对片形吸虫的作用机制目前尚未完全阐明。体外和/或感染动物的研究表明,TCZ及其活性代谢物(亚砜和砜)可被未成熟和成熟的蠕虫的皮层吸收,导致静息膜电位降低,从而抑制微管蛋白功能以及蛋白质和酶的合成(李文杰等,2001;Kelleyetal., 2016)。对皮层、卵黄和睾丸形态学研究表明,用活性亚砜代谢物处理后,TCZ可能会与β-微管蛋白分子结合从而扰乱微管功能。例如,卵黄和生精细胞的有丝分裂受到抑制;被膜(吸虫的外层)的运输过程中断,导致被膜表面逐渐严重受损,最终导致被膜完全丧失。此外还观察到被膜合胞体内微管蛋白免疫染色的丢失。结果表明,微管蛋白消失反过来又会阻止分泌体从细胞体移动到被膜表面。这一过程对于维持表面膜的完整性至关重要,它的破坏可以解释严重形态变化(Brennanetal., 2007)。研究发现在TCZ作用后的肝片吸虫细胞核内染色质凝集,核仁消失,RNA 合成下降,核糖体减少,抑制成虫初级精原细胞的分化,阻止精母细胞和精子的形成,因此提出TCZ的作用机制是抑制虫体内蛋白质合成(李文杰等,2001)。
2 药动学
2.1 吸收
片形吸虫病患者口服单剂量的TCZ(10 mg/kg),与560 kcal食物同服,TCZ、TCZ亚砜代谢物和砜代谢物的Cmax分别为1.16、38.6和2.29 μmol/L,AUC则分别为5.72、386和30.5(μmol·h)/L;TCZ和亚砜代谢物的Tmax为3~4 h。食物可使本品Cmax和AUC分别增加约3倍和2倍;TCZ亚砜代谢物Tmax由禁食2 h变为进食后4 h(El-Tantawyetal., 2007;Triclabendazole-dynamed,2020)。
2.2 分布
进食状态下本品亚砜代谢物的表观分布容积(Vd)约为1 L/kg。人血浆中TCZ、亚砜代谢物和砜代谢物的蛋白结合率分别为96.7%、98.4%和98.8%(Triclabendazole-drugbank,2020)。
2.3 代谢与排泄
基于体外研究,TCZ主要由CYP1A2(约64%)代谢为其活性亚砜代谢物,并且少量由CYP2C9、CYP2C19、CYP2D6、CYP3A和FMO代谢。亚砜代谢物进一步主要由CYP2C9代谢成有活性的砜代谢物,且部分由CYP1A1、CYP1A2、CYP1B1、CYP2C19、CYP2D6和CYP3A4代谢。在人体内,TCZ、亚砜和砜代谢物的t1/2分别约为8、14和11 h(Triclabendazole-dynamed,2020)。
没有人类排泄TCZ的相关数据。在动物中,90%的TCZ与亚砜和砜代谢物通过胆道排泄,仅10%经尿液中排出(Triclabendazole-drugbank,2020)。
3 临床试验
一项随机试验纳入165例患有片吸虫病的患者,10~65岁,随机分组口服TCZ 10 mg/kg,用药1、2或3 d(分别为单剂量、双剂量和三剂量组)。治疗7 d后,3个治疗组的临床体征和症状明显缓解。在单剂量和双剂量组中,粪检无片形吸虫虫卵排出。第14和30 d,三剂量组仍有2例患者的粪便中检测出虫卵;进行第2疗程,给予单剂量TCZ 10 mg/kg,治疗30 d后,未在粪便中发现虫卵。所有患者在第60 d治愈。60 d的治愈率高于治疗30 d的(P=0.07)。三个剂量组的治愈率无显著差异(P> 0.05)。未发现中毒性肝炎病例。试验表明口服给予1~3 d 10 mg/kg的TCZ治疗人片吸虫病是安全有效的(Talaieetal., 2004)。
一项为期60 d的开放性2期多中心临床试验,84例片吸虫病的患者,2~16岁,分为2组,Ⅰ组(n=44)给予TCZ 15 mg/kg,分两次服用,间隔12 h;Ⅱ组(n=40)给予TCZ 10 mg/kg,单次给药。第I组治愈为100%;第Ⅱ组有2例存在肝脏感染(2/40; 5%),治愈率为95%(38/40);接着用相同的剂量后治愈,即第2次给药后有效率为100%。第60 d,在粪便检测中所有患者均没有发现虫卵。试验表明了TCZ有效且耐受性好,并且可能是该区域的最佳治疗方案(Macoetal., 2015)。
在古巴、玻利维亚、秘鲁、智利和伊朗进行的6项非随机、开放性研究,245例成人和儿童患者,粪便证实患有片吸虫病。所有研究在设计上都相似。给予TCZ 5~20 mg/kg,第1~3 d服用。治愈的标准是参考Kato-Katz方法,即最初呈阳性的患者经治疗后,第60 d粪便中未检测出片形吸虫虫卵。TCZ具有剂量依赖性,具体而言,20 mg/kg组第60 d治愈率最高95.5%(95% CI(77%,100%)),15、10、5 mg/kg治愈率分别为88%(95%CI(64%,99%)),80%(95%CI(73%,86%))和50%(95%CI(27%,73%)),明显高于对照组22%(95%CI(9.8,38.2))(Triclabendazole-drugbank,2020)。
肝片吸虫被认为是我国动物和人类片吸虫病的主要病因,1999年以前共记录了204例人感染片吸虫病例。Chen等(2013)描述了云南省暴发的一起人片吸虫病疫情,回顾了29例患者的完整临床记录,来自2011年12月以来住院的患者,发热,嗜酸性粒细胞增多症,表现为肝脏病变(如肝肿大、肝痛、上腹压痛或超声检查病变)。给予广谱抗寄生虫药物,如阿苯达唑、甲苯咪唑、左旋咪唑、吡喹酮、蒿甲醚等均未能治愈。改口服TCZ 10 mg/kg,连续2 d。生化及细胞指标虽未立即恢复正常,但治疗后4~5 d CRP、AST、WBC等生化及细胞指标均有明显改善,体温恢复正常,感染得到了令人满意的控制。治疗期间患者没有报告由于TCZ药物引起的明显副作用。少数患者主诉下肢发炎和麻木。然而,使用其他驱虫药和/或激素治疗可能是导致上述不适的原因。
2020年1月14日申请一项IV期、多中心、开放性研究,考察TCZ安全性、耐受性和临床疗效。该研究将招募约300例患有急性(≥15%)或慢性片吸虫病的成人和儿童受试者(≥6岁)。入选受试者给与两次TCZ(10 mg/kg),间隔12 h。主要终点指标:观察90 d内不良事件,严重不良事件和死亡率;次要结局是观察急、慢性患者的临床治愈率。这一项新开启的试验进一步提示我们TCZ在治疗片吸虫病方面的重要性(US National Institutes of Health,2020)。
4 合理用药使用评价
对于6岁及以上的片吸虫病的患者,TCZ推荐剂量10 mg/kg,间隔12 h。可与食物同服,可整个吞服或分成两半,用水或压碎并与苹果酱一起服用,压碎片剂可稳定长达4 h;临床治疗有效,且单疗程大剂量的治愈率高,耐受性好(李文杰等,2001;张伟娜等,2019);循证推荐强度为I级,证据强度是B类。不能排除胎儿风险,孕期、哺乳期慎用TCZ。使用TCZ可延长QT间隔,监测有QT延长病史或正在服用延长QT间隔药物的患者的心电图(Triclabendazole-dynamed,2020)。
TCZ的不良反应轻微,为恶心、呕吐、虚弱、瘙痒、上腹部疼痛或肝脏肿大、头痛、头晕和眩晕等,其中瘙痒和皮疹可能与肝片吸虫病有关,因为它们通常发生在感染患者中。(Talaieetal., 2004;Gandhietal., 2019)。TCZ最常见不良事件为胆绞痛,在第2 d后严重程度逐步降低;患有严重胆绞痛的病例在2 h内给予解痉药,症状缓解,不需要进一步的医疗措施(Macoetal., 2015);其不良事件与肝胆系统排出死亡或垂死的吸虫有关(Gandhietal., 2019)。
TCZ是治疗人和牲畜片形吸虫病的唯一特效药,被广泛用于动物。因此,TCZ耐药性的出现,对耐药性虫株的鉴定、耐药性产生的机制和预防也成为片形吸虫治疗研究的重点。目前,对TCZ的抗性机制尚不清楚,其耐药性机制可以是多因素的,包括药物摄入/排出机制,靶分子和药物代谢物的改变(Kelleyetal., 2016)。目前尚未确定TCZ耐药性对人体的临床意义。Wilkinson等(2012)提出了P-糖蛋白基因中的T687G单核苷酸多态性(SNP)作为肝片吸虫中TCZ 抗性的分子标记。Elliott等(2014)对来自澳大利亚的TCZ易感和TCZ抗性群体进行了P-gp基因的分析,以确定SNP是否是TCZ抗性的标记,得出该P-gp基因中的T687G SNP与这些澳大利亚肝片吸虫群中的TCZ耐药性无关。研究表明肝吸虫可能出现TCZ耐药来自类似的β-微管蛋白同种型变体选择机制。黄素单加氧酶酶系统是TCZ的主要代谢途径,其改变药物代谢的作用比细胞色素P450酶系统更重要(Brennanetal., 2007)。
5 药物相互作用
体外数据表明同时使用TCZ可能会升高CYP2C19底物的血药浓度。基于TCZ的短消除半衰期和短治疗持续时间,合用CYP2C19底物浓度的升高是短暂的。建议对CYP2C19底物的全身暴露量进行监测,如果在给予TCZ期间CYP2C19底物的血药浓度升高,则在停止TCZ治疗后重新检查CYP2C19底物的血药浓度(Triclabendazole-drugbank,2020)。
TCZ可延长QT间隔,故避免与其他能延长QT间期药物合用,如胺碘酮、西沙比利、西酞普兰等,具体可参考drug数据库(Triclabendazole-drugs,2020)。
6 小结
我国云南、广西等省有TCZ治疗吸虫病的病例报道,具有良好疗效,深受临床医生的青睐。TCZ与其他抗蠕虫药物相比用药剂量小、疗程短、毒副作用小、无致畸致突变作用、对片吸虫的各期幼虫均具有很好的杀虫效果,且杀虫谱较窄,使用十分安全方便,是治疗片形吸虫病的特效药。但值得注意的是,TCZ也有耐药性的报道,澳大利亚、荷兰等国均发现牲畜感染对TCZ耐药的片形吸虫,提示我们要警惕并预防该药物的耐药性问题(Ashrafietal., 2014)。新近通过吸虫病基因学的研究正在努力改善本品的耐药性,不过TCZ的耐药性并未影响其地位,目前TCZ仍被认为是对片形吸虫的最有效治疗药物(Hodgkinsonetal., 2018)。
